抗菌肽LL-37通过激活p53信号通路诱导胃癌AGS细胞凋亡
2021-04-09欧宏宇朱海宏朱文君贺贝贝吴世乐
欧宏宇,朱海宏,朱文君,贺贝贝,吴世乐
胃癌(gastric cancer,GC)是世界第6大常见恶性肿瘤,其病死率高居各类恶性肿瘤的第3位,且5年生存率低于30%。由于GC早期症状不明显,超过80%的患者确诊时就是中晚期,而中国是GC高发地区,每年新增病例数占全球40%~50%,其防治形势相当严峻。因此,了解GC相关发病机制,寻找潜在治疗靶点,对改善GC治疗、提高预后具有重要意义。抗菌肽LL-37是一种由前体蛋白hCAP-18水解产生的C端肽,具有抗菌和免疫调节功能,在慢性感染、炎症反应、伤口愈合、组织再生、肿瘤等方面发挥重要的生理功能。LL-37是人体内唯一的抗菌肽,其异常表达与肿瘤发生有关,但有关其在肿瘤中的功能目前研究甚少。有研究表明,LL-37在幽门螺杆菌感染患者胃上皮组织和胃分泌物中显著上调,而在萎缩性胃炎向胃腺癌进展过程中表达逐渐降低。Wu et al研究表明,LL-37在GC组织中低表达,并通过蛋白酶体依赖机制激活骨形成蛋白信号通路来抑制GC细胞增殖。据此推测,LL-37可能作为抑癌基因参与胃癌发生发展进程,然而有关LL-37在胃癌中更多的功能作用目前鲜有报道。该研究拟采用外源LL-37干预GC细胞,探讨LL-37对GC细胞凋亡的影响并初步阐明其可能机制,为GC靶向治疗提供更多理论基础。
1 材料与方法
1.1 试剂与仪器
人胃癌AGS细胞系购自中国典型培养物保藏中心细胞库;胎牛血清及RPMI-1640培养基购自美国Gibco公司;PrimeScriptRT reagent Kit和TB GreenPremix
Ex
Taq
Ⅱ试剂盒购自大连宝生物工程有限公司;Annexin V-FITC细胞凋亡检测试剂盒和辣酸根过氧化物酶(HRP)标记的山羊抗兔或抗小鼠IgG二抗均购自上海碧云天生物技术有限公司;噻唑蓝(MTT)购自北京索莱宝科技有限公司;p53 siRNA干扰质粒及其阴性对照质粒购自汉恒生物科技上海有限公司;p53、Cleaved-caspase-3、PUMA、Bcl-2、Bax、GAPDH和Histone H3等抗体均购自美国Cell Signaling Technology公司。1.2 细胞培养
取出液氮冻存的人胃癌AGS细胞,添加至含有10%胎牛血清的RPMI-1640培养基中,置于37 ℃、5% CO的细胞培养箱中培养,根据细胞生长状态,每隔2~3 d传代1次。1.3 MTT实验
取对数生长期的AGS细胞,调整细胞密度,以2×10个/孔接种于96孔板,待细胞完全贴壁后,分别加入终浓度为0、10、20、40 μmol/L的LL-37溶液,每个浓度设置3个复孔,置于细胞培养箱中继续培养24 h。避光条件下,每孔加入10 μl MTT溶液(5 mg/ml)继续培养4 h,去掉培养液,每孔加入150 μl二甲基亚砜(DMSO),低速振荡15 min,采用酶标仪检测各孔在490 nm波长处吸光度(opitcal density,OD)值,以OD490值表示细胞增殖活性,并计算半抑制浓度(IC)值。1.4 qRT-PCR检测
取对数生长期的AGS细胞,调整细胞密度,取等体积细胞悬液分别接种于培养皿中,待细胞完全贴壁后,分别加入终浓度为0、10、20、40 μmol/L的LL-37溶液继续培养24 h。收集细胞沉淀,加入适量TRIzol试剂,提取细胞总RNA,采用PrimeScriptRT reagent Kit将RNA逆转录成cDNA,再采用TB GreenPremix
Ex
Taq
Ⅱ试剂盒进行PCR扩增。引物序列:p53,forward: 5′-GAGGTT GGCTCTGACTGTACC-3′,reverse: 5′-TCCGTCCCAGTAGATTACCAC-3′;GAPDH,forward:5′-AGCCACATCGCTCAGACAC-3′,reverse: 5′-GCCCAATACG-ACCAAATCC-3′。PCR反应程序:95 ℃、30 s,60 ℃、1 min,72 ℃、1.5 min,共35个循环。采用2法计算p53 mRNA相对表达量。1.5 流式细胞术检测细胞凋亡
取对数生长期的AGS细胞,调整细胞密度,以1.5×10个/孔接种于6孔板中,待细胞完全贴壁后,分别加入终浓度为0、10、20、40 μmol/L的LL-37溶液处理24 h。收集细胞,500 r/min离心5 min,弃上清液,按照试剂盒说明书加入195 μl Annexin V-FITC结合液重悬细胞,再分别加入5 μl Annexin V-FITC染液和10 μl碘化丙啶(PI)染色液,轻轻混匀,室温避光15 min,随后置于冰上,立即采用流式细胞仪进行检测。1.6 免疫荧光实验
取对数生长期的AGS细胞,调整细胞密度,以1.5×10个/孔接种于内含无菌盖玻片的6孔板中,待细胞完全贴壁后,分别加入终浓度为0、10、20、40 μmol/L的LL-37溶液处理24 h。弃培养基, 3%多聚甲醛固定10 min,预冷PBS轻轻洗2次,1% NP40处理5 min,吸掉液体,5%牛血清白蛋白4 ℃封闭2 h,滴加p53抗体(1 ∶500),置于4 ℃冰箱中孵育过夜,预冷PBS轻轻洗3次,滴加荧光二抗(1 ∶1 500),室温避光孵育1 h,预冷PBS轻轻洗3次,滴加适量DAPI溶液(0.1 mg/ml),室温避光孵育15 min,预冷PBS轻轻洗3次,取出玻片,滴加防淬灭剂,荧光显微镜观察并拍照。1.7 Western blot检测相关蛋白表达
取对数生长期的AGS细胞,调整细胞密度,取等体积细胞悬液分别接种于培养皿中,待细胞完全贴壁后,分别加入终浓度为0、10、20、40 μmol/L的LL-37溶液继续培养24 h。收集细胞沉淀,分别加入全细胞蛋白裂解液或核蛋白裂解液抽提蛋白并定量。取25 μg蛋白经沸水浴变性后,行SDS-PAGE凝胶电泳,利用湿转法将蛋白转移至聚偏二氯乙烯(PVDF)膜上,5%脱脂牛奶室温封闭1 h,分别加入一抗p53(1 ∶1 000)、Cleaved-caspase-3(1 ∶1 000)、PUMA(1 ∶1 000)、Bcl-2(1 ∶1 000)、Bax(1 ∶1 000)、GAPDH(1 ∶1 000)和Histone H3(1 ∶1 000),4 ℃条件下孵育过夜。次日,加入二抗(1 ∶10 000),室温孵育1 h,滴加ECL化学发光液,显影。采用Image-Pro Plus 6.0软件测量蛋白条带灰度值,以Histone H3为核蛋白p53内参,其他蛋白以GAPDH为内参,以目的蛋白吸光度值与内参蛋白吸光度值的比值表示目的蛋白相对表达量。1.8 LL-37联合siRNA-p53干预实验
取对数生长期的AGS细胞,调整细胞密度,以1.5×10个/孔接种于6孔板中,采用Lipofectamine3000转染试剂将siRNA阴性对照质粒(siRNA-NC)和p53 siRNA干扰质粒(siRNA-p53)分别转染至AGS细胞中,记为siRNA-NC组和siRNA-p53组,另取未经转染的AGS细胞作为空白对照组(blank)。转染48 h后,采用上述qRT-PCR和Western blot法检测p53 mRNA和蛋白水平。取对数生长期转染后AGS细胞,调整细胞密度,以1.5×10个/孔接种于6孔板中,将细胞分为siRNA-NC、siRNA-NC+LL-37、siRNA-p53和siRNA-p53+LL-37组。待细胞完全贴壁后,siRNA-NC+LL-37组和siRNA-p53+LL-37组细胞均采用20 μmol/L LL-37处理24 h,收集细胞后采用上述流式细胞术法检测各组细胞凋亡水平,Western blot法检测各组细胞中Cleaved-caspase-3蛋白表达水平。

2 结果
2.1 LL-37抑制AGS细胞增殖活性
MTT检测结果显示,不同浓度(0、10、20、40 μmol/L)LL-37处理24 h后,胃癌AGS细胞OD490值分别为(0.48±0.01)、(0.43±0.01)、(0.36±0.01)和(0.29±0.01),IC值为55.54 μmol/L。与0 μmol/L比较,LL-37可呈剂量依赖性抑制AGS细胞增殖,差异有统计学意义(F
=189.631,P
<0.001)。为了保证该研究后续实验中AGS细胞的增殖活性,该研究选择40%抑制浓度(约40 μmol/L)作为该研究LL-37最大干预浓度。2.2 LL-37促进AGS细胞凋亡
流式细胞术检测结果(图1A)显示,不同浓度(0、10、20、40 μmol/L)LL-37处理24 h后,胃癌AGS细胞凋亡率分别为(7.37±1.86)%、(14.80±1.49)%、(25.53±2.85)%和(39.10±2.56)%;与0 μmol/L比较,不同浓度(10、20、40 μmol/L)LL-37处理后,AGS细胞凋亡率逐渐增加(F
=114.868,P
<0.001)。Western blot检测结果(图1B)显示,不同浓度(0、10、20、40 μmol/L)LL-37处理24 h后,胃癌AGS细胞中Cleaved-caspase-3、Bax和PUMA蛋白表达水平逐渐上升(F
=586.209、252.665、482.897,P
<0.001),而Bcl-2蛋白表达水平逐渐降低(F
=705.271,P
<0.001)。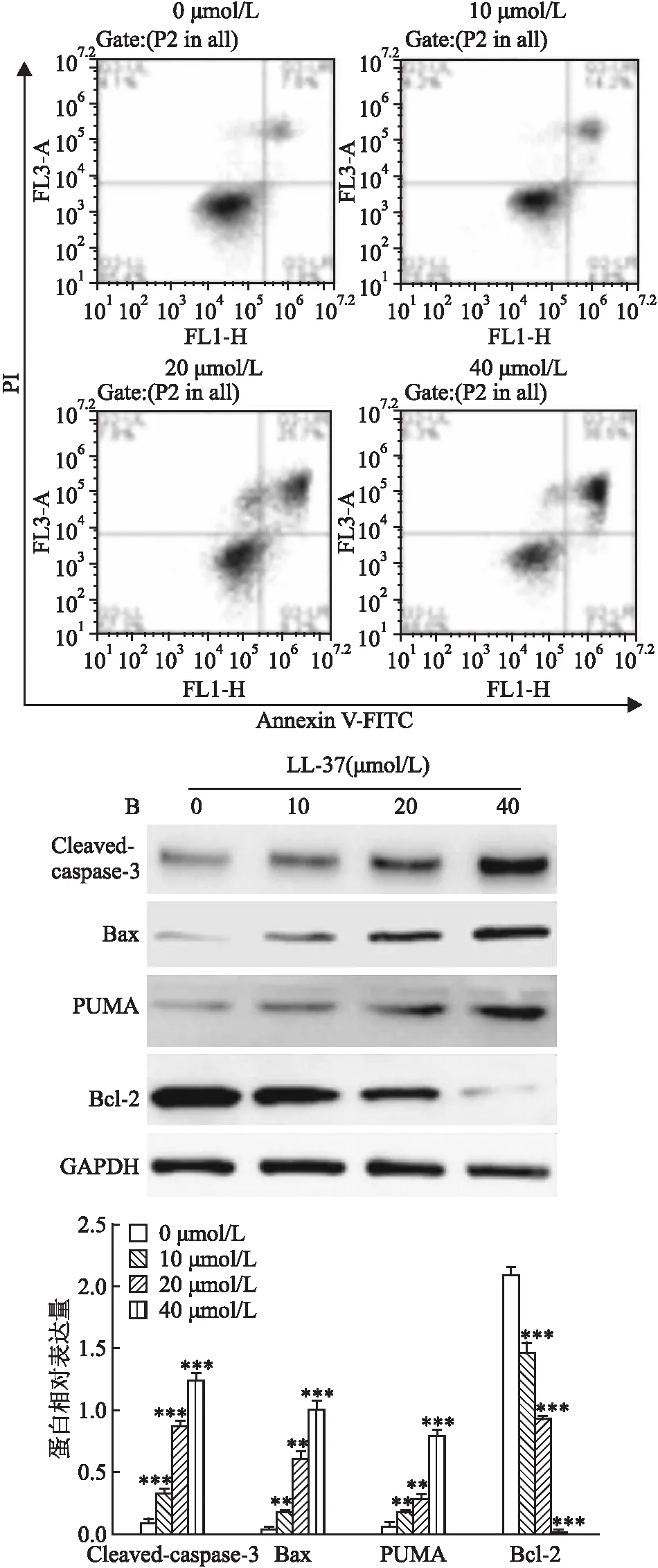
图1 LL-37对AGS细胞凋亡的影响A:流式细胞术检测AGS细胞凋亡;B:Western blot检测AGS细胞中凋亡相关蛋白的表达;与0 μmol/L LL-37处理组比较:**P<0.01,***P<0.001
2.3 LL-37激活p53信号通路的转导
qRT-PCR结果显示,不同浓度(0、10、20、40 μmol/L)LL-37处理24 h后,胃癌AGS细胞中p53 mRNA相对表达量分别为(1.00±0.02)、(2.46±0.09)、(4.23±0.13)和(7.09±0.62);与0 μmol/L比较,不同浓度(10、20、40 μmol/L)LL-37处理后,AGS细胞中p53 mRNA表达水平逐渐增加(F
=207.276,P
<0.001)。Western blot检测结果(图2A)显示,(0、10、20、40 μmol/L)LL-37处理24 h后,胃癌AGS细胞核中p53 蛋白相对表达量分别为(0.06±0.03)、(0.16±0.03)、(0.31±0.02)和(0.86±0.04);与0 μmol/L比较,不同浓度(10、20、40 μmol/L)LL-37处理后,AGS细胞核中p53 蛋白表达水平逐渐增加(F
=401.866,P
<0.001)。免疫荧光结果(图2B)显示,0 μmol/L LL-37处理后AGS细胞中p53 蛋白绿色荧光非常弱,而不同浓度(10、20、40 μmol/L)LL-37处理后AGS细胞中p53 蛋白绿色荧光逐渐增强,并且逐渐由细胞质向细胞核内聚集。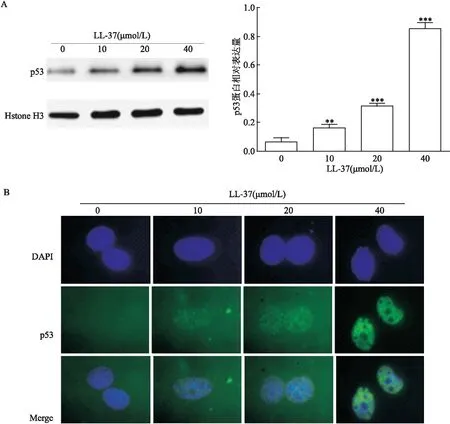
图2 LL-37对AGS细胞中p53蛋白表达及定位的影响A:Western blot检测AGS细胞核中p53蛋白表达水平;B: 免疫荧光实验检测AGS细胞中p53 蛋白定位情况×400;与0 μmol/L LL-37处理组比较:**P<0.01,***P<0.001
2.4 干扰
53基因表达抑制LL-37诱导的细胞凋亡
qRT-PCR结果显示, siRNA-p53组细胞中p53 mRNA相对表达量(1.00±0.04)低于blank组(0.96±0.06)和siRNA-NC组(0.28±0.06),差异有统计学意义(F
=185.368,P
<0.001)。Western blot检测结果(图3A)显示,与blank组和siRNA-NC组比较,siRNA-p53组细胞中p53蛋白表达水平降低,差异有统计学意义(F
=169.321,P
<0.001)。流式细胞术检测结果(图3B)显示,siRNA-NC、siRNA-NC+LL-37、siRNA-p53和siRNA-p53+LL-37组细胞凋亡率分别为(7.23±1.07)%、(27.01±2.31)%、(4.83±1.66)%和(11.13±2.90)%。与siRNA-NC组比较,siRNA-NC+LL-37组细胞凋亡率升高,差异有统计学意义(t
=11.531,P
<0.001),而siRNA-p53+LL-37组细胞凋亡率差异无统计学意义(t
=2.275,P
>0.05);与siRNA-p53组比较,siRNA-p53+LL-37组细胞凋亡率升高,差异有统计学意义(t
=3.675,P
<0.01)。Western blot检测结果(图3C)显示,与siRNA-NC组比较,siRNA-NC+LL-37组细胞中Cleaved-caspase-3蛋白表达水平升高,差异有统计学意义(t
=28.583,P
<0.001),而siRNA-p53+LL-37组差异无统计学意义(t
=2.042,P
>0.05);与siRNA-p53组比较,siRNA-p53+LL-37组细胞中Cleaved-caspase-3蛋白表达水平升高,差异有统计学意义(t
=4.219,P
<0.01)。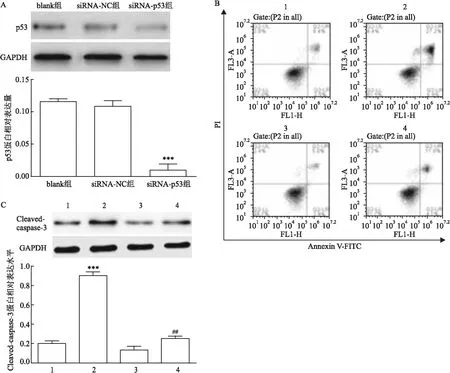
图3 干扰p53基因表达对LL-37诱导的细胞凋亡的影响A:Western blot检测转染后各组细胞中p53蛋白表达水平;与blank或siRNA-NC组比较:***P<0.001;B:流式细胞术检测各组细胞凋亡率;C:Western blot检测各组细胞中Cleaved-caspase-3蛋白表达水平; 1:siRNA-NC组; 2:siRNA-NC+IL-37组; 3:siRNA-p53组; 4:siRNA-p53+IL-37组; 与siRNA-NC组比较:***P<0.001;与siRNA-p53组比较:##P<0.01
3 讨论
无限增殖及抵抗细胞死亡均是肿瘤细胞的主要特征之一,也是抗肿瘤药物研发的靶点。目前,较多一线抗肿瘤药物均以干扰细胞周期进程为靶点,如5-氟尿嘧啶、吉西他滨、顺铂等;也有某些以原癌基因或抑癌基因为靶点的分子靶向抗癌药物,如以表皮生长因子受体(RGFR)为分子靶点的吉非替尼、以血管内皮生长因子(VEGF)为靶点的依维莫司等,并且都取得显著效果。作为一个具有多种生物学活性的人源抗菌肽,LL-37在肿瘤的发生发展过程中发挥重要生理作用,但其功能具有肿瘤异质性,而其作用的分子靶点主要为膜受体蛋白及其相关信号通路。在LL-37抗肿瘤研究方面,闫圣玉 等报道称,LL-37通过激活AMPK/mTOR信号通路介导的细胞自噬,抑制结肠癌细胞裸鼠移植瘤的生长;Mader et al证实,LL-37通过激活线粒体凋亡途径诱导人Jurkat T白血病细胞凋亡。而该结果显示,LL-37可通过激活抑癌基因p
53的表达抑制胃癌AGS细胞增殖并诱导细胞凋亡,表明p
53可能是LL-37作为治疗胃癌潜在药物的一个分子靶点。抑癌基因的失活及原癌基因的激活是导致肿瘤发生发展的始作俑者。作为一种非常重要的抑癌基因,p
53基因可通过转录调控下游靶基因的表达,通过参与调节细胞周期、DNA修复、细胞凋亡以及细胞衰老等生物学过程抑制肿瘤进程。然而,在多数肿瘤组织中p
53基因发生突变,导致p
53基因转录激活功能的丧失,进而失去肿瘤抑制活性。目前,靶向p
53基因的抗癌药物主要以恢复p
53基因野生型功能、诱导突变型p53蛋白降解以及抑制突变型p
53下游功能为策略,但化学合成药物副作用较大。LL-37是在人体中迄今为止发现的唯一的抗菌肽,具有多种生物学活性,因此人源抗菌肽LL-37药用价值较大。已经有报道称,LL-37能够激活p53介导的凋亡途径诱导结肠癌细胞凋亡。为此,为了探讨LL-37对胃癌细胞凋亡的影响及其作用机制与p53关系,该研究选择p53野生型的胃癌AGS细胞为研究对象,采用人源抗菌肽LL-37进行干预,结果显示,LL-37可呈剂量依赖性抑制胃癌AGS细胞增殖并诱导细胞凋亡。此外,该研究还表明,不同浓度LL-37处理可促进AGS细胞中p
53 mRNA表达,表明LL-37能够促进p
53基因的转录表达。作为核转录因子,p53蛋白须由胞质转位至细胞核才能激活下游靶基因的转录,发挥其抑癌活性。为此该研究对AGS细胞核中p53蛋白表达水平进行了检测,Western blot结果显示0 μmol/L LL-37处理时,AGS细胞核中p53蛋白表达量较低,而经过不同浓度LL-37处理后AGS细胞核中p53蛋白表达水平逐渐升高,且免疫荧光实验进一步证实LL-37能够促进p53蛋白由胞质转位至细胞核。提示,LL-37不仅能够促进p
53基因的表达,而且还能促进p53蛋白由胞质向细胞核中转位。p53介导的细胞凋亡途径是p
53发挥抑癌基因功能的重要方式,其可直接转录激活PUMA的表达,随后PUMA与Bcl-2/Bax复合体相互作用诱导线粒体膜间隙细胞色素C的释放,激活caspase级联反应,最终由Cleaved-caspase-3执行凋亡。该结果显示,不同剂量的LL-37处理可促进AGS细胞中PUMA、Bax及Cleaved-caspase-3等蛋白的表达,而抑制Bcl-2蛋白的表达,提示LL-37可能通过激活p53介导的细胞凋亡途径诱导AGS细胞凋亡。为了进一步证实LL-37是通过p53途径诱导AGS细胞凋亡,该研究采用siRNA技术沉默AGS细胞中p
53基因表达,然后再采用LL-37进行干预,结果显示与siRNA-NC组比较,p
53基因沉默后LL-37诱导的AGS细胞凋亡率大幅度降低,同时Cleaved-caspase-3蛋白表达水平也明显降低,说明LL-37是通过激活p53介导的细胞凋亡途径诱导AGS细胞凋亡。此外,该结果还显示与siRNA-p53组比较,siRNA-p53+LL-37组细胞凋亡率和Cleaved-caspase-3蛋白表达水平均升高,说明激活p53介导的细胞凋亡途径并非LL-37诱导胃癌细胞凋亡的唯一途径,还可能存在其他途径。