骨形态发生蛋白7 通过调节GSK⁃3β 活性对心肌梗死后大鼠心肌纤维化的影响
2021-04-07余平梁鹏庞诗锋袁文健黄巧娟
余平 梁鹏 庞诗锋 袁文健 黄巧娟
持续过度的心肌重构是心肌梗死发展成充血性心力衰竭的重要病理机制,而心肌纤维化是心肌重构的关键环节[1]。因此,有效抑制心肌纤维化可能是心肌梗死后治疗的关键。既往研究表明,BMP7 具有抗炎、抗凋亡、抗纤维化的作用,并在心脏疾病中发挥重要作用,但其抗心肌纤维化可能涉及的机制尚不清楚[2,3]。因此本研究通过制备心肌梗死大鼠模型,旨在探究BMP7 对心肌梗死后心肌纤维化的影响及可能的机制。
1 材料与方法
1.1 实验动物 22 只健康雄性Sprague⁃Dawley 大鼠(SD rats),体重230-250 g,由广西医科大学实验中心提供。
1.2 主要试剂及仪器 人重组骨形态发生蛋白7(BMP7,北京博奥森生物科技有限公司),p⁃GSK⁃3β抗体(英国Abcam 公司),TGF⁃β1 抗体(英国Abcam公司),β⁃Actin 抗体(美国CST 公司),Masson 染色试剂盒(北京博奥森生物科技有限公司),ALC⁃V9动物呼吸机(上海奥尔科特生物科技有限公司)
1.3 心梗模型制备 根据Curaj[4]等的方法构建心梗模型。通过腹腔注射2%戊巴比妥钠(3 ml/kg)麻醉大鼠,行经口气管插管并连接动物呼吸机辅助呼吸,在左侧胸壁第3-4 肋间处备皮、开胸,暴露心脏,于左心耳根部下方2-3 mm 处用6-0 缝合线结扎左前降支,结扎后见左室前壁及心尖部变白,心脏搏动减弱,心电图示ST 段抬高,即表示造模成功。术毕,形成胸腔负压,逐层关闭胸腔后肌肉注射2.5×104U 青霉素预防感染。假手术组大鼠进行相同手术操作,仅不结扎左前降支。
1.4 动物分组与处理 将术后成功存活12 h 的大鼠随机分为2 组,分别为MI 组和MI+BMP7 组,每组8 只。另外选择6 只正常SD 大鼠作为Sham组。术后第二天,MI+BMP7 组尾静脉注射35 μg·kg-1[3],1 次/周,共4 周,其 余 两 组 尾 静 脉 注 射 与BMP7 等体积的生理盐水,1 次/周,共4 周。
1.5 标本收集与处理 术后4 周时,先麻醉大鼠,再剪开胸腔迅速将心脏取出,并放入盛有10%氯化钾溶液的玻璃皿中,使心脏在舒张期停止。用冷生理盐水冲洗心腔及心脏表面,直至冲洗液变透明。再将结扎线以上部分心肌组织和右心室组织去除,剩余心肌组织一部分用4%多聚甲醛固定24 h 备用,另一部分经液氮速冻后转入-80℃冰箱保存。
1.6 检测指标及方法 (1)HE 染色 各组心肌组织经4%多聚甲醛固定24 h 后,石蜡包埋切片,将切片依次放入二甲苯脱蜡、梯度乙醇水化至蒸馏水,再苏木素染色,盐酸酒精分化,氨水返蓝,伊红染色,再梯度酒精脱水,二甲苯透明,中性树胶封片,镜检观察心肌形态学改变。(2)Masson 染色切片常规脱蜡水化,遵循Masson 染色试剂盒操作说明处理,在光镜下心肌纤维呈红色,胶原纤维呈蓝色,并用Image⁃Pro Plus 6.0 软件进行图像分析。胶原容积分数(%)=(胶原面积/胶原纤维+肌纤维总面积)×100%。(3)蛋白质免疫印迹试验(Western Blot)采用RIPA 组织裂解液提取各组心肌组织蛋白,蛋白定量,按比例加入上样缓冲液煮沸10 min,冷却后取35 μg 蛋白上样,进行聚丙烯酰胺凝胶电泳,转膜至聚偏氟乙烯(PVDF)膜上,将膜浸于5%脱脂奶粉封闭后分别置于p⁃GSK⁃3β、TGF⁃β1 及β⁃Actin 一抗中孵育,4℃过夜。再TBST 缓冲液洗膜三次,室温孵育二抗1 h 后TBST 再次洗涤,在膜上加入ECL化学发光液,曝光显影,并用Image⁃J 软件分析蛋白条带灰度值。
1.7 统计学方法 采用SPSS 22.0 进行数据统计分析,计量数据以(±s)表示,多组间比较采用单因素方差分析法,组间两两比较采用LSD 法,以P<0.05 为差异具有统计学意义。
2 结 果
2.1 各组大鼠心肌组织病理学改变 HE 染色结果显示,Sham 组大鼠心肌纤维排列有序,未见明显异常;MI 组心肌组织出现大量心肌纤维断裂、坏死,并被胶原纤维所取代;MI+BMP7 组较MI 组而言,心肌纤维坏死减少,心肌纤维化程度得到明显改善,见图1。
2.2 各组大鼠心肌纤维化情况 Masson 染色结果显示,Sham 组心肌纤维间仅有少量的胶原纤维;与Sham 组相比,MI 组心肌纤维排列紊乱,可见大量的胶原纤维沉积(P<0.05);而使用BMP7 治疗后明显减轻了心肌组织纤维化程度(P<0.05),见图2。
2.3 各组大鼠心肌组织中p⁃GSK⁃3β 及TGF⁃β1的蛋白表达 与Sham 组相比,MI 组大鼠心肌组织中p⁃GSK⁃3β及TGF⁃β1的蛋白表达水平明显上调(均P<0.05);而MI+BMP7组大鼠心肌组织p⁃GSK⁃3β 及TGF⁃β1 的蛋白表达水平明显低于MI 组(均P<0.05),见图3。
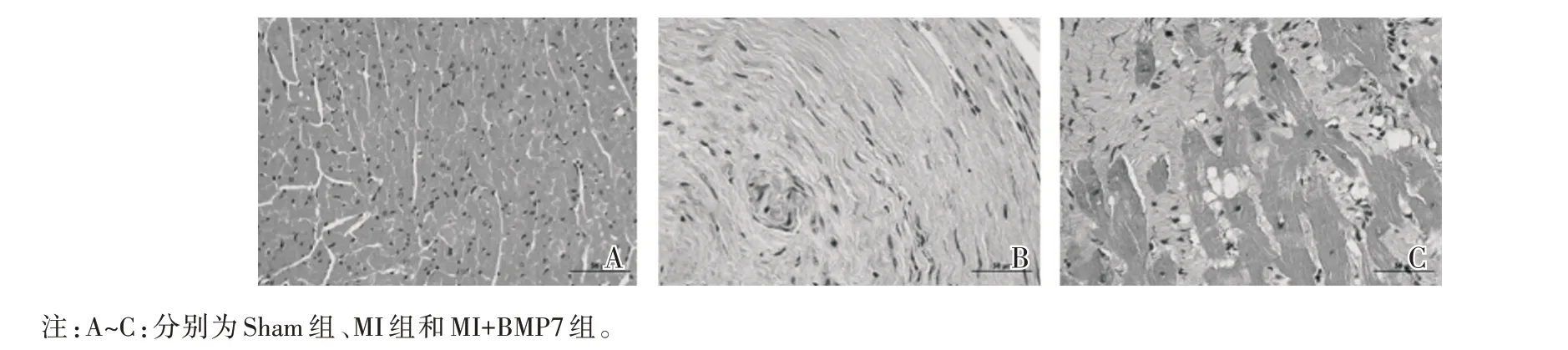
图1 各组大鼠心肌组织HE 染色结果(×400)

图2 Masson 染色检测各组心肌纤维化情况(×200)
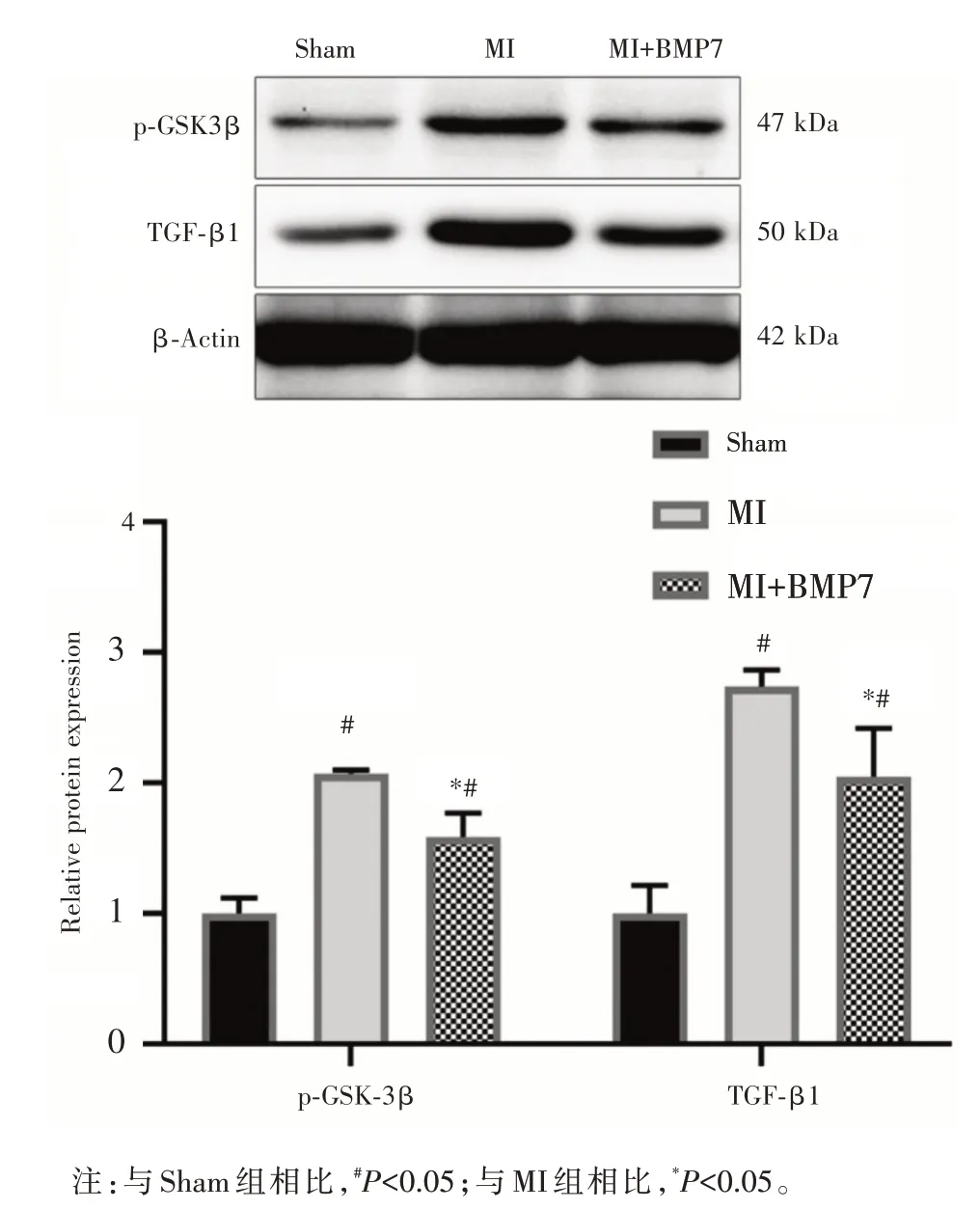
图3 各组大鼠心肌组织中p⁃GSK⁃3β 及TGF⁃β1 蛋白表达情况
3 讨 论
心肌纤维化是MI 后所致缺血性心脏病的常见结果,可作为心力衰竭的独立危险因素[5]。因此,MI 后心肌纤维化的治疗成为了心血管疾病研究的热点。大鼠左冠状动脉前降支结扎4 周后可诱导心肌纤维化模型,目前此模型已广泛应用于心肌纤维化研究。本研究应用该方法成功构建了大鼠心肌纤维化模型,模型组大鼠心肌间质胶原纤维大量沉积,纤维化相关蛋白p⁃GSK⁃3β 和TGF⁃β1显著升高,而应用BMP7 干预后,以上纤维化相关蛋白随之降低,心肌纤维化程度得到明显改善,其机制可能是BMP7 通过GSK⁃3β 通路来改善MI 后心肌纤维化。
既往研究表明,TGF⁃β1 是公认的器官纤维化指标,在缺血性心脏病中促进成纤维细胞活化和胶原纤维沉积[6,7]。目前研究显示,多种信号分子及通路可调控TGF⁃β1/Smads 信号传导,进而调节心肌纤维化程度,也称为通路串扰,GSK⁃3β 便是其中之一。GSK⁃3β 是一种可调节糖原合成酶活性的丝氨酸/苏氨酸激酶,其活性受到多种机制的复杂调控,是少数可通过磷酸化而失活的蛋白激酶之一。多项研究证实,GSK⁃3β 介导心肌纤维化负性调节作用在限制MI 后心肌重构过程中发挥重要作用[8,9]。此外,GSK⁃3β 可直接控制Smad⁃3 活性及其蛋白稳定性,进而调控TGF⁃β1/Smads 信号传导,GSK⁃3β 缺失或活性降低可导致TGF⁃β1/Smads 信号传导通路过度激活,诱导心肌纤维化表型[8,10]。
在结扎大鼠左冠状动脉前降支4 周后,MI 组大鼠心肌组织心肌纤维排列紊乱,可见大量的胶原纤维沉积,证明本模型确实诱发了心肌纤维化。进一步实验发现,MI 组p⁃GSK⁃3β 和TGF⁃β1 表达量较Sham 组明显升高,这与先前研究一致[9]。而相较于MI 组,给予BMP7 治疗后p⁃GSK⁃3β 和TGF⁃β1表达量均显著下调,且心肌纤维化程度得到明显改善。说明外源性BMP7 治疗可能通过改善MI 诱导的GSK⁃3β 活性降低,从而抑制TGF⁃β1/Smads 信号传导通路过度激活,减轻心肌纤维化。
综上,本研究通过制备大鼠MI 后心肌纤维化模型将BMP7 与纤维化负调节因子GSK⁃3β 联系起来,结果证明外源性BMP7 可改善MI 诱导的不良心室重构,而GSK⁃3β 介导的纤维化负调控可能参与了BMP7 对MI 后心肌纤维化的保护机制,具体作用机制还需要进一步使用通路抑制剂或体外实验加以验证,为心肌纤维化疾病的治疗提供一个新的治疗方向。
