ELA 对骨髓间充质干细胞氧化应激损伤的保护作用
2021-04-07符佳颖陈旭翔许岱诗刘欣杨欢周长青吴海东曾朝涛吴浩郑光辉王彤
符佳颖 陈旭翔 许岱诗 刘欣 杨欢 周长青 吴海东 曾朝涛吴浩 郑光辉 王彤*
近年来,骨髓间充质干细胞(Mesenchymal stem cells,MSCs)移植治疗心肌梗死的优越性得到了广泛关注。MSCs 移植已被证实能够有效缩小心肌梗死面积、形成新生血管、改善心室重塑、提高患者的心功能[1]。然而,多项临床试验指出MSCs 在移植后受到局部梗死微环境的影响导致生存能力低下,未能达到理想的治疗效果[2]。因此,如何提高MSCs 在缺氧环境下的生存能力是干细胞移植亟需解决的关键问题。ELABELA(ELA)是一种内源性肽类激素,课题组前期的实验表明ELA 能够通过改善和促进MSCs 的细胞增殖和迁移能力[3]。但ELA 是否能够提高MSCs 抵抗氧化应激损伤的能力需要进一步验证。本实验通过采用过氧化氢(H2O2)诱导MSCs 凋亡,探讨ELA 对MSCs 氧化应激损伤的影响及其最佳治疗浓度。
1 材料与方法
1.1 材料 SPF 级Sprague Dawley(SD)大鼠,体质量(100±20)克,购于广州中医药大学动物实验中心,许可证号:SCXK(粤)2018-0034。实验中对动物处理方法取得中山大学伦理委员会批准,批准号:2019-057-01。
1.2 方法 (1)细胞培养根据课题组已建立成熟的 方 法 进 行 分 离、培 养 及 鉴 定MSCs[4]。第3 代MSCs 用于后续实验研究。(2)细胞分组及H2O2诱导细胞凋亡模型建立将体外培养的MSCs 随机分为Control 组、H2O2组、500 nM ELA 组,1 μM ELA 组,5 μM ELA 组,10 μM ELA 组。H2O2组 细 胞 加 入 含400 μM H2O2的无血清培养基,在37℃条件下培养6 h,建立H2O2诱导细胞凋亡模型,模拟心肌梗死后体内氧化应激微环境[5]。Control 组加入等量PBS;500 nM ELA 组,1 μM ELA 组,5 μM ELA 组,10 μM ELA 组各自加入不同浓度ELA(500 nM,1 μM,5 μM,10 μM)后进行H2O2诱导细胞凋亡。(3)MTS 法检测细胞增殖及细胞活力将MSCs 按3×103 个/孔接种到96 孔板,每孔100 μl,待细胞贴壁。按(2)方法处理各组细胞后,每孔加入cellTiter96AQ 单溶液细胞增殖检测试剂20 μl,于37℃孵育2 小时,应用酶标仪检测A490 值。(4)DCFH-DA 荧光探针法检测细胞内活性氧(reactive oxygen species,ROS)水平收集各组MSCs 后,使其重悬于10 μM DCFH-DA中,充分混匀,置于37℃细胞培养箱内孵育30 分钟。使用无血清培养基洗涤细胞3 次,以除去未进入细胞内的DCFH-DA 探针。应用荧光酶标仪(激发波长=485 nm,发射波长=520 nm)检测各组细胞内ROS 水平。细胞内相对ROS 水平=各组荧光强度/Control 组荧光强度×100%。
1.3 统计学分析 采用SPSS 23.0 统计软件进行分析,实验数据以(x ± s)表示。多组间差异比较采用方差分析,组间两两比较采用LSD-t 检验,P<0.05 为差异具有统计学意义。
2 结 果
2.1 ELA 对MSCs 细胞增殖及细胞活力的影响通过MTS 实验验证ELA 是否能增强MSCs 在氧化应激损伤下的细胞增殖及存活能力。与Control 组相比,H2O2组的细胞增殖能力显著降低(P<0.05,图1,2)。与H2O2组相比,500 nM ELA 组,1 μM ELA 组,5 μM ELA 组MSCs 保持良好的细胞活性(P<0.05,图1,2),且呈剂量依赖效应。尽管10 μM ELA 组细胞活力优于H2O2组(P<0.05,图1,2),与5 μM ELA 组相比,其促进MSCs 细胞生存能力减低,提示5 μM ELA 促进氧化应激状态下MSCs 细胞生存能力为最佳。

图1 各组骨髓间充质干细胞的OD490 值

图2 各组骨髓间充质干细胞的细胞活力(%)
2.2 ELA 对MSCs 细胞内ROS 水平的影响 通过检测MSCs 细胞内ROS 水平观察ELA 是否能增强MSCs 抵抗氧化应激损伤。与Control 组相比,在氧化应激条件下,MSCs 的细胞内ROS 水平含量上升(P<0.05,图3)。分别加入500 nM ELA,1 μM ELA,5 μM ELA 治疗后,与H2O2组相比,MSCs 的细胞内ROS 水平含量下降(P<0.05,图3),且与ELA 浓度梯度相关。MSCs 经10 μM ELA 治疗后,细 胞 内ROS 水 平 高 于5 μM ELA 组,提 示5 μM ELA 是抑制MSCs 细胞内ROS 产生的最佳浓度。
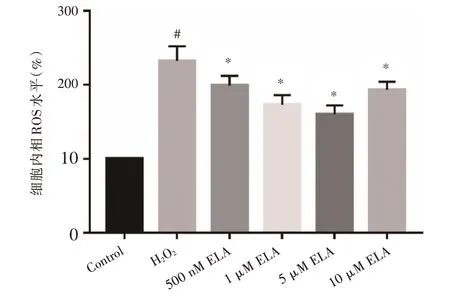
图3 各组骨髓间充质干细胞内ROS 水平
3 讨 论
MSCs 是来源于骨髓并具有自我更新和多向分化潜能的成体干细胞,尽管MSCs 治疗心肌梗死取得了较大的研究进展,由于缺氧和氧化应激导致MSCs 在局部梗死心肌的存活率较低[6],导致MSCs移植治疗效率仍然不理想。ELA 分泌于胚胎干细胞,是由32 个氨基酸构成的多肽。ELA 具有较强的胚胎信号活性,在早期心管向心血管谱系发育和分化中扮演着重要的角色[7]。研究证实,ELA 能够有效调控心肌梗死模型大鼠的心肌重塑,增强心肌收缩力,改善心肌梗死后心功能[8]。然而,ELA 是否能够改善MSCs 移植后在体内氧化应激状态下的生存能力目前未有相关研究。
本研究证实了ELA 能够促进氧化应激状态下MSCs 的存活能力,并探讨了不同浓度ELA 对MSCs 细胞活力的保护作用。其中,500 nM ELA,1 μM ELA 及5 μM ELA 对MSCs 的保护作用呈现浓度依赖效应,并降低了细胞内ROS 生成水平。研究表明,氧化应激状态下ROS 水平升高,过度的氧自由基及其衍生物产生与细胞存活能力密切相关[9]。目前,已经证实ELA 能够通过PI3K/AKT 通路调控G1/S 阶段细胞周期从而实现胚胎干细胞的自我更新和生存能力[10]。基于以上研究发现,我们推测ELA 保护MSCs 抗氧化应激的作用可能与ROS 介导的PI3K/AKT 通路活化状态有关。然而,10 μM ELA 对改善MSCs 在氧化应激状态下的存活能力有所降低,其具体的原因需进一步验证。
综上所述,ELA 能够增强氧化应激状态下MSCs 的生存能力,有利于提高MSCs 在梗死心肌中的存活。本实验的结果初步表明ELA 治疗对于改善MSCs 抵抗氧化应激损伤是一种可行的方法,其作用机制有待进一步研究。
