响应面法优化红芪多糖的提取工艺
2021-04-06董嘉琪张晓松彭晓婷文艳巧姚万玲魏彦明
董嘉琪,张晓松,彭晓婷,文艳巧,薛 姣,姚万玲,魏彦明
(甘肃农业大学动物医学院,甘肃兰州 730070)
红芪为豆科植物多序岩黄芪(HedysarumpolybotrysHand)的干燥根,其最早记录于《神农百草经》[1]。1977年版《中国药典》将红芪列入黄芪项下,作为黄芪来源收载,《中国药典》自1985年版开始,将红芪由黄芪项下转为单一的一味中药[2]。红芪为甘肃道地药材,主产于甘肃陇南、武威、陇西等地区,具有补气升阳、固表止汗、利水消肿、生津养血、行滞通痹、托毒排脓、敛疮生肌之功效[3]。药理成分分析表明,红芪中可能含有氨基酸(或蛋白质)、皂苷、有机酸、酚类、黄酮、生物碱、甾醇,微量元素及木质素等成分。随着20 世纪80年代日本学者对红芪的不断研究探索,从红芪中分离出黄芪中不存在的抗菌成分1-3-羟基-9-甲氧基紫檀烷,该化合物具有较强的杀菌作用,红芪的研究逐渐引起了国内学者的广泛关注。红芪多糖(Radix Hedysari polysaccharide,RHPS)属多聚糖,是红芪的主要活性成分,其结构极为复杂。红芪多糖为其重要的有效成分之一,其具有增强免疫、抗氧化、抗肿瘤、降血糖、抗辐射、治疗肝损伤等多种药理作用。
近年来,多糖类中药保健品在市场上的占有率越来越高,但是多糖类药品屈指可数。其原因是多糖的结构复杂,提取分离较难。因此,对多糖的研究与提取便成为了多糖类药品发展过程中必不可少的重要一环。据文献报道,红芪多糖提取的优化方法多采用正交试验设计,而Box-Benhnken设计结合响应面分析法比正交设计试验法更简便易行,且预测性好,便于实际应用。本试验采用水提醇沉法提取红芪多糖,并以多糖提取率为衡量指标,在单因素试验基础上,进行Box-Behnken设计结合响应面分析法,通过回归模型的建立及显著性检验,得到红芪多糖提取工艺的最佳参数,以期为红芪多糖的有效提取提供依据。
1 材料与方法
1.1 材料
1.1.1 药材与主要试剂 红芪药材,产自甘肃省武都,经甘肃农业大学动物医学院魏彦明教授鉴定,将其制成饮片,干燥以待用。苯酚、无水乙醇、950 mL/L乙醇、丙酮、浓硫酸、D-无水葡萄糖等均为分析纯,天津致远化学试剂有限公司产品。
1.1.2 主要仪器 RE-6000型旋转蒸发仪,上海亚荣生化仪器厂产品;冷冻干燥机,北京博医康实验仪器有限公司产品;HH-S型数显恒温水浴锅,金坛市恒丰仪器厂产品;TDZ5-WS型台式多管架自动平衡离心机,长沙湘仪离心机仪器有限公司产品;紫外分光光度计,上海琅玕实验设备有限公司产品等。
1.2 方法
1.2.1 水提醇沉法提取红芪多糖 取红芪饮片,粉碎,过60目筛,加入6倍量950 mL/L的乙醇溶液回流,重复多次,直至液体接近无色为止,以除去单糖、低聚糖、色素和多肽等小分子物质,同时灭活酶以防止在提取过程中酶对多糖的降解。然后进行抽滤,40℃真空干燥,得到预处理红芪药材。在不同的影响条件下,采用水提醇沉法提取红芪多糖:称取预处理后红芪药材2 g,加入设定倍数的蒸馏水,按设定的提取温度、提取时间和提取次数进行回流提取。待提取液冷却至室温后抽滤,收集液体,浓缩到0.1 g/mL后离心(4000 r/min,15 min),去除杂质,收集上清液;测量上清液体积,加入950 mL/L乙醇,使醇沉比达到设定百分比。4℃静置12 h后离心(4000 r/min,15 min),取沉淀。将沉淀用无水乙醇、丙酮、950 mL/L无水乙醇依次充分润洗,冷冻干燥,得红芪多糖。
1.2.2 红芪多糖含量的测定 采用苯酚-硫酸法[5]进行。
1.2.3 单因素试验 通过查阅文献得出影响红芪多糖提取率的主要因素有提取温度、液料比、醇沉比、提取时间和提取次数等因素。本试验中提取温度设置为50℃、60℃、70℃、80℃、90℃5个水平;液料比设置为10、15、20、25、30 mL/g 5个水平;醇沉比设置为50%、60%、70%、80%、90% 5个水平;提取时间设置为1、1.5、2、2.5、3 h 5个水平;提取次数设置为1次、2次、3次、4次、5次5个水平。按照上述设置进行单因素试验,且以提取率为响应值。

1.2.4 响应面法优化红芪多糖的提取条件 响应面试验设计:以多糖的提取率为响应值,采用5因素3水平的Box-Behnken试验设计,考察提取温度(A,℃)、液料比(B,mL/g)、醇沉比(C,%)、提取时间(D,h)和提取次数(E,次)对红芪多糖提取率的影响。每个考察因素设3个水平,即提取温度75℃、80℃、85℃,料液比20、15、10 mL/g,醇沉比75%、70%和65%,提取时间3、2.5 、2 h,提取次数4次、3次和2次(表1)。
验证试验:根据响应面法优化的最佳提取条件做3次平行试验,按照1.2.2方法测定多糖含量,计算其提取率,并通过独立性t检验分析试验值与理论值间是否存在差异性。
1.2.5 统计学分析 用SPSS 22.0统计软件对单因素试验各组数据进行单因素方差分析,试验数据以平均数±标准差(Mean±SD)表示;用Design-Expert8.0.6对响应面数据进行分析,根据单因素方差分析(ANOVA)结果对模型中的显著性进行评价,P<0.05为差异显著。
2 结果
2.1 单因素试验
2.1.1 提取温度对红芪多糖提取率的影响 固定液料比为10 mL/g,提取时间为1 h,提取次数为2次,醇沉比为80%,研究提取温度在50℃~90℃范围内对红芪多糖提取率的影响。随着温度的不断增高,红芪多糖的提取率呈线性增加,在80℃时达到最大值,80℃后温度继续增高,多糖的提取率反而下降,所以选择80℃作为最佳提取温度。在中药提取的过程中,加热可促进分子运动,软化组织,加速溶剂对药材组织细胞的渗透作用,降低溶液黏度,使药物有效成份溶解并且能提高溶解度[4]。但是,对于含黏液质、淀粉较多的糖类中草药,温度过高可能分解其有效成分,因而应避免加热提取[6]。
2.1.2 液料比对红芪多糖提取率的影响 固定提取温度为80℃,提取时间为1 h,提取次数为2次,醇沉比为80%,研究液料比在10 mL/g~30 mL/g范围内对红芪多糖提取率的影响。当液料比为15 mL/g时,红芪多糖提取率达到最大值,之后随着液料比的增加多糖的提取率不断下降,所以选择液料比15 mL/g作为最佳提取条件。液料比越大时,植物细胞与外部溶剂的浓度差越大,致使多糖的扩散速度越快,进而可提高多糖提取率[7]。另一方面,当料液比过大时,植物与溶剂之间的吸附作用减小,导致多糖的提取需要吸收更多的能量。因此,当能量供给不足时,植物细胞壁无法达到完全破碎,所以多糖提取率会降低[8]。
2.1.3 醇沉比对红芪多糖提取率的影响 固定提取温度为80℃,提取时间为1 h,提取次数为2次,液料比为10 mL/g,研究醇沉比在50%~90%范围内对红芪多糖提取率的影响。当醇沉比在70%时,红芪多糖提取率达到最大值,之后随着醇沉比的增加多糖的提取率有下降趋势,但不显著,所以选择醇沉比70%作为最佳提取条件。随醇沉比的增加多糖提取率先增加后减少,这可能是因为随着醇沉比的增加,多糖的溶解度增加,使多糖不断的从乙醇中析出;但是,多糖组成中有较多羟基醛和羟基酮,当醇沉比达到一定值后,其分子中的羟基会与多糖分子中的羟基形成互溶体系[9],可使多糖提取率减少。当醇沉比过大时,会使沉淀中杂质(淀粉、蛋白质、无机盐类)的含量增加,且有效成分易被沉淀物包裹而造成损失。
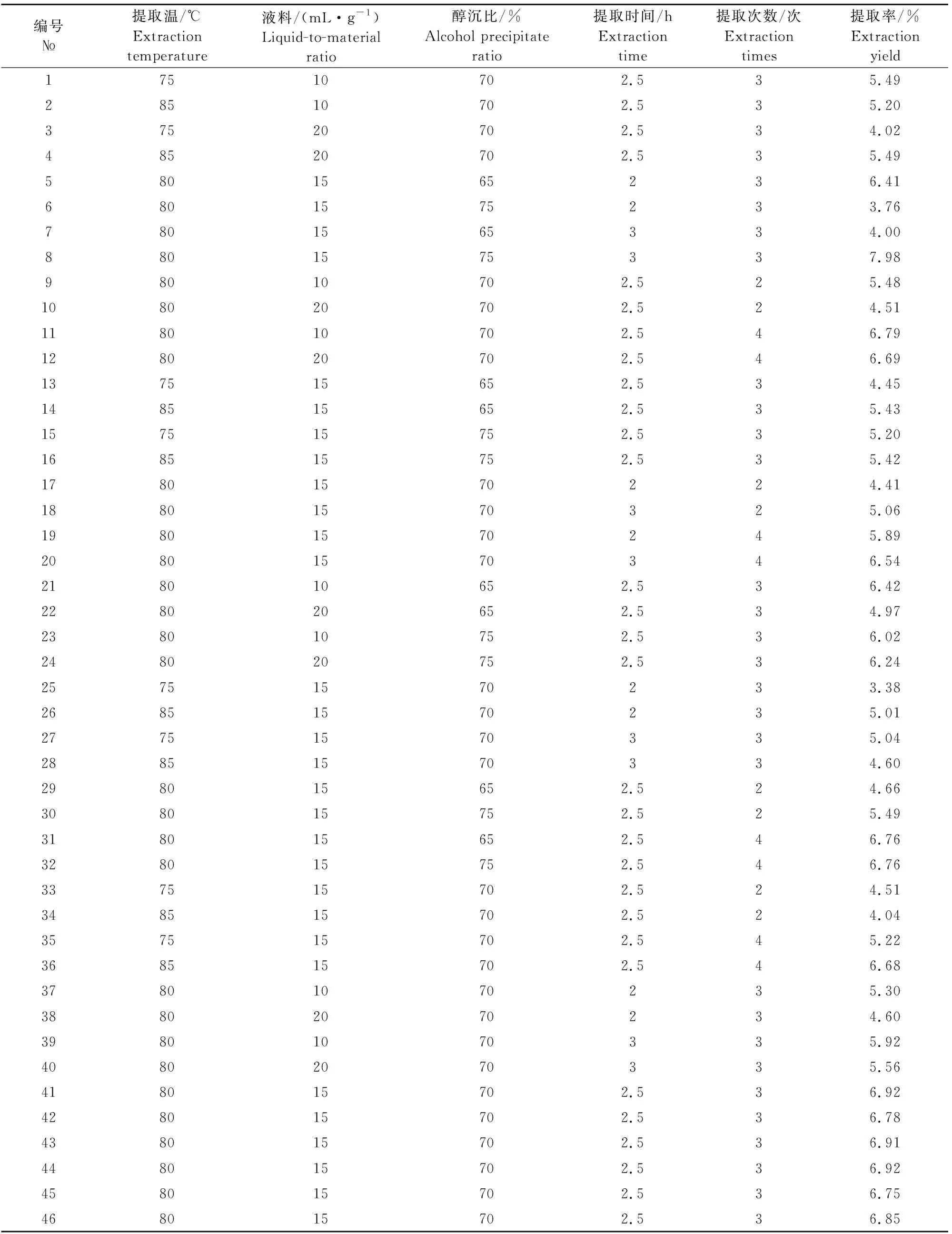
表1红芪多糖提取Box-Behnken试验设计及结果
2.1.4 提取时间对红芪多糖提取率的影响 固定提取温度为80℃,液料比为10 mL/g,提取次数为2次,醇沉比为80%,研究提取时间在1 h~3 h范围内对红芪多糖提取率的影响。随着提取时间的不断增加,红芪多糖的提取率不断增加,当时间在2.5 h时,多糖的提取率达到最大值,2.5 h后随着时间的增加,红芪多糖的提取率反而下降,所以选择2.5 h作为最佳提取时间。在药物提取过程中,延长提取时间可提高多糖的得率。但过长的提取时间也会引起多糖分子结构的改变,从而降低多糖的提取率。
2.1.5 提取次数对红芪多糖提取率的影响 固定提取温度为80℃,提取时间为1 h,液料比为10 mL/g,醇沉比为80%,研究提取次数在1~5次范围内对红芪多糖提取率的影响。随提取次数的增加,多糖的提取率也随之增加。当提取次数达到3次后,多糖的提取率变化不大,所以选择3次作为最佳提取次数。当提取次数超过3次时,对提取率的影响不大。因此,将提取率和加工成本考虑在内,提取3次就足够了。若仅进行一次提取,不能将多糖最大限度的提取完全,造成原料的浪费。
2.2 响应面法试验
2.2.1 各响应面条件下提取率结果 采用 Design-Expert 8.0.6软件,通过多元二次回归方程来拟合各因素与响应值之间的函数关系,考察提取温度、提取时间、提取次数、液料比和醇沉比对红芪多糖提取率的影响。通过对回归方程的分析来寻求最优工艺参数,试验设计及结果见表2。
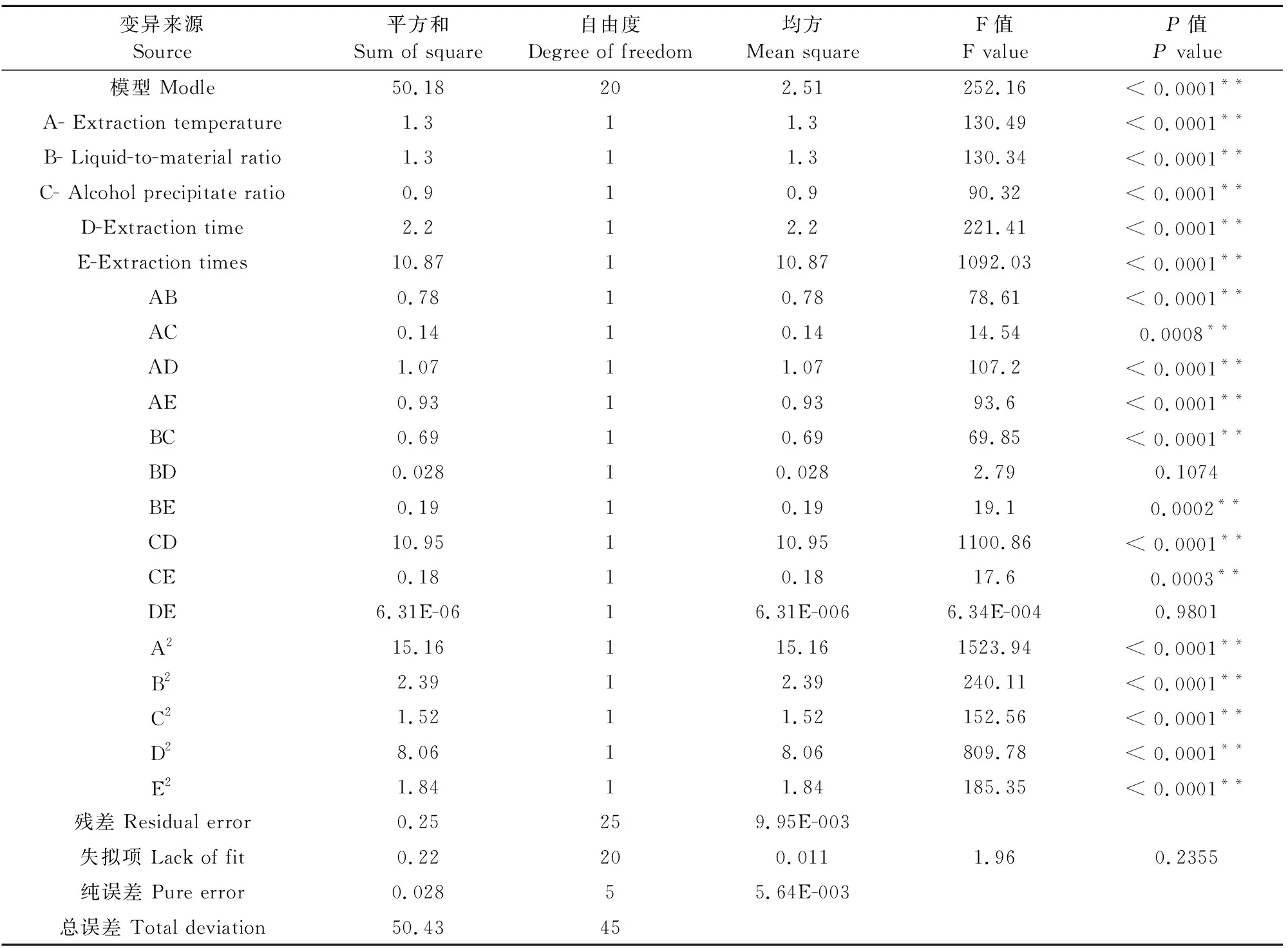
表2红芪多糖提取率的显著性检验及方差分析
2.2.2 建立回归模型及显著性检验 利用 Design-Expert 8.0.6软件对表 2 中的数据进行多元回归拟合,得到二次项回归方程:y=6.86+0.28A-0.28B+0.24C+0.37D+0.82E+0.44AB-0.19AC-0.52AD+0.48AE+0.2BC+0.083BD+0.22BE+1.65CD-0.21CE-1.256-003DE-1.32A2-0.52B2-0.42C2-0.96D2-0.46E2。
其中Y为红芪多糖的提取率,A、B、C、D和E分别代表提取温度、液料比、醇沉比、提取时间和提取次数。

2.2.3 各因素之间的交互作用 采用响应面法对提取参数与红芪多糖提取率之间的关系进行了三维响应面图和等高线图的研究。圆形或椭圆形等高线图的形状表明变量之间的相互作用是否显著。
三维响应面图表示,随着提取温度的升高和液料比的增加,多糖的提取率逐渐增加,当这两变量上升到峰值时,多糖的提取率将下降。等高线图表示,沿提取温度轴等高线变化密集,说明提取温度对响应值的影响比液料比影响显著。等高线呈椭圆形,说明两因素的交互作用较强,影响显著(图1)。
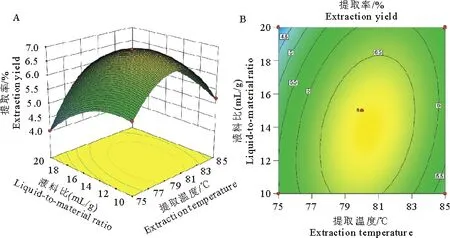
图1提取温度与液料比对红芪多糖提取率的影响
随着提取温度的上升,多糖提取率逐渐提高到最大,然后呈现下降趋势。而随着醇沉比的增加多糖的提取率变化不大。等高线图表示,沿提取温度轴等高线变化密集,说明提取温度对响应值的影响比醇沉比影响显著。等高线呈椭圆形,说明两因素的交互作用较强,影响显著(图2)。
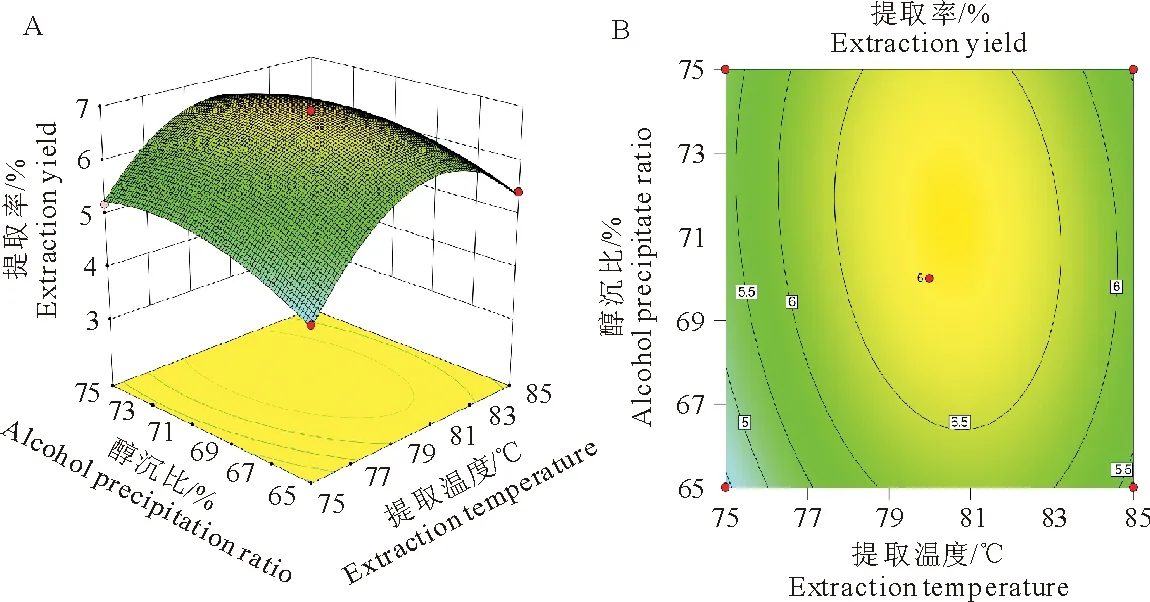
图2提取温度与醇沉比对红芪多糖提取率的影响
随着提取温度的升高和提取时间的增加,多糖的提取率显著增加,当这两变量上升到峰值时,多糖的提取率将不停的下降。等高线图表示,提取时间对响应值峰值的影响比提取温度交互作用较强,影响显著。等高线呈椭圆形,说明两因素的交互作用较强,影响显著(图3)。
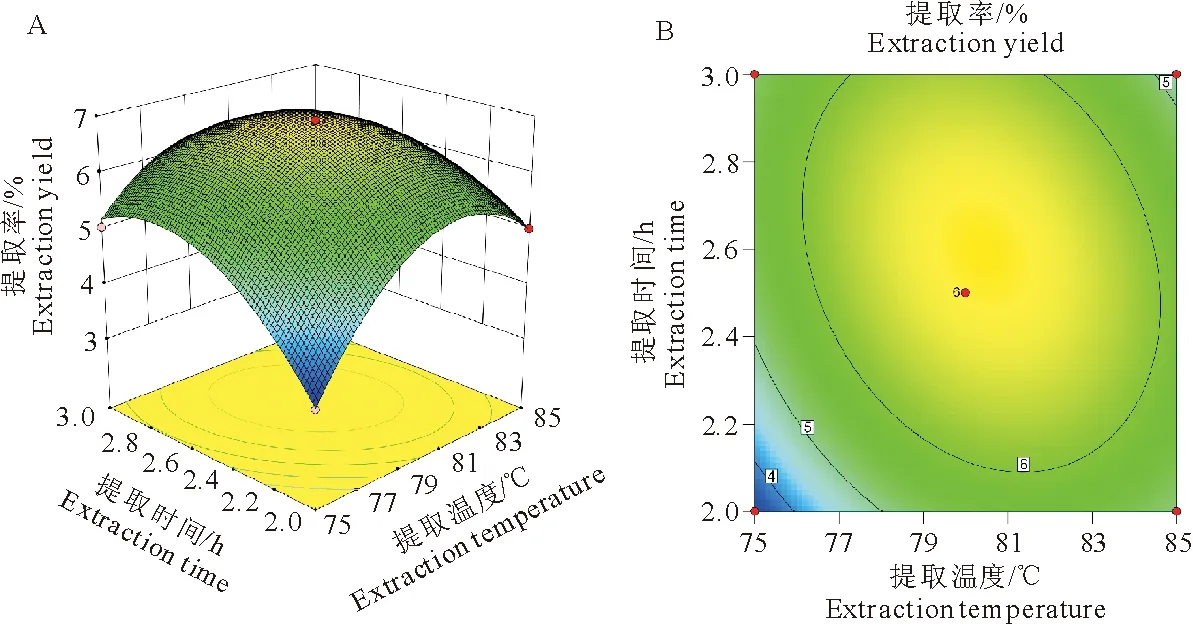
图3提取温度与提取时间对红芪多糖提取率的影响
随着提取温度的上升,多糖提取率缓慢增加到最大值时,然后逐渐下降。而随着提取次数的增加多糖的提取率不断增加。等高线图表示,提取次数对响应值峰值的影响比提取温度交互作用较强,影响显著。等高线呈椭圆形,说明两因素的交互作用较强,影响显著(图4)。

图4提取温度与提取次数对红芪多糖提取率的影响
当醇沉比在65%~70%时,随着液料比的增加提取率不断增加;之后随醇沉比的增加,提取率变化不大;而醇沉比对多糖提取率的影响变化不大。等高线呈椭圆形,说明两因素的交互作用较强,影响显著(图5)。
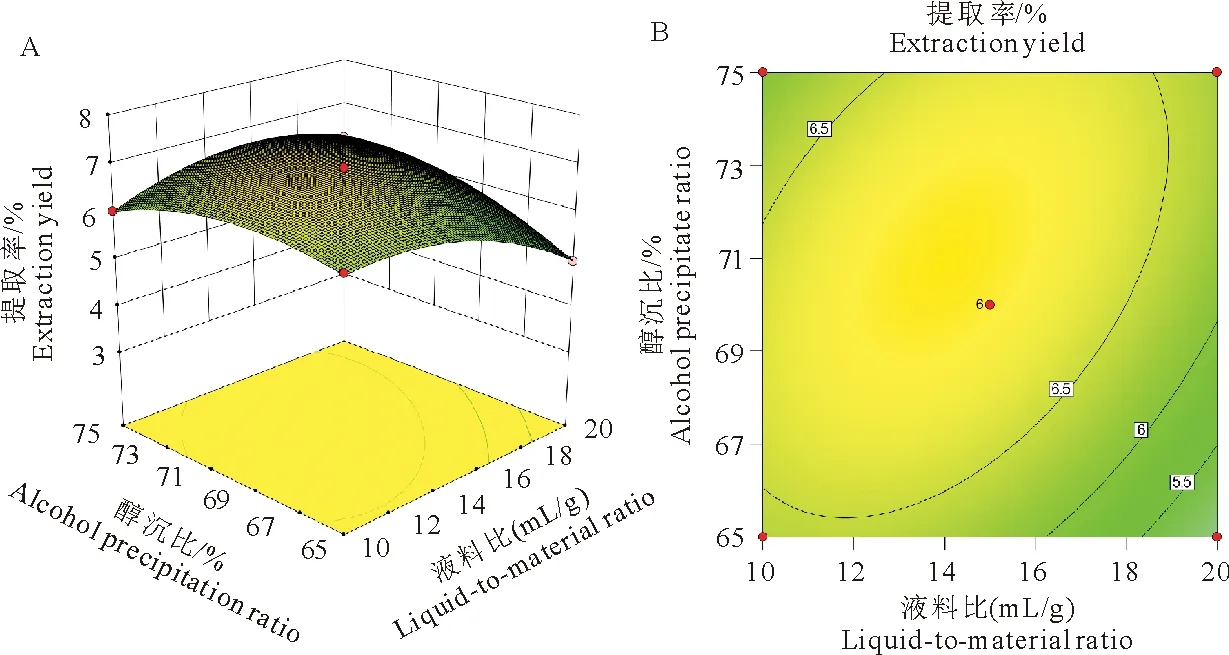
图5液料比与醇沉比对红芪多糖提取率的影响
随着提取时间的增加,多糖提取率不断增加到最大值后略有下降。而随着液料比的增加多糖的提取率也不断增加。等高线图表示,提取时间轴等高线密集,而液料比轴等高线相对稀疏,说明提取时间对响应值峰值的影响比液料比交互作用强(图6)。

图6液料比与提取时间对红芪多糖提取率的影响
随着提取次数的增加,多糖提取率呈增加趋势。而随着液料比的增加多糖的提取率变化不大。等高线图表示,提取次数轴等高线密集,而液料比轴等高线相对稀疏,说明提取次数对响应值峰值的影响比液料比交互作用较强,影响显著(图7)。

图7液料比与提取次数对红芪多糖提取率的影响
当提取时间2 h~2.5 h时,多糖提取率呈上升趋势,随着提取时间增加,提取率略有下降。等高线图表示,沿提取时间轴等高线变化密集,说明提取时间对响应值的影响比醇沉比影响显著(图8)。
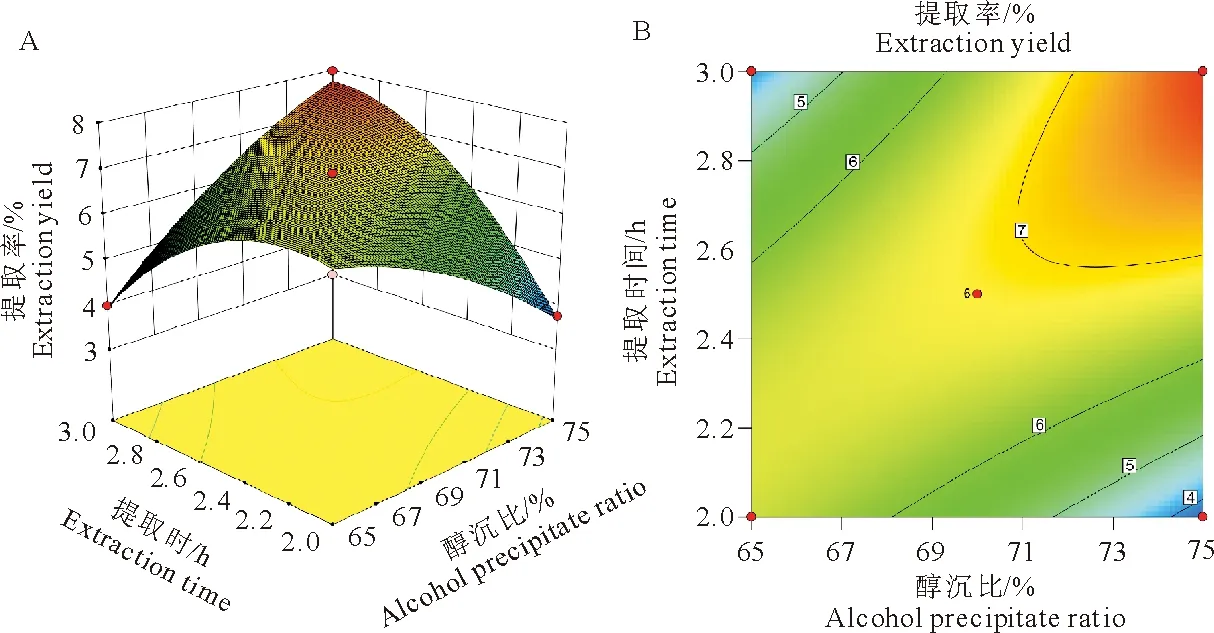
图8醇沉比与提取时间对红芪多糖提取率的影响
随着提取次数的增加,多糖提取率逐渐增加,而随着醇沉比的增加多糖的提取率变化不大。等高线图表示,沿提取次数轴等高线变化密集,说明提取次数对响应值的影响比醇沉比影响显著。等高线呈椭圆形,说明两因素的交互作用较强,影响显著(图9)。

图9醇沉比与提取次数对红芪多糖提取率的影响
随着提取时间的增加,多糖提取率先缓慢增加后下降。而随着提取次数的增加多糖的提取率不断增加。等高线图表示,沿提取次数轴等高线变化密集,说明提取次数对响应值的影响比提取时间影响显著。等高线呈圆形,说明两因素的交互作用不显著(图10)。
综上所述,温度与液料比、温度与醇沉比、温度与时间、温度与次数、液料比与醇沉比、液料比与次数、醇沉比与时间、液料比与次数的交互作用极显著,影响红芪多糖提取率因素的主次顺序为提取次数>提取时间>提取温度>液料比>醇沉比。

图10提取时间与提取次数对红芪多糖提取率的影响
2.2.4 响应面试验方案优化及结果验证 通过Design-Expert 8.0.6软件分析得出红芪多糖最佳提取工艺条件为:提取温度80 ℃,提取时间3 h,提取次数4次,液料比17 mL/g,醇沉比75%,红芪多糖理论提取率为8.01%。在此条件下做3次平行试验进行验证,红芪多糖平均提取率为7.70%。独立性t检验理论值与实际值之间无显著性差异(P>0.05),说明该模型的预测条件与实际情况相吻合,模型建立成功,故此方案可行,可以广泛推行。
3 讨论
多糖的提取方法主要有稀碱或稀酸提取法、酶解法以及水提醇沉法等[10]。由于酸和碱易引起糖苷键的断裂造成多糖得率降低,故往往采用热水作为提取剂。酶解法会引入其他蛋白,除蛋白效果不是很好。水提醇沉法操作步骤简单,成本低且安全,被广泛应用于中药制剂研发和生产中,尤其在口服药液或注射液纯化过程中,是我国中药生产企业首选的分离提纯技术之一。醇沉能够提高单味药有效成分含量的提取和纯化,减少中药的服用剂量;乙醇本身还具有杀菌作用,经醇沉处理后的中药液不易发霉变质。红芪多糖属于水溶性多糖,通过多糖不溶于乙醇的性质,使红芪多糖从提取液中析出,故采用水提醇沉法进行提取。
在药物研发领域通常采用正交试验设计、均匀试验设计或响应面试验设计等进行工艺优化。正交设计方法是一种用线性数学模型进行设计的方法,可以找出几个因素水平的最佳组合,但它不能找出整个区域上因素和响应值之间的一个明确的函数表达式,只能分析离散型数据,无法获得设计变量的最优组合,所以精确度不高,预测性不佳。并且当试验因素水平数较多时,采用正交设计方法需要进行大量的试验,实施起来比较困难[11]。均匀设计以牺牲部分正交性、最大化地追求均匀性来达到减少试验次数为目的。当试验次数少于因素个数时,采用多重回归的方法来研究响应变量随自变量的变化的回归方程就不是唯一的,而且其在试验设计时没有考虑全部交互作用,只有通过回归分析时引入因素之间的交叉乘积项等来进行探索,因此其结果不够稳定[12]。因此,需要找到一种试验次数少、周期短、求得的同归方程精度高、预测性能好,能研究几种因素间交互作用的回归分析方法,响应面分析方法很大程度上满足了这些要求。响应面法是一种高效、便捷的统计方法,它将实验设计和数学建模相结合起来,通过对具有代表性的局部各点进行试验,回归拟合全局范围内因素与响应值之间的函数关系,有助于快速建模缩短优化时间和提高应用可信度。而且响应面法得到的是一个连续的曲面,能够对各个水平进行连续分析[13]。通过对函数响应面和等高线的分析对影响响应值的各因素水平及其交互作用进行优化和评价快速有效地确定多因素系统的最佳条件[14]。所以,本研究采用响应面法来优化红芪多糖的水提醇沉方案。
研究发现,影响水提醇沉法提取红芪多糖的因素有浸提温度、浸提次数、浸提时间和料液比。通过苦瓜多糖水提醇沉、大黄不同醇沉产物、猴头菇多糖水提醇沉等研究表明,不同的多糖有着不同的最适醇沉浓度,所以醇沉比也是影响多糖提取率的一个重要因素[15-17]。文献报道,红芪多糖水提醇沉工艺多以含量或得率为评价标准进行工艺的优化。本试验以提取率(含量与得率的乘积)为衡量指标,从整体角度更加客观、科学地评价了红芪多糖提取工艺,并在单因素试验基础上用响应面法考查提取温度、液料比、醇沉比、提取时间和提取次数对红芪多糖提取工艺的优化,最终得到红芪多糖的最佳提取条件采用单因素结合响应面法建立红芪多糖的提取工艺稳定可行,可为红芪多糖的有效提取提供理论依据。
