近10年青岛市9家医院安乃近临床使用中安全性分析
2021-04-06陈春
陈春
(青岛市第八人民医院药学部,青岛 266121)
安乃近是吡唑酮类解热镇痛抗炎药,为氨基比林和亚硫酸钠相结合的化合物,易溶于水,其解热和镇痛作用较氨基比林快且强,注射给药可迅速见效,适用于急性高热时的紧急退热,但临床不良反应报道也较多[1]。20世纪40年代末,西方各国相继不再将安乃近应用于临床,我国于1982年淘汰安乃近复方片剂,而其他制剂(如注射剂)至今仍在使用,例如安乃近片剂、滴剂、注射剂,在临床上用于解热、头痛、偏头痛、肌肉痛、关节痛及痛经,同时亦有较强的抗风湿作用,可用于急性风湿性关节炎。由于安乃近及其制剂存在粒细胞缺乏等严重不良反应风险,药监部门一直对安乃近及其制剂的使用进行持续不良反应监测和预警[2]。本研究对近10年间青岛市9家公立医院安乃近及其制剂临床使用中不良反应情况调研分析,以期为安乃近的临床安全性进行预警,为药监部门制定应对策略提供参考。
1 资料与方法
1.1临床用药资料 通过向各医院药学部门发放临床用药调研表的方式,收集2008年6月—2018年6月青岛市中心医院、青岛市市立医院、青岛市第五人民医院、青岛市第八人民医院、青岛大学附属医院及黄岛分院、青岛市妇女儿童医院、齐鲁医院青岛分院、解放军第401医院等9家医院安乃近及其相关制剂使用情况,通过药物的不良反应直报系统统计临床不良反应的监测报告情况。
1.2方法
1.2.1宏观调查 向各医院药库及药房发放临床用药调研表,取得调查年限内安乃近制剂药品的基本信息,了解相关药品名称、生产厂家及消耗数量,并通过向临床药理科室发放调研表,取得相关制剂不良反应发生情况。同时,通过国家药监局网站数据查询系统查询安乃近制剂审批和生产情况。
1.2.2微观调查 通过门诊药房、住院药房、中心摆药室及药库的计算机信息系统,追踪安乃近制剂每一种药的生产企业、销售金额及科室使用情况。
1.3统计学处理 利用Excel表对数据进行汇总,采用相应的分析软件对数据进行统计分析。
2 结果
2.1安乃近制剂的基本情况 在我国上市的安乃近制剂,包括安乃近片、安乃近注射液等11个品种,临床上主要用于解热镇痛、小儿退热及重症感冒的治疗,所涉及安乃近制剂见表1。据国家药监局网站查询,我国安乃近制剂批准文号近1400个,涉及生产企业近1000家,大部分企业现在已不再生产,年销售额总计约2亿元;安乃近原料药批准文号7个,生产企业6家,年销售额约4亿元,除了用于人用药品的生产外,也用于兽药生产。

表1 不同临床适应证所涉及安乃近制剂的常用品种
2.2安乃近制剂的用药金额统计 在统计的10年间,安乃近制剂使用量呈现逐年下降趋势,安乃近制剂销售金额也逐年下降,安乃近制剂销售金额占同类产品总销售金额降至2.2%,主要与近年来医务工作者对相关制剂认识越来越多,安乃近制剂的临床不良反应被大量的报道和讨论相关。同时,非甾体抗炎类的使用及优化,有了更多更好的选择,安乃近制剂逐渐被淘汰[3]。而目前临床应用较多的安乃近制剂主要集中在小儿退热的外用制剂,如安乃近滴剂、小儿解热栓,重感灵胶囊等复方制剂,具体销售金额见表2。
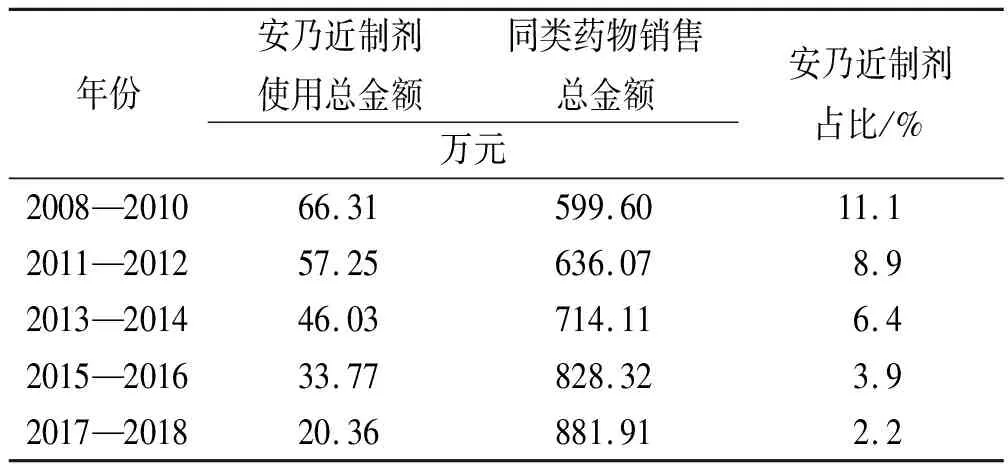
表2 安乃近制剂的用药金额及同类药物使用占比统计
2.3安乃近制剂的不良事件报告统计 10年间,不良反应监测系统共监测到安乃近制剂相关不良事件2 099例,主要不良反应表现为变态反应,尤其是皮肤变态反应较多;其次为全身性变态反应主要表现为胸闷、呼吸困难及头晕等症状。其中出现严重不良反应报告112例,主要表现为过敏性休克、严重皮肤损伤、粒细胞缺乏症、血小板减少以及再生障碍性贫血等症状,具体数据见表3。

表3 安乃近制剂严重不良反应主要表现形式及病例数量
安乃近作为早期开发的非甾体抗炎类药物,在治疗解热、镇痛、抗炎,乃至抗风湿性疾病均有一定作用。在所有监测到与安乃近制剂相关的2099例不良事件中,针对临床不同适应证,将安乃近制剂相关不良事件发生情况进行了归纳总结,结果显示安乃近及其制剂临床上不良事件主要发生在联合治疗解热镇痛的适应证,也是安乃近制剂的最主要的临床应用,这可能与用药剂量较高有关;其次是单独在治疗镇痛适应证,镇痛作用也是安乃近的主要适应证,除治疗头痛和偏头痛外,安乃近还对肌肉疼痛、关节痛、痛经等具有广泛的镇痛作用;安乃近制剂不良事件在治疗风湿病适应证发生数量最小,主要原因可能是安乃近制剂不是常用的抗风湿药物,且抗风湿药物需要长期用药,风险相对较高,很少在临床治疗应用[4]。具体结果见表4。

表4 安乃近制剂严重不良事件主要发生的适应证及病例数
2.4安乃近制剂相关不良事件产生原因分析 安乃近制剂主要不良反应表现为泌尿系统、血液系统与造血系统损伤,如粒细胞缺乏症、血小板减少症等,正常剂量与超大剂量均可导致严重不良反应或药物不良事件(adverse drug events,ADEs)的发生甚至致死。正常用药剂量下,药物不良事件发生原因主要还是药品不良反应导致的,这些不良反应的产生主要是由药物本身的结构的理化性质所决定的,所占比例也最大(39.2%)。非正常剂量用药引起的不良反应主要为超说明书用药以及联合用药产生的毒副作用;其中超说明书剂量及适应证范围用药可能因剂量增加产生更大毒性;安乃近相关制剂的联合用药不良事件主要表现为安乃近注射液与林可霉素混合静脉推注、与氨基比林混合(或分开)肌内注射,安乃近口服片剂与强力感冒片、索米痛、布洛芬片、氟苯尼考等联合口服用药,占比为25.2%。同时,用药患者的自身原因也会对安乃近的用药产生影响,如患者自身原发病及相关药物过敏史等,占比为17%。具体见表5。

表5 安乃近制剂不良事件产生的相关因素分析
3 讨论
安乃近是氨基比林和亚硫酸钠结合形成的化合物,20世纪20年代即开始作为解热镇痛药用于临床[5]。由于其吸收完全、起效快、解热作用显著、镇痛作用强,疗效确切,安乃近及其制剂在很长的一段历史时期成为临床常用的治疗药物,尤其在农村基层医疗机构使用较多,因此为《中华人民共和国药典》(2005年版)收载品种和乙类医保品种[6]。
2018年互联网上一篇《美国禁用40年的退烧药,我们还在给孩子吃》的文章,“古老”的退热止痛药物安乃近吸引了大众的关注。由于不规范用药等原因,恶性不良反应事件频繁发生,如泌尿系统、血液系统与造血系统损伤,急性肾衰竭、暴发性血小板减少等。国内文献调研[7-8],安乃近由于其不良反应严重,以泌尿系统损伤最为多见,对血液和造血系统损伤以及引发过敏性休克等最为严重。国外文献[9-10]研究显示,安乃近引发的血液及造血系统损害最为常见,以粒细胞缺乏发生率最高。
自20世纪60年代起,各国药品监管部门对于安乃近及其制剂可导致粒细胞缺乏症等严重安全性问题十分担忧,也纷纷采取撤市等措施。1974年瑞典将安乃近所有的剂型撤市,1977年美国FDA也宣布从市场撤出安乃近全部剂型。此后,澳大利亚、法国、新加坡等30多个国家,分别采取措施对安乃近制剂部分撤市或限制使用措施。然而,目前仍有包括德国、俄罗斯、西班牙、日本等在内的60余个国家仍在使用安乃近制剂。HOFFMAWN等[11]报道,安乃近在德国作为解热药物的应用日益增加,1999年该药应用了1100万个剂量,2012年高达14200万个剂量;比较之下,镇痛药物昔布类非甾体抗炎药在2012年仅应用9800万个剂量。德国学者的荟萃分析显示,2009年共有199 291个处方应用安乃近,全科医生处方占78.9%,外科和骨科处方占11.8%。德国和瑞士的研究都肯定了安乃近的安全性。
在我国,含安乃近的药品均作为处方药管理,未列入2012年版国家基本药物目录。但安乃近片、重感灵片胶囊等安乃近制剂列入2017年国家医保乙类品种,安乃近注射液、安乃近滴鼻剂等列入部分省医保目录。目前,安乃近在中国的适应证为:高热、头痛、偏头痛、肌肉痛、关节痛、痛经等。也有较强的抗风湿作用,可用于急性风湿性关节炎,但由于抗风湿需要长期用药,有可能引起严重的不良反应,所以在该领域应用较少。国外学者研究[12]发现,安乃近在短期用于缓解轻、中度疼痛时,与同等剂量的其他解热镇痛药比较,其致严重不良反应的危险性并不高。因此,1995年瑞典重新批准安乃近50 mg片剂和500 mg·mL-1注射剂,用于短期治疗组织损伤(例如手术损伤和创伤)后的急性中、重度疼痛和急性中、重度绞痛(例如尿道和胆道绞痛)。
据国家药品监督管理局官方网站获悉,药监部门为了应对网络上对于“安乃近在国内应用”的质疑,先后两次组织专家对安乃近制剂在我国的安全性有效性和临床使用情况进行了评价。专家认为,安乃近片剂和注射剂具有疗效确切的优势,但也存在粒细胞缺乏症等严重不良反应,不良反应多发的主要原因在于基层使用风险管控力度不足;同时,安乃近制剂均不是临床必需药品,具有多种安全性和有效性更可靠的同类替代药品。另有专家分析[13],重感灵等复方安乃近制剂组方不尽合理,小儿解热栓用于儿童安全风险也较为突出。据调研[14],安乃近相关制剂主要在基层使用,尤其是在偏远贫困山区,由于基层医疗水平相对较差,医疗过程中存在不合理用药的风险。
随着人们对医药技术和科学认知的发展,特别是2017年10月中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品和医疗器械创新的意见》出台,一些老品种安全风险逐渐凸显,而替代品不断出现,“老药”在临床应用中的风险获益比值持续发生变化。安乃近制剂尽管具备价格低廉、疗效确切的优势,但相关制剂品种安全风险突出,基层使用风险控制能力欠缺,同时有同类替代药品可选择。因此,医务人员在使用这些药物时更要权衡利弊,谨慎使用,权衡安乃近及其复方制剂对患者的获益与风险。为了更好保障临床用药安全合理,对安乃近相关制剂产品的临床应用提出以下建议。
①组织开展安乃近相关制剂临床应用情况的调研,尤其是国家卫生健康行政部门应当对基层卫生院及贫困偏远山区卫生所和乡村医生使用相关药品情况进行调研,进一步厘清安乃近相关制剂临床应用特点,制定适宜的临床用药监测方案。由于安乃近相关制剂在国内应用多年,在部分基层人群中存在习惯性依赖,且相关制剂涉及生产药品企业数量较多,“一刀切”的推进安乃近相关制剂撤市不一定是最佳方案。总之,以有效性和安全性为基础的效益风险比是决定药品撤市的唯一标准。
②对于安乃近相关制剂的生产流通方面,更要做好严格把关。药品生产企业要做好权衡利弊分析,针对产品的不良反应进行工艺改进或产品改良,同时做好产品生产流通过程中不良反应的监测和反馈;药品审评审批部门要关注该类药物的不良事件发生情况及新药临床需求,审慎应对相关药品的审批;国家药品招标采购部门也要积极学习安乃近相关制剂等高ADR发生品种的临床应用情况反馈,合理的制定药品招标采购目录,最大限度的保障人民群众用药安全。
③对相关药品进行全面的上市后再评价工作。根据《中华人民共和国药品管理法》实施条例:国务院药品监督管理部门对已经批准生产销售的药品进行再评价,根据药品再评价结果可以采取责令修改药品说明书,暂停生产销售和使用的措施。对于安乃近相关制剂的再评价工作,可以根据不同制剂药品的临床使用情况,综合相关药品不良反应监测数据,制定再评价方案。同时,结合药品生产企业的意见,对于销量很低,或者不良反应大、其他原因危害人体健康的药品,充分权衡后显示风险大于获益,应当撤销该药品批准文件。对于不良反应可控的药品,可以通过对药品说明书的修改进行警示,如美国FDA对于上市药品出现的严重不良反应会责令企业在药品说明书加黑框警告,以提示临床用药安全。
