柑橘香橙素生成途径关键酶黄烷酮-3-羟化酶特性分析及原核表达
2021-04-02田苗苗肖妃垚
黄 旭,田苗苗,肖妃垚,刘 娟,王 振,单 杨
(湖南大学 隆平分院,湖南 长沙 410082;湖南省农业科学院 农产品加工研究所/果蔬贮藏加工与质量安全湖南省重点实验室/湖南省果蔬加工与质量安全国际科技创新合作基地,湖南 长沙 410125)
类黄酮是柑橘中最重要的一类生物活性成分,包括黄烷醇、黄酮、黄烷酮、黄酮醇、二氢黄酮醇和花色苷[1],具有促进健康的功能,如:抗炎、抗癌、抗氧化等[2]。作为类黄酮化合物中的一类,二氢黄酮醇通常在柑橘等植物液泡中以糖苷衍生物的形式存在[3]。获取二氢黄酮醇的方法主要是提取法和合成法。提取法包括溶剂提取法、超声提取法和酶解法[4]等,合成法[5]包括化学合成法和生物催化合成法[6]等。提取法和化学合成法虽然发展成熟但仍存在化学物质残留、副产物过多等不利因素[7]。近年来,生物催化合成的方法以廉价底物合成高价值的目的产物越来越受到人们广泛关注。借助于微生物进行改造后生产天然产物能够不受季节限制,还具有反应温和、选择性强等优点,对生产高附加值食品及保健品等原料具有极大优势[8]。
黄烷酮-3-羟化酶(flavanone-3-hydroxylase,F3H)能够催化黄烷酮类化合物柚皮素在C- 3位置立体定向羟基化,合成二氢黄酮醇香橙素(见图1),是黄酮醇化合物和花色苷生物代谢途径上的关键酶之一[9]。

图1 柚皮素在黄烷酮-3-羟化酶的作用下合成香橙素的路线Fig.1 Aromadendrin synthesis pathway from naringenin catalyzed by flavanone-3-hydroxylase
Forkmann等[10]在紫罗兰中首次发现F3H并对其酶活性和纯化鉴定进行了报道,在后续研究中发现在酶催化反应过程中也同样需要氧气、酮戊二酸盐、亚铁离子和抗坏血酸作为辅助因子[11]。有重组蛋白研究发现不同种类的F3H还具有不同范围的底物偏好性和催化活性[2]。而f3h在金鱼草[12]中首次克隆成功后,在拟南芥[13]、草莓[14]、茄子[15]、百合[16]中也陆续被发现。本研究选取了在NCBI上进行注册的5种F3H,利用生物信息学的分析方法对酶的理化性质、蛋白质结构、基因序列等进行比较与总结并构建异源表达体系进行原核表达,以期对香橙素生成途径F3H的酶学特征进行了解,从而总结不同物种之间的f3h基因多样性和多态性,以利于日后利用原核生物进行生物合成类黄酮化合物,也为后续进一步改造f3h基因工程菌提供材料。
1 材料与方法
1.1 数据采集
将目前在NCBI上已注册的F3H进行筛选,最终选取了5种已注册的F3H作为研究对象(见表1),分别是来源于柑橘的CF3H(GQ121373.1)、陆地棉的GhF3H(EF187440.1)、玉米的ZmF3H(U04434.1)、水母雪莲的SmF3H(AY550120.1)以及欧芹的PcF3H(AY230248.1)。并从NCBI数据库中获取了核酸序列及蛋白质序列。所选取的不同来源的F3H均是完整序列。

表1 不同物种的F3HTab.1 F3H of different species
1.2 菌株和试剂
质粒pET32a- GhF3H,pET32a- CF3H,pET32a- PcF3H,pET32a- SmF3H和pET32a- ZmF3H由上海生工公司合成,E.coliBL21购于上海生工公司。SDS- PAGE凝胶制备试剂盒、LB液体培养基购自北京索莱宝科技有限公司;蛋白Marker,美国Thermo公司;IPTG购自上海瑞永生物科技公司;α-酮戊二酸购自阿拉丁试剂(上海)有限公司;FeSO4·7H2O,购自上海沪试试剂公司;柚皮素,分析纯,上海麦克林生化科技有限公司,柚皮素、香橙素,质量分数≥98%,上海源叶生物科技有限公司。其余试剂均为分析纯。
1.3 仪器与设备
LDZM- 80L- Ⅲ型高压灭菌锅,上海申安医疗器械厂;JY96- IIN型超声破碎仪,宁波新芝生物科技股份有限公司;SYNERGY H1型酶标仪,美国Bio Tek公司;H- class型超高效液相色谱仪,美国Waters公司;qtof6550型质谱仪,美国安捷伦公司;Mini- PROTEAN Tetra Cell 1658004型蛋白电泳仪,美国Bio- Rad公司;Avanti J- 26XP型离心机,美国Beckman公司。
1.4 实验方法
1.4.1利用生物信息对酶筛选
1.4.1.1 基本理化性质
通过expasy工具包中的ProtParam(https:∥web.expasy.org/protparam/)[17]以及NCBI提供的ORFfinder(https:∥www.ncbi.nlm.nih.gov/orffinder/)[18]分析,可获得氨基酸数(aa)、分子质量(kDa)、等电点、不稳定系数、脂肪指数以及开放阅读框长度等理化分析信息;通过expasy工具包中ProtScale(https:∥web.expasy.org/protscale/)工具在线预测F3H亲疏水性;通过网站(http:∥biotech.ou.edu/)可在假设该蛋白质在原核表达体系过表达的前提下,预测此蛋白质在大肠杆菌中溶解的可能性[19]。
1.4.1.2 保守功能域结果分析,跨膜结构及信号肽分析
通过NCBI网站中提供的工具Conserved Domains(https:∥www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线分析鉴定出蛋白质序列包括的保守结构域[20],用TMHMM v.2.0软件(http:∥www.cbs.dtu.dk/services/TMHMM/)对酶的跨膜螺旋状态进行预测[21];利用Signal 4.0软件(http:∥www.cbs.dtu.dk/services/SignalP- 4.0/)能预测在原核生物的氨基酸序列中信号肽位点是否存在及位置信息[22]。
1.4.1.3 蛋白质二、三级结构及配体结合位点分析
利用在线软件SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白二级结构[23]。考虑到序列相似度≥30%,使用SWISS-MODEL软件(https:∥swissmodel.expasy.org/)同源性建模来预测蛋白质三级结构[24],对不同来源的F3H进行蛋白二级结构和三级结构的分析;通过COACH在线软件(https:∥zhanglab.ccmb.med.umich.edu/COACH/)[25-26]进行蛋白质- 配体结合位点预测,从而预测配体的结合位点,进行蛋白信息分析。
1.4.1.4 序列比对分析
对所有物种来源的F3H序列用ClustalX 2.1及DNAMAN 8进行多重序列比对来研究一组序列的关系。
1.4.2重组菌株培养条件
将质粒pET32a与筛选出的酶基因序列经双酶切后进行连接重组为pET32a- F3H。将pET32a- GhF3H,pET32a- CF3H,pET32a- PcF3H,pET32a- SmF3H和pET32a- ZmF3H质粒分别转入EscherichiacoliBL21中后获得对应的5株重组菌株。将其涂布在含有氨苄的LB固体培养基,在37 ℃培养箱中放置10 h后观察菌株生长情况,挑取其中生长状况良好的单菌落,重新接种在含有氨苄的LB液体培养基中,培养至菌株浓度OD值约为0.6时,以V(菌液)∶V(体积分数为60%的甘油水溶液)=1∶1分装在冻存管中,保存在-80 ℃冰箱。
1.4.3重组pET32a- F3H质粒诱导表达
取5株重组目的菌株各20 μL分别装于3 mL含100 μg/mL氨苄的LB液体培养基中,在37 ℃,220 r/min的摇床中进行活化,过夜培养约10 h后取200 μL菌液接种于30 mL含有氨苄的LB液体培养基中进行扩大培养,当OD值在0.7~0.8时加入终浓度为0.2 mmol/L的诱导剂IPTG进行低温诱导,在23 ℃,220 r/min的摇床中培养24 h后收集菌体,用PBS溶液重悬后进行破碎,分别收集匀浆液及上清液,SDS- PAGE检测重组pET32a- F3H。
1.4.4重组菌株发酵液处理
在诱导后的菌液中添加终浓度为100 mg/L的柚皮素和FeSO4(终浓度为0.1 mmol/L)以及α-酮戊二酸(终浓度为8.2 mmol/L),必要时可添加少量抗坏血酸。在23 ℃,220 r/min摇床中继续培养24 h后取不同菌株的发酵液转移至15 mL离心管,将发酵液超声破碎后加入等体积乙酸乙酯萃取,静置后在3 700 r/min,4 ℃,10 min条件下离心,取上层有机相进行氮吹,待有机相挥发完全后加入1 mL甲醇复溶,将得到的溶解液经0.22 μm滤膜过滤后转移至液相瓶,用HPLC进行分析。
2 结果与分析
2.1 生物信息学分析
2.1.1基本理化性质分析结果
来自5种不同物种的f3h分析,分析结果见表2。由表2可知,5种f3h基本理化性质具有一定规律性。其基因开放阅读框(ORF)为1 032~1 119 bp,编码的氨基酸长度基本在343~372个,蛋白分子质量为38.89~41.45 kDa,理论等电点在5.43~5.96,偏酸性。蛋白质的稳定系数不统一,其中只有GhF3H是稳定蛋白,稳定指数在38.86。剩余全部为不稳定蛋白,不稳定指数在40.01~46.60。脂肪指数指的是脂肪族氨基酸占蛋白质的相对含量,比例在77.52~83.68,说明其热稳定性较好。
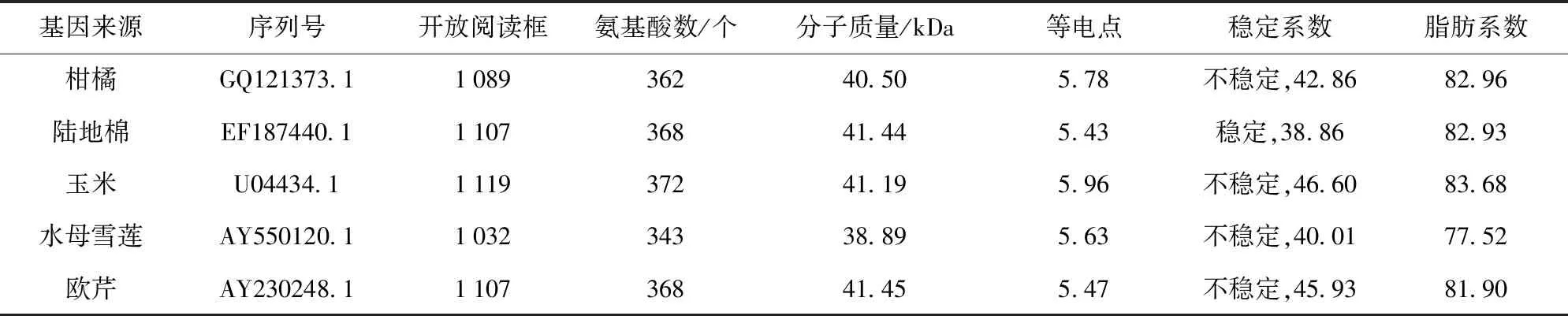
表2 不同物种的F3H基本理化信息Tab.2 Basic physicochemical information of F3H in different species
ProtScale结果分析见表3,5种F3H蛋白亲疏水性预测结果全部为亲水性蛋白质,且亲水性范围在为-0.297~-0.464。预测蛋白亲疏水性有助于后期蛋白的表达、纯化的研究,尤其是在蛋白质纯化方法上可提供良好的参考。
继续分析5种F3H蛋白在正常生长温度下在大肠杆菌中可能的过表达蛋白的溶解度,基本分为低中高三类。溶解度可能性见图2,其中PcF3H和SmF3H预测可能是不溶蛋白,有成为包涵体的可能性;CF3H蛋白溶解度较低为2.90%;ZmF3H蛋白溶解度处于中等为70.20%;最后具有极高溶解度的GhF3H为99.60%。

图2 F3H蛋白在E.coli BL21体内的溶解可能性Fig.2 Dissolution possibility of F3H protein in E.coli BL21
2.1.2保守功能域结果分析
结构域作为蛋白质生理功能的基础独立功能区域[27],保守的结构域能显示一组不变或相同的序列结构域。分析结果显示,选取的5种F3H都具有典型的2OG- Fe- Oxy保守结构域(2OG- Fe(II)加氧酶超家族包含2-氧戊二酸酯(2OG)和Fe(II)依赖性加氧酶超家族)以及PcbC结构域(次级代谢产物的生物合成,转运和分解代谢),这表明:它们都具有同样的催化功能且在反应时需要氧戊二酸,亚铁离子及氧气等辅因子参与。除去SmF3H(AY550120.1)之外全部属于PLN02515,PcbC,2OG- Fe- OXY家族。SmF3H属于PLN02639氧化还原酶家族。
2.1.3跨膜结构结果分析
预测结果表明:来自不同物种的5种酶均为膜外蛋白,不含有膜及跨膜结构,由此推测,F3H蛋白在细胞质基质中合成后不经过跨膜转运,并在细胞质中催化合成类黄酮类物质。
2.1.4蛋白质信号肽结果分析
信号肽一般是由15~30个氨基酸残基形成的短肽链,可以引导蛋白质跨膜运输[28]。在宿主菌中表达外源蛋白时,可用信号肽引导外源蛋白定位分泌到胞外,提高蛋白可溶性。通过分析发现5种F3H蛋白均未发现具有信号肽,表明此类蛋白不属于分泌蛋白[28],可能在胞内进行酶促反应。
2.1.5蛋白质二三级结构及配体结合位点分析结果分析
经SOPMA预测F3H蛋白的二级结构组成,发现他们的二级结构包括α-螺旋,延伸链,β-折叠和无规则卷曲,结果见图3。由图3可知,他们之间各有差异但是总体具有一定的相似性:F3H 蛋白中无规则卷曲和α-螺旋所占比例最多,β-折叠所占比例最少。在F3H二级结构中,α-螺旋占31.99%~38.59%,β-折叠占4.35%~6.18%,延伸链占17.12%~18.82%,剩下则是无规则卷曲部分。

图3 不同物种F3H蛋白的二级结构组成Fig.3 Secondary structure composition of F3H protein in different species
按照序列最大相似度进行建模的蛋白三级结构图结果见图4,经分析比对5种F3H蛋白活性位点发现:虽然5种F3H结合位点各不相同,但也具有一定相似性。其中铁离子及氧戊二酸结合位点主要在蛋白三级结构延伸链上,其中铁离子结合位点可能在220位及280位氨基酸残基附近,氧戊二酸结合位点可能在200位、219位和290位氨基酸残基附近;而黄酮类化合物结合位点在α螺旋和延伸链上都存在,可能结合在221位及290位氨基酸残基附近。

图4 不同物种F3H蛋白的三级结构组成Fig.4 Tertiary structure of F3H protein in different species
2.1.6序列比对结果分析
通过比对结果发现所分析5种不同物种的F3H蛋白具有一定的相似性见图5,相似度为72.07%。不同物种来源的F3H在某些区域具有极高相似度,具有高度保守性的部分区域如281~293与蛋白质结构域预测结果位置相近,推测可能是结构域所在对应位点,这也能够表明:F3H保守结构域的部分氨基酸序列组成具有一定的同源性。

图5 不同物种F3H序列比对结果Fig.5 Results of different F3H sequence alignment
2.2 重组pET32a- F3H表达结果
经双酶切后将5种F3H分别与pET32a载体进行重组结合,分别诱导培养含有PcF3H、ZmF3H、CF3H、GhF3H和SmF3H的菌株,经SDS- PAGE鉴定在大肠杆菌中的表达结果见图6。图6的1~7通道分别是Marker、pET32a空载体、表达CF3H菌株、表达GhF3H菌株、表达ZmF3H菌株、SmF3H菌株和表达PcF3H菌株破碎后的上清液。
如图可知与空载相比,5个外源导入的f3h基因在70 kDa处都有明显蛋白质特征条带,且新条带与5种目标蛋白在大肠杆菌体内总分子质量基本一致。说明CF3H、GhF3H、ZmF3H、SmF3H和PcF3H在大肠杆菌中成功实现了表达,属于胞内可溶蛋白。其中CF3H、GhF3H和PcF3H有较亮的条带出现,蛋白表达量高,但有部分水解情况产生;ZmF3H和SmF3H相比来说有较细条带,蛋白表达量较少。

泳道中1~7分别是Marker,pET32a空载体、CF3H、GhF3H、ZmF3H、SmF3H和PcF3H的破胞上清液。图6 SDS- PAGE分析大肠杆菌破碎后上清液的蛋白Fig.6 SDS- PAGE analysis of extracted proteins from the homogenate after the disruption of E.coli BL21
2.3 重组pET32a- F3H产物检测分析
对重组菌株进行发酵培养后上样进行HPLC检测分析(图7)。经过分析后发现除SmF3H外,其余4种重组菌均在图谱中出现了两个与柚皮素、香橙素标准品出峰位置一致的峰且分离效果较好。为进一步验证产物,将发酵液进行一级质谱(100~1 000m/z)扫描,MS结果显示在负离子模式下化合物峰在m/z=287.058 7时有离子峰,与香橙素标准品相同,证明大肠杆菌能够成功表达蛋白并将柚皮素转化为香橙素。可得出结论,大肠杆菌能够体内表达F3H蛋白并能以柚皮素为底物合成香橙素。空载E.coliBL21和5种异源表达的菌株产香橙素情况见图8,其中ZmF3H香橙素合成量最高为20.12 mg/L,而PcF3H、GhF3H和CF3H的合成量分别为17.48、19.34、15.45 mg/L。
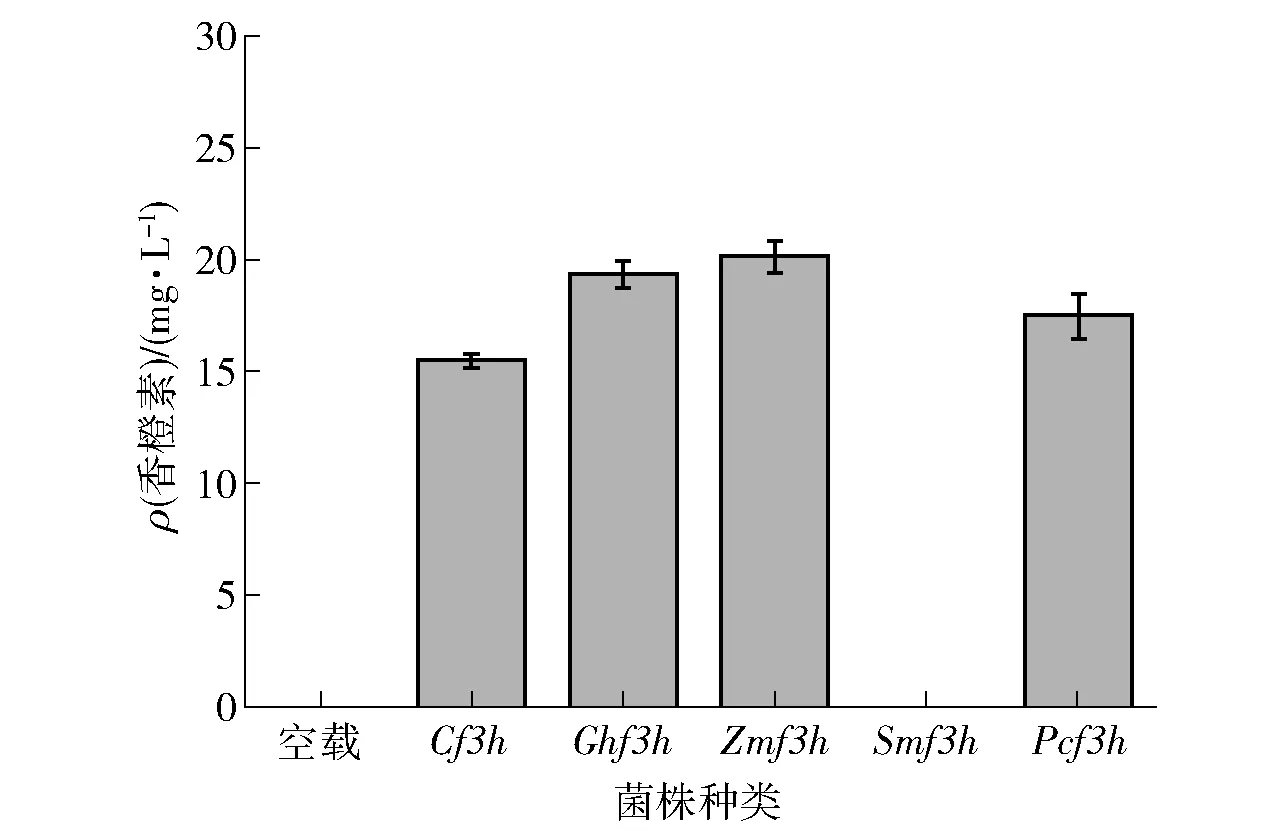
图8 不同菌株催化合成香橙素产量Fig.8 Yield of aromadendrin catalyzed by different bacterial strains
由图6和图7对比可知,ZmF3H蛋白表达量较小但催化合成香橙素产率较高,说明其蛋白活性较高。推测SmF3H组样品未能检测到目标峰可能是来源于水母雪莲的F3H在结构域亚组与其余F3H不同,因此虽然SDS- PAGE显示成功出现蛋白表达,但在酶促反应中未能成功与黄酮化合物底物结合从而转化为香橙素,后续可针对此方面进一步进行探讨。

图7 不同重组菌株产酶催化合成香橙素的HPLCFig.7 HPLC for synthesis of aromadendrin by enzyme from different recombinant strains
3 结 论
香橙素在化合物植物体中的代谢通路已经明晰,本研究选取5种来自不同物种的F3H进行研究,对他们各自的理化性质,空间结构以及同源性进行了分析并构建了异源表达体系。分析认为:不同来源的黄烷酮-3-羟化酶具有相近的开放阅读框及氨基酸长度,分子质量在38.89~41.45 kDa。蛋白偏酸性,适合在中酸性环境下的反应;预测所有的黄烷酮-3-羟化酶都是亲水性蛋白且蛋白的溶解可能性差异较大,但后续实验发现所选的5种F3H蛋白均属于可溶性蛋白;具有2OG- Fe- Oxy,PcbC及PLN02515结构域的黄烷酮-3-羟化酶能作用于黄酮类化合物催化羟基化且在酶催化反应过程中需要铁离子,氧戊二酸及氧气等辅因子的参与;黄烷酮-3-羟化酶的蛋白二级结构中α螺旋和无规则卷曲占得比例最多,占整体结构的70%以上;5个不同物种的黄烷酮-3-羟化酶氨基酸序列相似度为72.07%,有一定的同源性。
对选取的5种不同物种来源的F3H蛋白进行原核表达,经过大肠杆菌表达后进行SDS- PAGE发现,与空载组相比PcF3H、ZmF3H、CF3H、GhF3H和SmF3H均出现了新蛋白条带,说明选择的外源F3H在大肠杆菌中成功实现蛋白表达;进行发酵培养后,除SmF3H外,4种其他来源的F3H均在液相色谱及质谱中确定了有新产物香橙素的生成。推测不同物种的黄烷酮-3-羟化酶有相似的结合位点,但由于结合的位点不同,因此在反应过程中催化效果不一,导致底物的偏好性及合成量的不同,具体酶学性质及催化产香橙素的应用后期还需进一步探讨研究。
