探针扩增阻滞突变法与数字PCR法检测甲状腺乳头状癌BRAF基因突变
2021-04-01荀延萍姜燕平傅佳仪张仕蓉
荀延萍,姜燕平,傅佳仪,张仕蓉
甲状腺乳头状癌(papillary thyroid carcinoma, PTC)是甲状腺癌中最常见的类型,约占甲状腺癌的90%[1]。虽然目前绝大多数PTC预后较好,但仍有30%的PTC患者术后出现反复复发及远处转移[2]。Kimura等[3]研究发现70%的PTC可能存在分子改变,包括编码受体酪氨酸激酶RET、神经营养受体酪氨酸激酶-1(NTRK1)基因,以及丝裂原活化蛋白激酶(MAPK)通路的两个细胞内效应基因RAS和BRAF。BRAF作为一种丝氨酸/苏氨酸激酶,通过丝裂原活化蛋白激酶信号通路,可以调控细胞的增殖、分化以及凋亡[4],在PTC中BRAF突变率最高,其中45%为V600E,其次为K601E和V599Ins[5-7]。BRAF V600E突变是PTC中最常见的一种遗传改变,可能通过侵袭性行为影响肿瘤的发展,因此BRAF突变已成为一种潜在的PTC预后分子标记[8],是目前PTC中分析和检测的热点。本实验应用探针扩增阻滞突变(amplification refractory mutation system, ARMS)法和数字PCR(droplet digital PCR,ddPCR)法检测BRAF V600E突变,分析比较哪种方法更适用于PTC组织中BRAF V600E突变检测。
1 材料与方法
1.1 标本来源收集2018年8月~2019年8月浙江省杭州市第一人民医院存档的PTC手术标本371例。患者中位年龄49岁,男性98例,女性273例。所有标本均经10%中性福尔马林固定、石蜡包埋、组织切片后病理医师复阅切片明确诊断,并评估肿瘤细胞含量后进行检测。本组所有患者均知情同意。
1.2 DNA提取使用QIAamp DNA FFPE Tissue Kit试剂盒(Qiagen公司生产,货号56404)提取石蜡包埋组织样本基因组DNA,具体操作步骤严格按试剂盒说明书进行。并用微量分光光度计测定DNA浓度及纯度,以OD260/OD280处于1.8~2.0之间,浓度均﹥10 ng/μL为合格。提取后的DNA样品在-20 ℃条件下保存待用。
1.3 ARMS法检测基因突变使用人BRAF基因突变检测试剂盒(荧光PCR法)(北京雅康博生物公司,TB004)检测石蜡包埋组织样本中BRAF基因V600E点突变,具体操作严格按照试剂盒说明书进行。采用引物序列:正链5′-CCTA AACTCTTCATAATGCTTGCT-3′;反链5′-AGTAACTCAGCAG CATCTCAGG-3′。利用ABI 7500实时荧光定量PCR仪(美国ABI公司)确定Ct值。PCR反应条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 60 s,合计40个循环,结束后采集荧光。样品检测结果分为阳性和阴性,其中无BRAF突变(突变位点检测FAM通道)曲线或BRAF突变(突变位点检测FAM通道)的Ct值>38判定为阴性;反之,有扩增且Ct值≤35判定为阳性。
1.4 ddPCR法检测基因突变使用人BRAF基因突变检测试剂盒(数字PCR法)(上海源奇生物公司,CB340002)检测,按照说明书操作。采用引物序列:正链5′-CTACT GTTTTCCTTTACTTACTACACCTCAGA-3′;反链5′-AGCCTC AATTCTTACCATCCA-3′。利用QX200 Droplet Digital PCR系统(美国BioRad公司)测定,PCR扩增条件:95 ℃ 10 min;94 ℃ 15 s,58 ℃ 60 s,合计40个循环;98 ℃ 10 min;4 ℃ 5 min。样品检测结果分为阳性和阴性,其中“ch1+”区的点<3个且落在“ch2+”区的点<5个被判定为阴性;反之,突变比例≥0.1%且落在“ch1+ch2-”区的点≥3个判定为阳性。
1.5 统计学分析采用SPSS 18.0软件进行统计学分析,应用χ2检验评价BRAF基因突变与PTC临床病理特征的关系。
2 结果
2.1 ARMS法和ddPCR法检测BRAF基因突变371例PTC标本中,ARMS法检测BRAF基因突变阳性275例,阴性96例,突变率为74.1%(图1);ddPCR法检测BRAF基因突变阳性284例,阴性87例,突变率为76.5%(图2)。ddPCR法检测BRAF基因突变率较ARMS略高,但两组差异无统计学意义(P>0.05)。
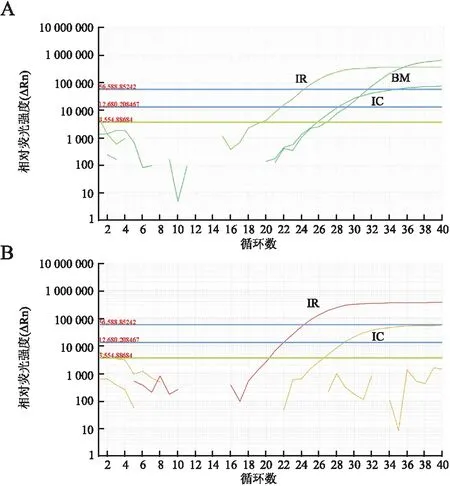
图1 ARMS法检测BRAF基因突变:A.阳性;B.阴性
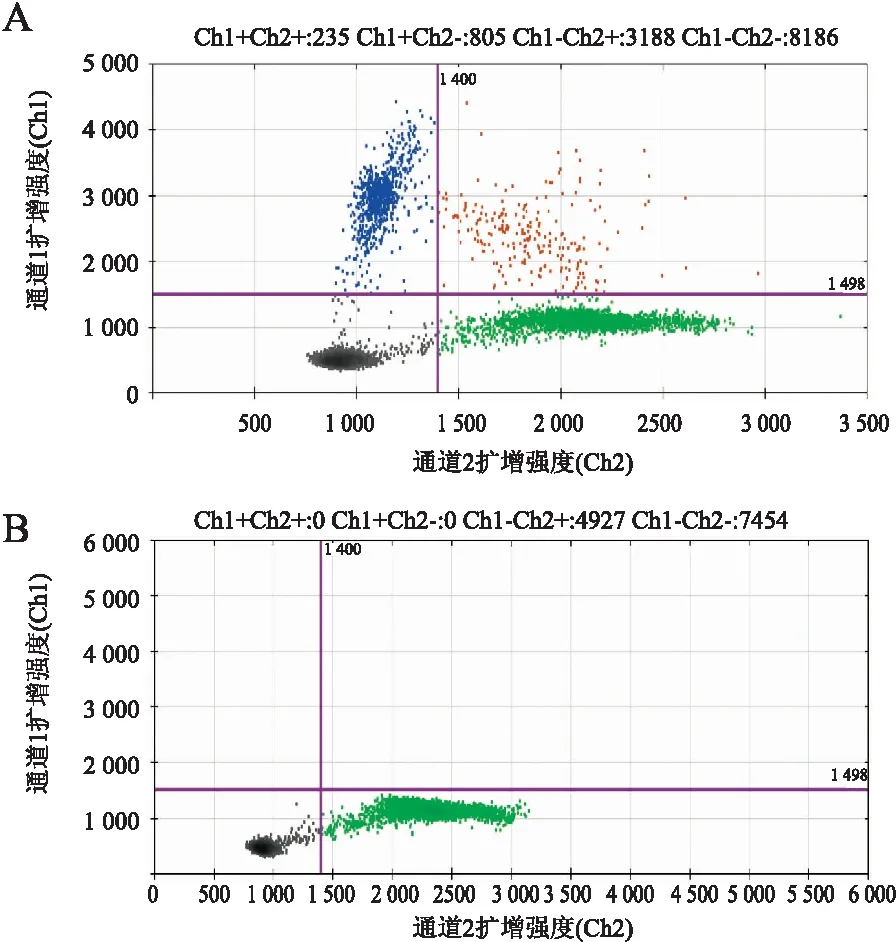
图2 ddPCR法检测BRAF基因突变:A.阳性;B.阴性
2.2 BRAF基因突变与PTC临床病理特征的关系ARMS法检测男性患者的BRAF基因突变率为71.4%(70/98),女性患者的BRAF基因突变率为75.1%(205/273),差异无统计学意义(P>0.05);年龄≥49岁组患者的BRAF基因突变率为73.5%(139/189),<49岁组患者BRAF基因突变率为74.7%(136/182),差异无统计学意义(P>0.05)。ddPCR法检测男性患者的BRAF基因突变率为72.4%(71/98),女性患者的BRAF基因突变率为78.0%(213/273),差异无统计学意义(P>0.05);年龄≥49岁组患者的BRAF基因突变率为77.2%(146/189),<49岁组患者BRAF基因突变率为75.8%(138/182),差异无统计学意义(P>0.05,表1)。
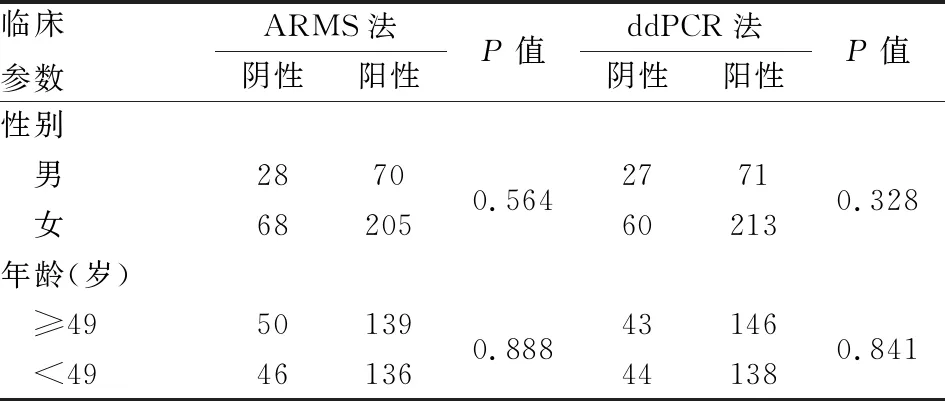
表1 甲状腺乳头状癌中BRAF基因突变与临床病理特征的关系
2.3 ARMS及ddPCR法检测BRAF基因突变的一致性BRAF基因突变的一致性本组以ARMS法为标准,ARMS法和ddPCR法检测结果阳性符合率为96.7%(266/275),阴性符合率为79.2%(76/96),总符合率为92.5%(342/371)(表2)。对于不一致的29例样本,采用测序的方法进行重测,结果显示其中23例为阳性样本(ARMS法准确6例,ddPCR法准确17例),6例为阴性样本(ddPCR法准确6例)。因此经过校验后ddPCR法检测阳性准确率为97.9%(283/289),ARMS法检测阳性准确率为94.1%(272/289)。

表2 ARMS法及ddPCR法检测BRAF基因突变的一致性分析
3 讨论
BRAF V600E基因突变是促使PTC形成及进展的重要分子改变,与PTC的高侵袭性、复发、预后不良均密切相关。因此准确、快速地检测甲状腺结节中BRAF V600E基因突变情况,对于临床医师确定PTC复发危险程度的分级、采取合适的手术方式及制定合理的随访计划均具有重要的指导价值[1]。有研究报道,应用免疫组化和实时荧光定量PCR法来评价BRAF V600E基因突变蛋白表达的灵敏性[9],以及实时荧光定量PCR法与Sanger测序法也被用来比较检测BRAF V600E基因突变结果的灵敏性[10]。本实验采用ARMS和ddPCR两种方法检测371例PTC患者中BRAF V600E基因突变,结果发现ARMS法检测BRAF基因突变率为74.1%(275/371),ddPCR法检测BRAF基因突变率为76.5%(284/371),且两种检测方法均显示PTC患者BRAF基因突变与患者性别、年龄无关;两种检测方法检测BRAF V600E突变状态的总符合率为92.5%,ddPCR法检测突变阳性准确率为97.9%,ARMS法检测阳性准确率为94.1%。总之,本实验结果显示,ARMS和ddPCR两种方法检测到的阳性突变具有相似的准确性。
一般来说,肿瘤组织再活检是病理诊断的金标准,其中检测组织中BRAF V600E基因状态是一种可行的方法,需要一种高灵敏度、简便的检测方法,如ARMS、ddPCR等。有文献报道基于荧光定量PCR的ARMS技术通过特异性探针识别EGFR突变序列,该方法具有很高的选择性和灵敏度,可以检测到组织样本中DNA突变量低至1%的情况[11]。与ARMS法相比,ddPCR法是一种新技术,可直接检测目标DNA的绝对拷贝数和相对拷贝数,并且通过对每个样品中上万滴微流体的快速分析,使得ddPCR在临床检测应用中具有可行性[12]。另外,ARMS为相对定量分析,ddPCR为绝对定量分析。在其他研究中表明,ddPCR的敏感性为0.01%[13],ARMS的敏感性为0.1%[14]。基于上述研究,本实验结果也发现,与ARMS法相比,ddPCR法在检测PTC中BRAF V600E基因突变具有优势,具有较高的精密度、灵敏度和准确性。因此,进一步证实ddPCR法更适用于检测BRAF V600E基因突变,为PTC的诊断及判断预后提供依据,在BRAF V600E突变患者中具有良好的应用前景,并发挥越来越大的作用。
