lncRNA COLCA1/miR-423-5p/FAM172A分子轴对皮肤鳞状细胞癌A431细胞的增殖和迁移的影响
2021-04-01皮先明余新健白书仙毛慧芳
金 晶,皮先明,余新健,白书仙,毛慧芳,张 波
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma, CSCC)起源于表皮胶质形成细胞,是我国常见的皮肤恶性肿瘤之一,发病率呈逐年增长的趋势[1]。目前,CSCC的发病机制尚不清楚,可能与慢性炎症、化学致癌物、微生物感染等有关[2]。明确CSCC的发生、发展机制,寻找关键调控作用分子,对CSCC的诊断和治疗具有重要意义。长链非编码RNA(long-chain non-coding RNA, lncRNA)是一种转录本长度大于200个核苷酸的内源性RNA,自身不具有编码蛋白质的功能[3]。lncRNA可通过多种方式调控特定基因的表达,在人体多种疾病包括肿瘤的进程中发挥重要作用[4-5]。COLCA1是新近发现的lncRNA,研究显示COLCA1在乳腺癌组织中低表达,COLCA1表达越低,乳腺癌患者的生存期越短[6]。COLCA1在CSCC组织中的表达及对肿瘤发生、发展的影响,目前尚未见报道。本文检测COLCA1在CSCC组织和细胞系中的表达,观察过表达COLCA1对CSCC细胞增殖和迁移的影响,应用生物信息学法探讨其发挥作用的潜在分子机制。
1 材料与方法
1.1 临床资料收集2018年2月~2019年12月我院行手术切除的CSCC组织37例,标本在液氮中保存并经病理检查确诊。男性20例,女性17例,平均年龄(52.93±9.57)岁;原位鳞状细胞癌9例,高分化鳞状细胞癌12例,中分化鳞状细胞癌16例。选取同期行整形外科手术的正常人皮肤组织37例作为对照。本实验经我院伦理委员会同意,患者均签署知情同意书。
1.2 细胞与主要试剂CSCC细胞系(HSC-2、SCL-12、Colo-16、A431、SCL-1)和人角质形成细胞系(HaCaT),均购自中国科学院上海生命科学院细胞资源中心。COLCA1过表达质粒和空白质粒,均购自上海吉玛基因公司。RPMI 1640培养基、胎牛血清(FBS)、DMEM培养基,均购自美国Gibco公司。转染试剂Lipofectamine 3000购自美国Invitrogen公司。qRT-PCR和Trizol试剂,均购自北京天根生化公司。ECL试剂购自美国Thermo公司。噻唑蓝(methyl thiazol tetrazolium,MTT)和二甲基亚砜,均购自美国Sigma公司。一、二抗均购自英国Abcam公司。
1.3 细胞培养和转染HSC-2、Colo-16、A431细胞采用含10% FBS的RPMI 1640培养基培养,SCL-12、SCL-1、HaCaT采用含10% FBS的DMEM培养基培养,置于37 ℃、5%CO2的培养箱中。将处于对数生长期的A431细胞接种于6孔板中,当细胞密度达50%时,通过Lipofectamine 3000转染空白质粒(对照组)和COLCA1过表达质粒(实验组)至A431细胞,具体操作步骤严格按照转染试剂盒说明书进行。12 h后更换新鲜培养基继续培养。
1.4 RNA提取和qPCR检测通过Trizol试剂裂解并提取组织和细胞系总RNA,逆转录为cDNA。按照qRT-PCR试剂盒说明书配制反应体系,反应条件为95 ℃预变性10 min、62 ℃ 30 s、72 ℃ 30 s,合计40个循环。荧光值采用2-ΔΔCt方法计算。以GAPDH为内参检测COLCA1和FAM172A mRNA的表达,以U6为内参检测miR-423-5p的表达。COLCA1上游引物:5′-CAGCAGCAGGGACTCAGC-3′,下游引物:5′-AGCCGGATGCTTTGTGAA-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′;GAPDH上游引物:5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物:5′-GCCATCACGCCACAGTTTC-3′;miR-423-5p上游引物:5′-GGTCGCTCTCTGCCCCTCA-3′,下游引物:5′-CAGTGCGTGTCGTGGAGT-3′;FAM172A上游引物:5′-CGACTGGCGAACTGGAAG-3′,下游引物:5′-GAGCTCAAGGAAATAGACATCAATC-3′。
1.5 MTT检测A431细胞增殖A431细胞转染48 h后,胰酶消化并制备单细胞悬液,以4×103个/孔细胞密度接种于96孔板中,每组4个复孔,分别培养1、2、3、4、5天。每天进行MTT检测,每孔加入10 μL浓度为2.5 g/L的MTT试剂,培养箱中培养4 h,每孔加入200 μL二甲基亚砜,水平振荡器振荡20 min,酶标仪读取每孔在450 nm波长处光密度(OD)值,绘制A431细胞生长曲线。
1.6 细胞划痕实验检测A431细胞迁移A431细胞转染48 h后,胰酶消化并制备单细胞悬液,以8×105个/孔细胞密度接种于6孔板中,每组4个复孔。待A431细胞贴壁后,使用10 μL移液枪枪头在6孔板底部划痕,用PBS冲洗3次,加入无血清RPMI 1640培养基,在倒置显微镜下(100×)拍照并记录细胞划痕宽度W1。培养24 h后,在倒置显微镜下(100×)拍照并记录细胞划痕宽度W2,细胞迁移率代表细胞迁移能力,迁移率=(W1-W2)/W1×100%。
1.7 生物信息学法预测COLCA1潜在分子机制采用LncBase Predicted v.2在线数据库预测COLCA1可能互补结合的miRNA,采用miRNA Map在线数据库预测miRNA可能互补结合的mRNA。
1.8 Western blot实验检测FAM172A蛋白的表达A431细胞转染48 h后,胰酶消化收集细胞,提取细胞总蛋白,取等量蛋白进行SDS-PAGE电泳,将蛋白转移至硝酸纤维素膜,采用5%脱脂奶粉封闭液在室温封闭2 h,稀释一抗FAM172A(1 ∶1 000稀释)、Notch1(1 ∶2 000稀释)、Hes1(1 ∶1 000稀释)、Cyclin D1(1 ∶3 000)、C-myc(1 ∶3 000)及α-Tubulin(1 ∶1 000),一抗在4 ℃下孵育过夜。加入二抗稀释液,在室温下摇床孵育2 h,滴加ECL试剂曝光、显影。

2 结果
2.1 CSCC组织和细胞系中COLCA1的表达qRT-PCR检测结果显示,COLCA1在37例CSCC组织与37例正常皮肤组织中的表达量分别为5.71±0.78和1.01±0.20,COLCA1在CSCC组织中呈低表达(P<0.01,图1);COLCA1在CSCC细胞系(HSC-2、SCL-12、Colo-16、A431、SCL-1)和人角质形成细胞系(HaCaT)中的表达量分别为0.64±0.07、0.39±0.03、0.16±0.05、0.77±0.03、0.56±0.07和1.00±0.01,COLCA1在CSCC细胞系中呈低表达(P均<0.01),A431细胞中COLCA1的表达最低(P<0.01,图2)。
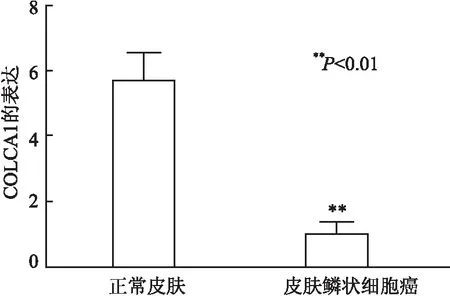
图1 正常皮肤和皮肤鳞状细胞癌组织中COLCA1的表达
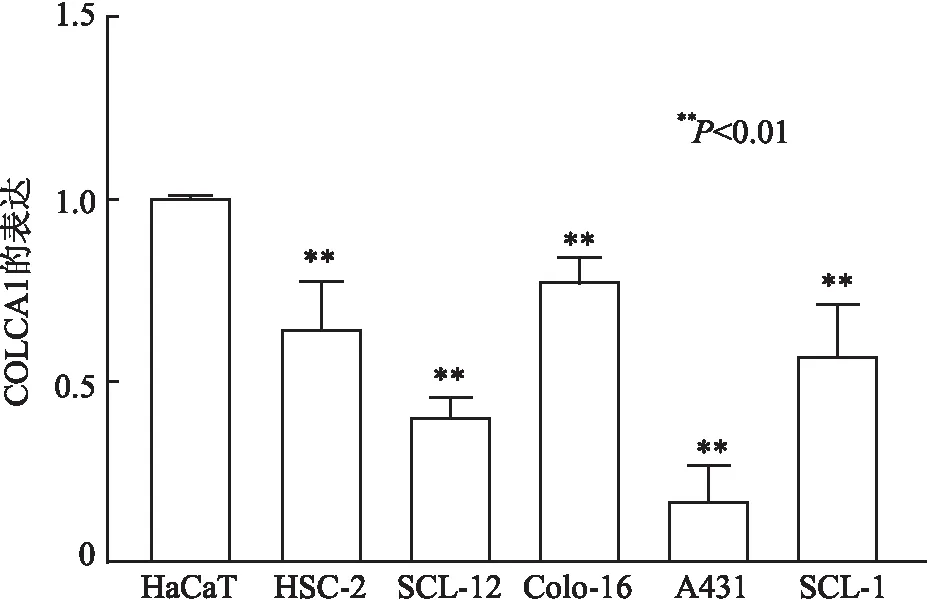
图2 皮肤鳞状细胞癌细胞系和人角质形成细胞中COLCA1的表达
2.2 转染COLCA1过表达质粒对A431细胞中COLCA1表达的影响转染COLCA1过表达质粒后,qRT-PCR检测对照组和实验组A431细胞中COLCA1表达量分别为1.00 ± 0.04和9.31 ± 0.99,结果显示,实验组中COLCA1表达高于对照组(P<0.01,图3)。
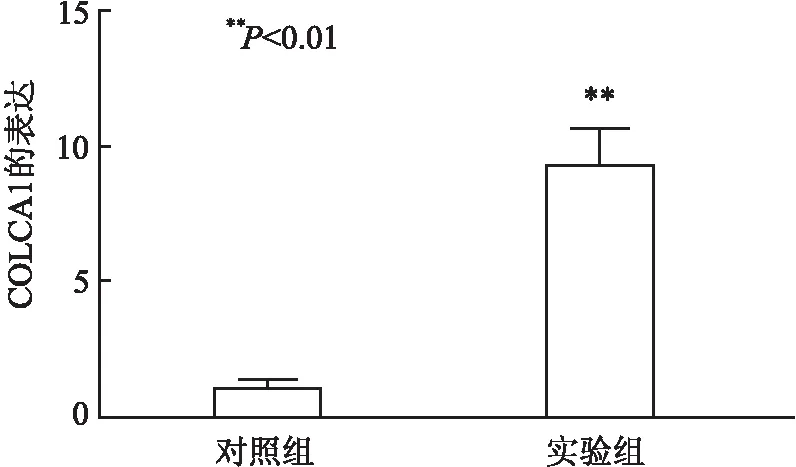
图3 COLCA1在对照组和实验组的A431细胞中的表达
2.3 过表达COLCA1对A431细胞增殖的影响MTT检测显示,在第2、3、4、5天实验组A431细胞的OD值与对照组相比,其表达下调(P<0.05、P<0.05、P<0.01、P<0.01);提示过表达COLCA1可抑制A431细胞的增殖(图4)。
2.4 过表达COLCA1对A431细胞迁移的影响细胞划痕实验显示,实验组和对照组中A431细胞迁移率分别为(27.69±2.15)%和(61.84±6.32)%,实验组中细胞迁移率低于对照组(P<0.01,图5);提示过表达COLCA1可抑制A431细胞的迁移。
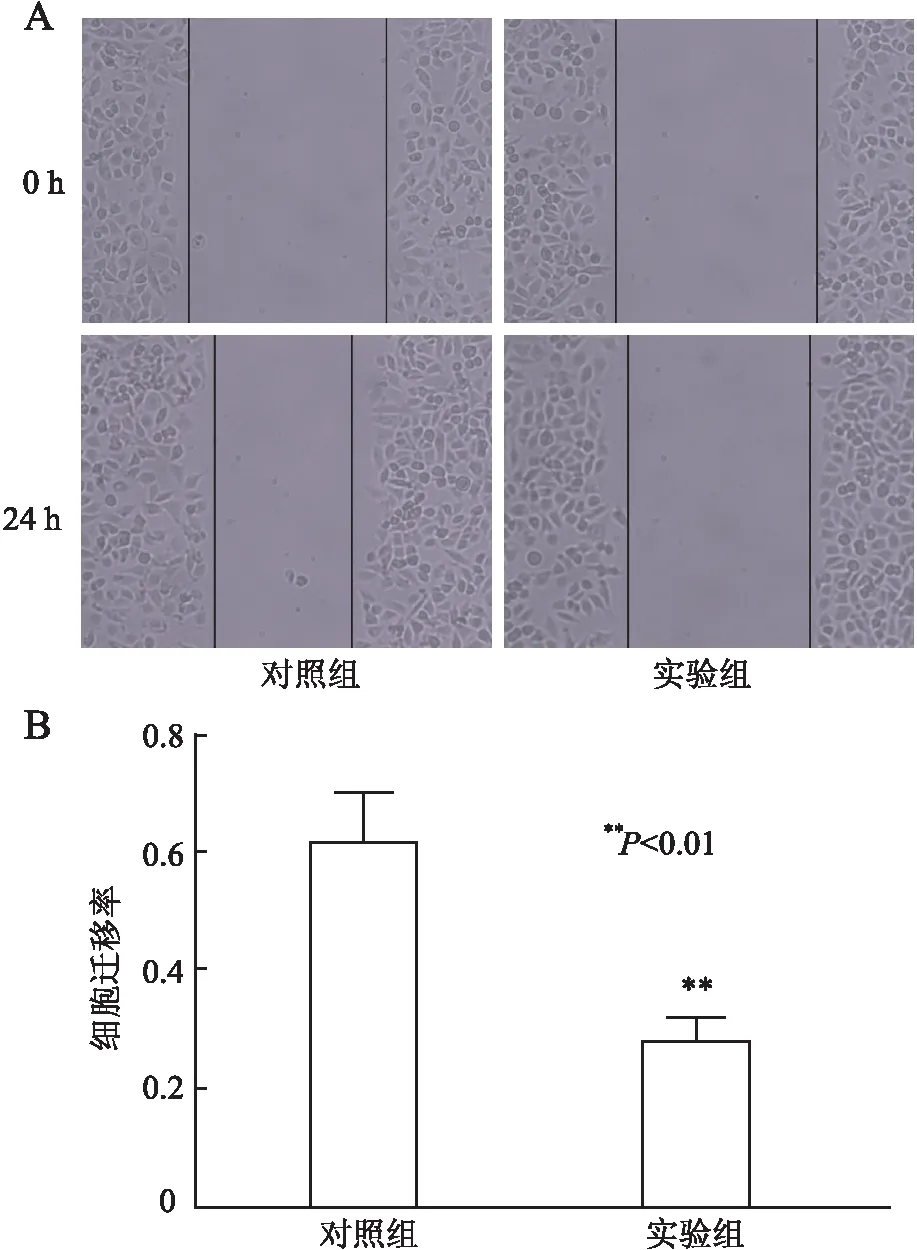
图5 A.过表达COLCA1对A431细胞迁移的影响;B.直方图统计分析
2.5 生物信息学法预测COLCA1潜在分子机制采用LncBase Predicted v.2在线数据库预测COLCA1可能与miR-423-5p互补结合,采用miRNA Map在线数据库预测miR-423-5p可能与FAM172A mRNA互补结合(图6)。
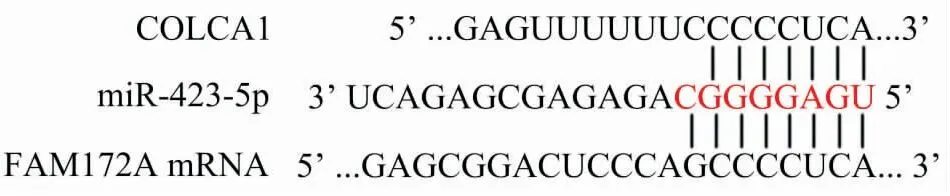
图6 生物信息学方法预测COLCA1潜在分子机制
2.6 过表达COLCA1对A431细胞中miR-423-5p和FAM172A mRNA表达的影响qRT-PCR检测显示,对照组和实验组的A431细胞中miR-423-5p表达量分别为1.00 ± 0.05和0.20±0.05,实验组中miR-423-5p表达低于对照组(P<0.01,图7)。对照组和实验组的A431细胞中FAM172A mRNA表达量分别为1.00±0.02和5.11±0.79,实验组中FAM172A mRNA表达高于对照组(P<0.01);提示过表达COLCA1可下调miR-423-5p mRNA的表达,上调FAM172A mRNA的表达。
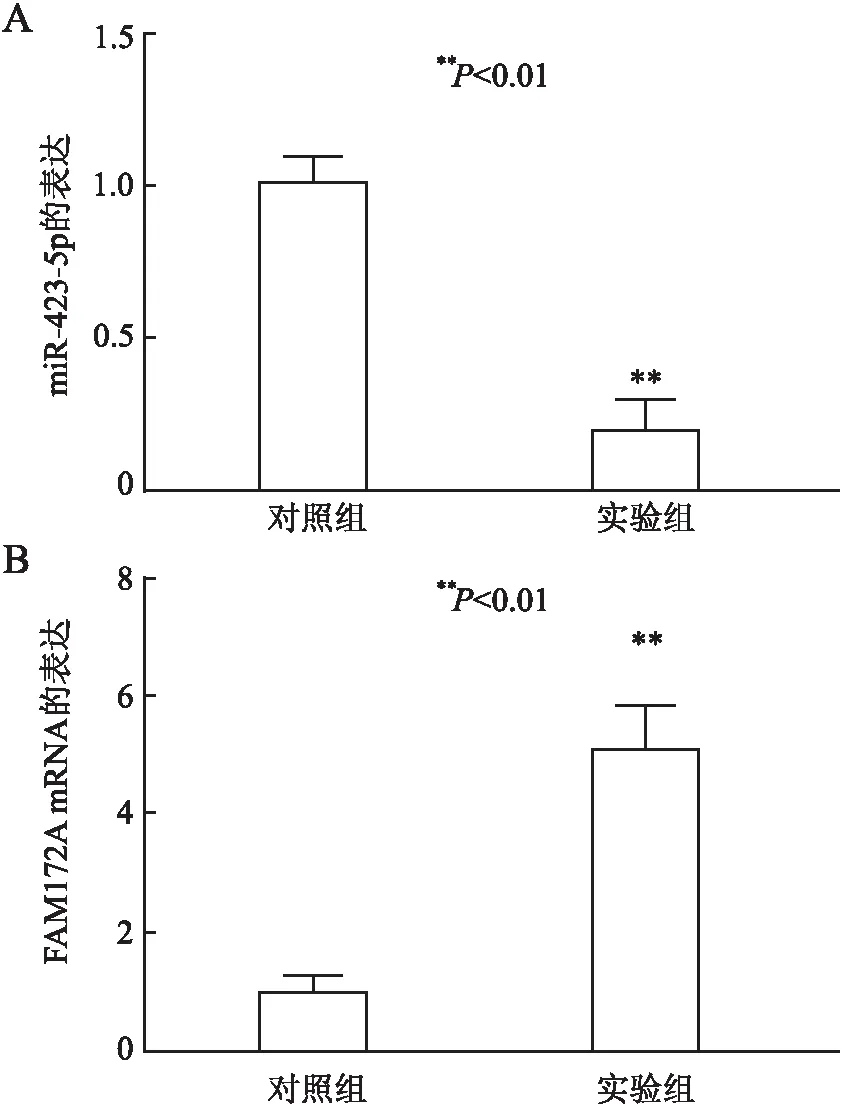
图7 miR-423-5p(A)和FAM172A mRNA(B)在对照组和实验组A431细胞中的表达
2.7 过表达COLCA1对FAM172A蛋白表达的影响Western blot检测显示,过表达COLCA1后,FAM172A蛋白表达上调,Notch信号通路蛋白如Notch1、Hes1、Cyclin D1及C-myc蛋白表达下调,Notch信号通路活化被抑制(图8)。
3 讨论
近年越来越多的研究证实lncRNA广泛参与细胞分化、发育、增殖、凋亡、转移、衰老等各种生理和病理过程[7-8]。lncRNA在绝大多数肿瘤中均异常表达,可作为抑癌基因或原癌基因调控肿瘤的发生、发展[9-11]。随着新一代测序技术的不断发展,发现越来越多的lncRNA与CSCC的恶性表型有关[12]。lncRNA LINC00520在CSCC组织中表达下调,LINC00520可通过干扰PI3K/Akt信号通路的活化,抑制CSCC的进展[13]。lncRNA PRECSIT在CSCC组织和细胞系中均呈低表达,PRECSIT可被p53蛋白负向调控,沉默PRECSIT可抑制CSCC细胞在体内和体外的生长和转移[14]。COLCA1是新发现的lncRNA,其在乳腺癌中异常低表达,与乳腺癌患者的预后相关,提示其在肿瘤发生、发展中发挥抑癌基因作用[6]。目前,COLCA1在CSCC中的生理功能和分子机制尚不清楚。
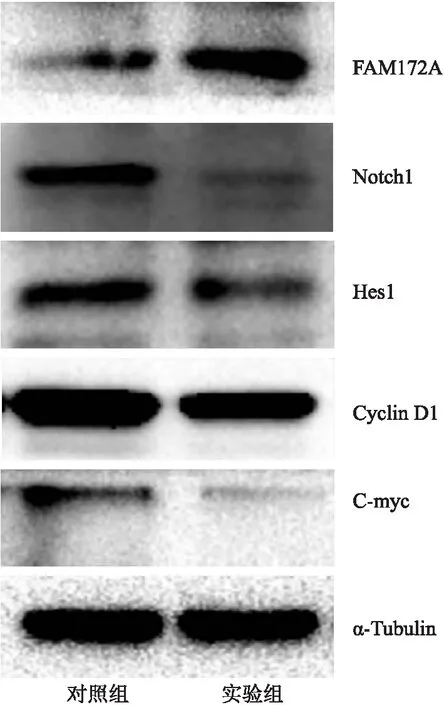
图8 过表达COLCA1对A431细胞FAM172A蛋白表达的影响
本组qRT-PCR检测显示,COLCA1在CSCC组织和细胞系中表达下调,提示COLCA1可能参与调控CSCC的发生、发展。MTT法和细胞划痕实验显示,过表达COLCA1可抑制A431细胞的增殖和迁移。lncRNA可作为竞争性内源性RNA与特定miRNA互补结合,抑制miRNA对其靶基因的干扰作用,进而促进miRNA靶基因的表达[15]。生物信息法显示,COLCA1可能与miR-423-5p互补结合,miR-423-5p可能与FAM172A mRNA互补结合。miR-423-5p在胶质瘤、胃癌、前列腺癌等肿瘤中表达上调,miR-423-5p可促进肿瘤细胞的增殖、迁移、侵袭、血管生长,与肿瘤的淋巴结转移相关,可作为患者不良预后的独立指标[16-17]。qRT-PCR检测显示,过表达COLCA1可抑制miR-423-5p的表达,COLCA1可能作为竞争性内源性RNA与miR-423-5p互补结合。FAM172A基因位于染色体5q15,是一类抑癌基因[18]。FAM172A在胰腺癌、结直肠癌等肿瘤中表达下调,FAM172A表达水平与肿瘤大小、淋巴结转移、临床分期、预后呈负相关[19]。过表达FAM172A蛋白可抑制肿瘤细胞的增殖、迁移、侵袭,沉默FAM172A蛋白表达可促进肿瘤的恶性生物学行为[18]。本组结果显示,COLCA1下调miR-423-5p表达后,FAM172A基因表达上调,提示COLCA1可能通过互补结合miR-423-5p,间接促进FAM172A基因的表达。Notch信号通路的异常活化可加速肿瘤细胞的生长和转移,在肿瘤的发生、发展中发挥重要作用[20]。Western blot检测显示,A431细胞中FAM172A蛋白表达升高后,Notch信号转导通路蛋白如Notch1、Hes1、Cyclin D1和C-myc表达下调,提示Notch1信号通路活化被阻滞。
综上所述,本实验结果发现COLCA1在CSCC组织和细胞系中表达下调,过表达COLCA1可抑制CSCC细胞的增殖和迁移,其潜在分子机制可能为COLCA1作为竞争性内源性RNA与miR-423-5p竞争性调控FAM172A基因的表达,抑制Notch信号通路的活化。本组实验为COLCA1在CSCC发生、发展中的功能提供理论基础,有望为CSCC的靶向治疗提供新分子靶标。
