细胞自噬参与中性粒细胞胞外诱捕网形成的机制研究进展*
2021-04-01杨冬梅综述邢艳审校
杨冬梅 综述 邢艳 审校
(川北医学院医学检验系·转化医学研究中心,四川 南充 637000)
中性粒细胞胞外诱捕网(Neutrophil extracellular traps,NETs)是由中性粒细胞解体后释放的DNA、组蛋白及胞浆蛋白形成的网状结构,是固有免疫系统抵抗感染的重要屏障[1]。NETs形成包括三个关键因素:活性氧(Reactive oxygen species,ROS)产生、组蛋白瓜氨酸化及自噬激活。现有研究已经基本阐明ROS和组蛋白参与NETs形成的机制,而自噬依赖的NETs形成机制近期才受到关注。细胞自噬是一种程序化的胞内降解过程,主要依赖溶酶体降解自身胞质成分而实现细胞自身代谢和细胞器更新,以维持细胞内环境稳态。深入研究发现细胞自噬和中性粒细胞的多种功能有着密切关联,包括中性粒细胞脱颗粒、ROS产生和中性粒细胞胞外诱捕网形成等[2]。本文对中性粒细胞自噬参与NETs形成机制进行综述,以期为揭示相关疾病的发病机制以及探索药物作用靶点提供参考依据。
1 中性粒细胞胞外诱捕网
中性粒细胞是人体最丰富的固有免疫细胞,被称为宿主防御的“前锋”,在疾病发生、进展及预后过程中起关键作用。2004年,Brinkmann等[3]首先发现用IL-8、佛波肉豆蔻酸酯乙酸酯(phorbol myristate acetate,PMA)或脂多糖(lipopolysaccharide,LPS)刺激中性粒细胞后,会释放一种网状结构,将其称为NETs。释放NETs过程被称为“NETosis”,包括三种类型:①自杀式NETosis,该过程持续2~4 h,主要依赖Raf/MERK/ERK 信号转导通路激活、肽基精氨酸酶脱氨酶4(PAD4)介导的组蛋白瓜氨酸化以及大量ROS产生[4-5],导致核染色体解聚,其中NADPH氧化产生的ROS是触发NETs形成的必要中间体。②依赖细胞核DNA释放式NETosis,又称“真实NETosis”,该过程需5~60 min,不依赖于ROS产生和 Raf/MERK/ERK 信号通路激活,而受Toll样受体、补体C3和血小板等影响[6],中性粒细胞通过囊泡形式,将解旋的染色体和组蛋白释放到胞外组装成NETs[7]。③依赖线粒体DNA释放式NETosis,中性粒细胞在补体C5a、LPS等刺激下,快速释放线粒体DNA参与形成NETs,该过程主要依赖线粒体ROS产生[8-9]。研究[10-13]发现缺氧、过敏、IL-1等因素可通过调控自噬/REDD1、RIPK3/MLKL及PAD4等信号途径,使得中性粒细胞核膜和大量颗粒膜破裂,释放中性粒细胞弹性蛋白酶、髓过氧化物酶;同时烟酰胺腺嘌呤(NADPH)氧化产生大量ROS,PAD4介导组蛋白瓜氨酸化等,进一步诱导形成NETs[14]。
NETs具有捕获、杀死和清除各种微生物,包括细菌、真菌、病毒和寄生虫的作用。然而,当体内中性粒细胞释放NETs过多,如果不能及时被清除,将作为自身抗原参与破坏机体免疫耐受而诱发自身免疫性疾病,如类风湿性关节炎和ANCA相关性血管炎等[15-16]。此外,NETs还能介导组织因子驱动血栓形成,导致急性心肌梗死[17]等。
2 自噬
自噬,又称“自食”,是细胞在能量供应不足时通过消化自身代谢废物来回收营养物的生存机制。自噬始于半圆形膜双层结构逐渐内陷,包裹需要降解的代谢废物,逐渐形成封闭的自噬小体,再与溶酶体融合形成自溶体,将消化的内容物释放到细胞质中用于生物合成,又称“自噬流”。自噬体是由一些自噬相关基因(ATG)表达的蛋白组成的复合体,包括Atg5、Atg12、Atg6(beclin-1)、Atg8和Atg12等,其形成过程为Atg5与Atg12结合形成复合物后,募集游离的LC3(ATG8)与之形成共轭复合物,靶向定位在空泡膜上形成自噬小体,再与Atg6-Atg14L-VPS复合物结合形成自噬前体复合物(UKL)[18-20]。ULK主要受哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)负调控,其上游又包括AMPK、PI3K/Akt和MAPK/ERK等多条通路。多种因素通过影响这些信号通路实现对自噬的调控,如生长因子、胰岛素等通过PI3K-Akt信号轴激活mTOR,抑制自噬;应激、营养不足条件下经AMPK抑制mTOR,上调自噬,这在很多代谢性疾病和肿瘤相关研究中得到证实[21-23]。自噬信号通路调控机制见图1。
自噬具有“双向”作用,可发挥保护性作用或损害性作用。自噬平衡对机体抵抗病原体入侵、调节抗原递呈参与适应性免疫反应至关重要,当自噬失衡,入侵的病原体和损伤的细胞器不能被完全清除,可能诱发自身免疫性疾病。因而体内恰当水平的自噬是机体维持正常生理功能的前提。有研究[24]指出中性粒细胞自噬在调控NETs形成中发挥重要作用,自噬激活加速NETs形成,早期或中晚期自噬抑制剂可抑制NETs释放,这充分证明自噬与NETs形成之间存在必然联系。
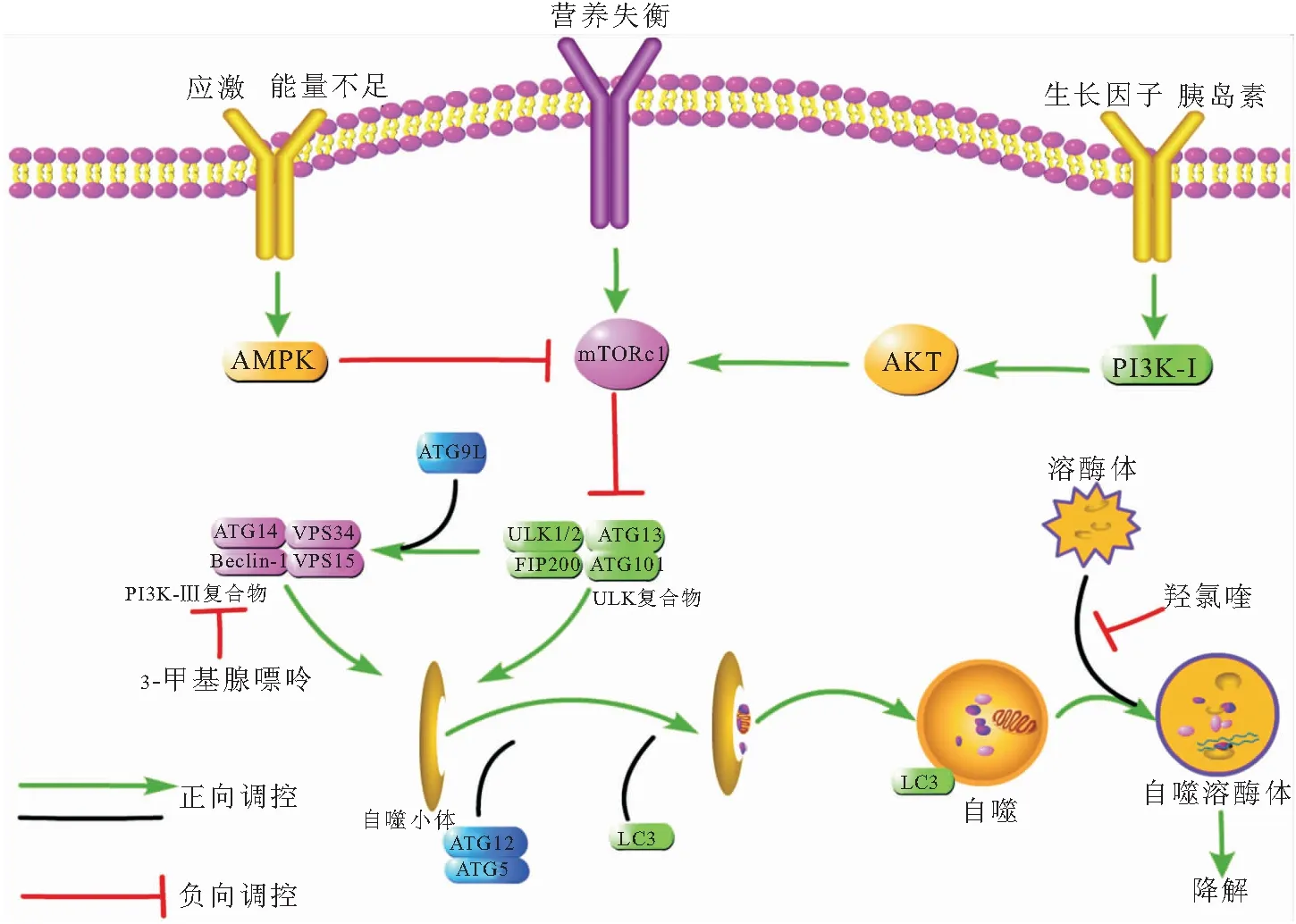
图1 自噬信号通路图
3 自噬与NETs
mTOR是自噬调节的重要节点,自噬被活化或是抑制,取决于mTOR上游的作用因子,抑制mTOR信号轴,促进中性粒细胞自噬的同时加速了NETs形成,说明自噬和NETs形成具有协同关系。自噬参与NETs形成受多种机制调控。
3.1 细菌衍生肽作用机制 中性粒细胞可以响应内外环境中各种刺激,包括炎症因子、细胞因子和微生物组分,常见如细菌衍生肽(N-Formylmethionyl-leucyl-phenylalanine, fMLP)、LPS等[25-26]。在中性粒细胞中,fMLP通过与特异性G蛋白偶联受体(主要是甲酰肽受体,FPR)结合,调控下游mTOR信号分子,介导自噬参与NETs形成。Itakura等[24]发现当利用特异性自噬诱导剂雷帕霉素处理中性粒细胞,自噬、NETs水平均明显升高;在雷帕霉素和fMLP共处理下,中性粒细胞自噬水平降低,同时NETs形成速率明显减慢,表明fMLP可抑制雷帕霉素作用下的自噬激活及NETs形成,fMLP-FPR-mTOR信号轴在介导自噬参与NETs形成中发挥重要作用。此外,fMLP-mTOR信号轴还能通过影响组蛋白瓜氨酸化影响NETs形成,该过程也需要自噬参与。当中性粒细胞受到各种炎症刺激后,核膜破裂,染色体裂解成组蛋白及DNA,释放到胞浆中,经PAD4介导的瓜氨酸化的组蛋白是NETs的关键结构蛋白[27]。Itakura等[24]也发现雷帕霉素诱导自噬激活的同时组蛋白H3(H3Cit)表达上调,而fMLP能抑制雷帕霉素诱导下的自噬水平,同时降低组蛋白H3(H3Cit)表达,导致NETs形成速率减慢,表明自噬可通过影响组蛋白瓜氨酸化参与NETs形成,该过程受fMLP- mTOR信号轴负调控。微管、肌球蛋白、肌动蛋白是细胞骨架的重要组成部分,不仅参与形成NETs的结构骨架,也有利于自噬小体形成及溶酶体融合[28-29]。研究[30]发现激活mTOR能通过介导肌动蛋白细胞骨架动力学抑制黑素瘤细胞自噬水平,同时抑制NETs形成。由此可见,mTOR信号分子在自噬依赖的NETs中发挥重要作用。
3.2 PI3K分子作用机制 磷脂酰肌醇3激酶(PI3K)是重要的信号分子,其中参与调控自噬主要有Ⅰ类PI3K(PI3K-1)和Ⅲ类 PI3K(PI3K-3)。体内胰岛素可激活磷脂酰肌醇3激酶1(PI3K-1),使蛋白激酶(AKT)磷酸化,并与之形成PI3K-1-Akt复合物,该复合物可以进一步促进肿瘤抑制因子TSC2磷酸化,TSC2磷酸化是激活mTOR的先决条件之一[31],mTOR通过抑制ULK从而阻碍自噬启动[32]。PI3K-3参与亮氨酸激活mTOR信号通路,当体内亮氨酸浓度升高,激活mTOR,抑制自噬发生[33]。上文中我们已经总结了mTOR调控自噬参与NETs形成的关键作用,因而推测PI3K-1和PI3K-3可以通过mTOR信号分子调控自噬参与NETs形成。此外,在mTOR下游,哺乳动物中的PI3K-3(Vps34),与Vps15、Beclin -1结合形成复合体[34],该复合物主要结合Atg14,参与形成自噬泡。自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA),通过抑制VPS34能有效降低ANCA相关性血管炎患者中性粒细胞自噬水平和NETs,推测ANCA患者体内NETs形成过程依赖自噬,并受PI3K-3调控[35]。Ma等[36]也发现用急性早幼粒细胞白血病(APL)患者血浆刺激中性粒细胞后,NETs明显增加,而自噬抑制剂3-MA作用后可明显降低该效应,表明APL诱导的NETs形成依赖PI3K-3介导的自噬。然而,Germic等[37]的研究否认了这一结论,该研究发现3-MA仅能消除暴露于低浓度的PMA介导的NETs水平,而对雷帕霉素刺激下的NETs形成无抑制作用,推测3-MA抑制NETs形成是通过抑制ROS产生,该过程依赖PI3K-1活性[38],而不依赖自噬,3-MA不仅可以阻断PI3K-3抑制自噬,也能阻断PI3K-1活化、降低NADPH氧化酶活性使NETs形成减少。
3.3 自噬基因调控机制 自噬受多种基因调控,目前已经鉴定出约71种自噬基因[39],以ATG1、5、6、7、8、12最为重要。近期研究发现部分自噬基因也参与调控NETs形成。Xu等[40]通过动物研究发现成年鼠中TLR样受体2(Toll-like receptor 2)诱导的NETs形成减少依赖于低水平的ROS和自噬,其中ATG5基因缺陷是自噬参与NETs形成减少的主要原因,当敲低鼠中性粒细胞中的ATG5基因,自噬活性明显降低且NETs形成速率明显减慢;该研究还发现成年鼠中NETs形成减少而凋亡增加可能是自噬调控的结果。然而,另一研究[41]发现在急髓白血病M3细胞株(HL-60)中过表达ATG5,能明显促进ROS产生,但对自噬和NETs形成均无明显上调或抑制作用,提示ATG5依赖的NETs可能受细胞类型差异影响。Ma等[36]的研究也发现利用小干扰RNA(siRNA)敲低自噬基因ATG7,几乎完全消除了APL血清诱导下的自噬,并抑制了NETs 形成,表明APL血清诱导的NETs 形成可能也依赖自噬基因ATG7。ATG1(ULK1)调控NETs形成受mTOR 信号通路上游刺激影响在前文中已经阐明,其他特异性自噬基因是否参与NETs形成有待进一步考证。
3.4 PMA/REDD1作用机制 PMA,经典NETs诱导剂,诱导NETs形成机制主要依赖ROS产生。研究指出自噬也参与了PMA诱导的NETs形成。Remijsen等[42]发现利用PMA刺激中性粒细胞后,双分子层自噬囊泡和自噬标志性蛋白LC3均明显增多,同时伴随ROS产生增多;抑制自噬,ROS产生降低,NETs形成减少,而抑制ROS产生同样阻碍自噬体形成,表明ROS产成和自噬激活之间存在密切的相互依赖关系,ROS产生介导自噬,反过来,ROS产生也依赖于自噬。ROS产生和自噬激活是PMA诱导的NETs的必要因素,缺一不可,无论抑制自噬或者NADPH氧化,都阻碍了染色体裂解,抑制NETs形成。Wang等[43]研究也发现利用阿特拉津(Atrazine,ATR),一种选择性的除草剂,体外刺激鲤鱼中性粒细胞,能抑制ROS产生和自噬激活,明显降低PMA诱导的NETs形成水平,而该效应能被雷帕霉素逆转,再次印证PMA诱导的NETs形成可能依赖于自噬。DNA损失反应蛋白1(REDD1),同样在自噬依赖的NETs中发挥重要作用。研究[4]报道在家族性地中海热患者外周血PMNs中REDD1表达明显上调,促进NETs释放,该过程依赖自噬激活。Frangou等[44]研究发现缺氧诱导因子1ɑ(Hypoxia-inducible factor-1α,HIF-1α)和内皮素-1诱导SLE患者中性粒细胞REDD1表达上调,激活REDD1/自噬途径,使得NETs释放增加。同样,另一研究[45]也发现溃疡性结肠炎(UC)患者中NETs形成增多依赖自噬,并与中性粒细胞中REDD1表达增高有关,REDD1/自噬/NETs轴参与了UC患者体内IL-1β驱动的炎症反应。
3.5 其他调节机制 研究[46]发现C型凝集素(Mincle)缺陷的中性粒细胞中NETs形成减少,自噬体激活受损,而ROS产生不受影响,通过自噬诱导剂他莫昔芬外源性干预Mincle-的中性粒细胞,能逆转Mincle-中性粒细胞中NETs形成缺陷,推测Mincle介导的NETs形成依赖自噬而不是ROS形成。此外,Zhou等[47]报道贝氏芽孢杆菌能诱导AMPK磷酸化,促进自噬体形成,同时NETs形成增加,提示自噬依赖的NETs可能受AMPK调控。另一项研究[48]发现用邻苯二甲酸二酯(DEHP)体外干预鲤鱼中性粒细胞后,可检测到大量ROS产生,NETs形成明显增多,自噬自噬蛋白mTOR表达降低、Atg6、LC3表达升高,推测DEH诱导的NETs形成是ROS和自噬共同作用的结果。综合上述研究,充分证实了自噬在NETs形成中的重要作用。自噬参与NETs形成信号调控见图2。
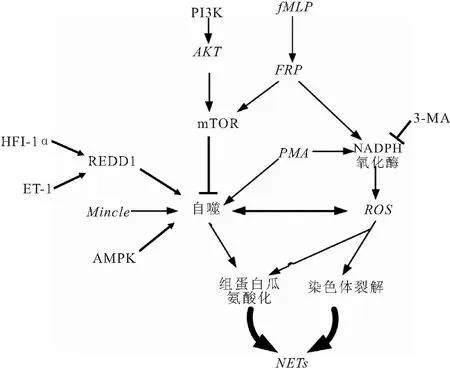
图2 自噬参与NETs形成信号调控图
4 小结
细胞自噬和NETs形成具有协同作用,NETs形成依赖于细胞自噬,其参与NETs形成的机制可能涉及到多种因素调控。鉴于两者在多种疾病中发挥重要作用,对其相互作用机制的深入研究或将为疾病诊断、临床治疗提供新思路。
