莜麦谷蛋白-1酶解物螯合亚铁离子影响因素的研究
2021-03-30郑亚军王贤侯雅馨李艳史攀琪吴晓洁朱玲芳
郑亚军,王贤,侯雅馨,李艳,史攀琪,吴晓洁,朱玲芳
(1.山西师范大学食品科学学院,山西 临汾 041000;2.北京工商大学轻工科学技术学院,北京 100048)
缺铁性贫血严重影响婴幼儿生长发育、青少年智力发育和孕妇胎儿健康。由于常规饮食中铁主要以三价铁形式存在,被摄入人体胃肠道后容易被植酸等其他食物成分影响,易形成难溶性盐类;同时食物中铁主要经离子吸收途径进入人体小肠刷状缘处的吸收细胞,耗能高、途径复杂,最终导致铁的消化吸收率较低[1]。肽-亚铁螯合物作为目前最理想的铁营养强化剂,蛋白质或多肽将亚铁离子螯合于肽链结构中,被摄入人体时,既可以避免胃肠道中其他食物成分的干扰,使铁保持在二价状态;同时,肽-亚铁离子螯合物经寡肽的吸收途径通过小肠吸收细胞而进入体内,具有快速、能耗低、简捷等优点[2]。随着人们生活水平的提高和绿色消费理念的深入,以食源性蛋白质制备肽-亚铁螯合物,从饮食上预防和治疗铁营养缺乏,具有广阔的市场前景。莜麦(naked oat)学名裸燕麦,是一种耐寒、耐旱和高产作物,在山西、河北北部地区、内蒙古等地区广泛种植。莜麦是山西省最具特色优势的杂粮作物之一[3]。莜麦蛋白质的含量较高(15%~18%),除了优良的营养功能外,还有降血脂、抑制血管紧张素酶、抗癌细胞等功能,开发潜力巨大[4~6]。组分蛋白一般指同一原料蛋白质中,因溶解性差异而分类的不同蛋白质,包括水溶性清蛋白、稀盐溶解的球蛋白、碱溶性谷蛋白和酸溶性谷蛋白等。由于氨基酸组成和溶解性存在较大差异,各组分蛋白表现出不同的功能特性和应用前景[4]。例如只溶解于稀酸溶液中的谷蛋白-1(酸溶性谷蛋白)和只溶解于稀碱溶液中的谷蛋白-2(碱溶性谷蛋白)的乳化性和起泡性就存在着较大差异,二者在食品工业中的应用范围也不同[7]。目前关于莜麦分离蛋白和贮藏蛋白的研究报道较多,但对莜麦组分蛋白的研究报道较少,对莜麦蛋白铁营养强化剂及相关产品的研究报道就更少。本试验以莜麦为原料,采用分步提取法提取各组分蛋白,以亚铁离子螯合率为评价指标,筛选出适宜制备螯合物的组分蛋白。然后采用复合酶法水解该莜麦组分蛋白,并分析水解度、温度、pH值等因素对螯合率的影响,以期为莜麦的进一步开发利用提供理论指导。
1 材料与方法
1.1 材料与试剂
莜麦:朔州市老农民食品公司。碱性蛋白酶(200 U/mg)、木瓜蛋白酶(800 U/mg)、风味蛋白酶(200 U/mg)、胃蛋白酶(100U/mg)、胰蛋白酶(2500U/mg)、维生素C:上海素培生物科技有限公司;考马斯亮蓝、盐酸羟胺、邻菲啰啉、乙酸钠:天津市天力化学试剂有限公司。
1.2 仪器与设备
紫外可见分光光度计(UV-1800PC):上海申光科学仪器公司;台式高速冷冻离心机(D-78532):德国Hettich公司厂;真空冷冻干燥器(Thermal-20):美国thermal公司;数显水浴振荡仪(HSA-D):苏州瑞天仪器厂。
1.3 方法
1.3.1 莜麦组分蛋白的制备
将莜麦粉100 g与400 mL石油醚混匀于锥形瓶中,20℃下振荡2 h后过滤,重复提取3次后在40℃下烘干,得到脱脂莜麦粉。各组分蛋白的提取采取连续提取法[8],根据各蛋白质溶解度的差异,清蛋白使用蒸馏水提取、球蛋白使用稀盐溶液提取,而谷蛋白-1和谷蛋白-2分别采用稀酸溶液和稀碱溶液提取。各组分蛋白的浓度测定采用Bradford法[9]。
1.3.1.1 莜麦清蛋白的提取
取40 g脱脂莜麦加入200 mL蒸馏水(dH2O),35℃下搅拌提取2 h,过滤,收集滤液,在滤渣中再加入等体积dH2O,重复提取3次,合并滤液,在12 000 g下离心15 min,收集上清液,冷冻真空干燥,得到莜麦清蛋白(naked oat albumin,NOA)。
1.3.1.2 莜麦球蛋白的提取
在1.3.1.1提取过清蛋白的滤渣中,每次加入200 mL NaCl(0.2 mol/L),35℃下搅拌提取2 h,过滤,重复提取3次,将合并的滤液在12 000 g下离心20 min,收集上清液,装入透析袋(MW 3 500 Da)中,4℃下透析24 h,每隔2 h换一次dH2O。将透析后的蛋白液冷冻干燥,得到莜麦球蛋白(naked oat globulin,NOG)。
1.3.1.3 莜麦谷蛋白-1的提取
在1.3.1.2提取了清蛋白和球蛋白的滤渣中,加入150 mL冰乙酸(体积分数50%),反复提取3次,收集并合并滤液,12 000 g下离心15 min。将上清液在4℃下透析24 h,每隔2 h换一次dH2O。透析后冷冻干燥,得到莜麦谷蛋白-1(naked oat glutelin-1,NOG-1)。
1.3.1.4 莜麦谷蛋白-2的提取
在1.3.1.3提取了清蛋白、球蛋白和谷蛋白-1的滤渣中,加入150 mL NaOH(0.1 mol/L),反复提取3次,收集并合并滤液,12000g下离心15min。将上清液在4℃下透析24 h,每隔2 h换一次dH2O。透析后冷冻干燥,得到莜麦谷蛋白-2(naked oat glutelin-2,NOG-2)。
1.3.2 亚铁离子螯合率的测定
亚铁离子螯合率的测定采用邻菲洛林法[10]。测定方法:取0.5 mL样品,加入9.5 mL dH2O,0.01 g维生素C和1 mg/mL氯化亚铁溶液0.1 mL,在一定水浴温度下螯合 60 min。将螯合液稀释500倍,取1 mL,依次加入1 mol/L盐酸1 mL、10%盐酸羟胺1 mL、0.12%邻菲啰啉1mL、10%乙酸钠5mL,然后定容至50mL,于510nm处比色。空白组用dH2O代替样品。计算公式如下。
螯合率/%=(1-A1/A0)× 100
式中:A1为样品组吸光值;A0为空白对照吸光值。
1.3.3 不同酶对莜麦谷蛋白-1的水解度和亚铁离子螯合率的影响
分别采用不同酶对莜麦谷蛋白-1(NOG-1)进行水解。包括胰蛋白酶、胃蛋白酶、木瓜蛋白酶、碱性蛋白酶和复合蛋白酶(碱性蛋白酶+风味蛋白酶),各酶的用量均为0.01 g/100 g,水解时间为2 h,而各自的pH值分别为7.0、2.0、7.5、9.0和7.5。分别采用甲醛滴定法[11]和邻菲洛林法[10]测定各莜麦谷蛋白-1水解物(naked oat glutelin-1 hydrolysates,NOG-1H)的水解度和亚铁离子螯合率。以螯合率最高的NOG-1H制备亚铁螯合物,并分析各影响因素。
1.3.4 不同温度对NOG-1H亚铁离子螯合率的影响
取等份的 NOG-1H 溶液(0.5 mL、2 g/100 mL),分别加入9.5 mL蒸馏水,0.01 g维生素C和1 mg/mL氯化亚铁溶液0.1mL,调节pH2.0,使其分别在不同温度(20、30、40、50、60 ℃)下进行螯合 60 min,测定螯合率。
1.3.5 不同pH值对NOG-1H亚铁离子螯合率的影响
取等份的 NOG-1H 溶液(0.5 mL、2 g/100 mL),分别加入9.5 mL蒸馏水,0.01 g维生素C和1 mg/mL氯化亚铁溶液 0.1 mL,调节 pH 值至 2.0、4.0、6.0、8.0、10.0,在30℃下反应60 min,测定螯合率。
1.3.6 亚铁离子浓度对NOG-1H亚铁离子螯合率的影响
取等份的 NOG-1H 溶液(0.5 mL、2 g/100 mL),分别加入9.5 mL蒸馏水,0.01 g维生素C和不同浓度的氯化亚铁溶液(0.25、0.50、0.75、1.00、1.25、1.50、1.75 mg/mL)0.1mL,调节 pH2.0,在 30℃下反应 60 min,测定螯合率。
1.3.7 不同时间对NOG-1H亚铁离子螯合率的影响
取等份的 NOG-1H 溶液(0.5 mL、2 g/100 mL),分别加入9.5 mL蒸馏水,0.01 g维生素C和氯化亚铁溶液(1 mg/mL)0.1 mL,pH 2.0、30℃下反应不同时间(30、60、90、120、150 min),测定螯合率。
1.4 数据分析
试验均重复3次,取平均值,邓肯氏新复极差法进行多重比较分析。
2 结果与分析
2.1 各莜麦组分蛋白的亚铁离子螯合率
莜麦各组分蛋白的含量与亚铁离子螯合能力见表1。
从表1可以看出,莜麦组分蛋白的含量从高到低依次为球蛋白、清蛋白、谷蛋白-1和谷蛋白-2,这与Sterna等的结果一致[5]。而NOG-1表现出最高的亚铁离子螯合能力,这可能与其特殊的氨基酸组成有关。段秀[10]研究表明,蛋白质中谷氨酰胺、天冬氨酸和谷氨酸含量较高时,由于具有大量的侧链羧基,容易螯合金属离子。Sterna等[5]的研究表明,NOG-1中酸性氨基酸(谷氨酸和天冬氨酸)的含量较高,这是其具有较高亚铁离子螯合和独特溶解性的主要原因。

表1 莜麦各组分蛋白的含量与亚铁离子螯合能力Table1 Ferrous chelating capacity of naked oat protein fractions
2.2 酶对莜麦谷蛋白-1水解度的影响
酶对莜麦谷蛋白-1水解度的影响如图1所示。
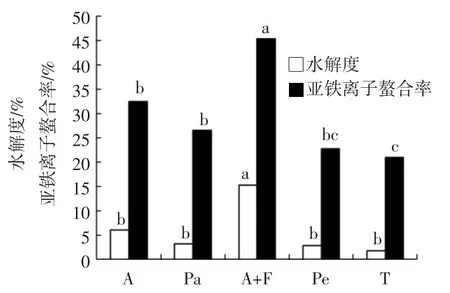
图1 酶对莜麦谷蛋白-1水解度和亚铁离子螯合能力的影响Fig.1 Effect of different enzymes on hydrolysis degree and ion chelating capacity of NOG-1
图1表明,NOG-1经碱性蛋白酶+风味蛋白酶降解后,水解度和螯合率均最高。可能是由于这两种蛋白酶分属内肽酶和外切酶,可以同时从多肽链的两端和中部位点水解NOG-1,释放出更多的活性肽段和氨基酸侧链,使NOG-1H表现出较高的亚铁离子螯合率。而对于木瓜蛋白酶、胰蛋白酶和胃蛋白酶来说,可能是它们最佳的水解温度、pH值对NOG-1的溶解度不利。
2.3 不同温度对NOG-1H亚铁离子螯合率的影响
温度对NOG-1H亚铁离子螯合率的影响如图2所示。
由图2可知,20℃~30℃内,温度上升,NOG-1H对Fe2+的螯合率上升,在30°C时达到最大值(52%);但随着温度的进一步升高,螯合率反而下降。可以看出,温度适当提高,可能使NOG-1H的分子结构进一步舒展,反应液中各分子的运动加剧,促进了NOG-1H与亚铁离子的螯合;而当温度进一步升高时,维系亚铁离子价态稳定的重要物质维生素C被破坏[10,12],使Fe2+被氧化为Fe3+,螯合率下降。
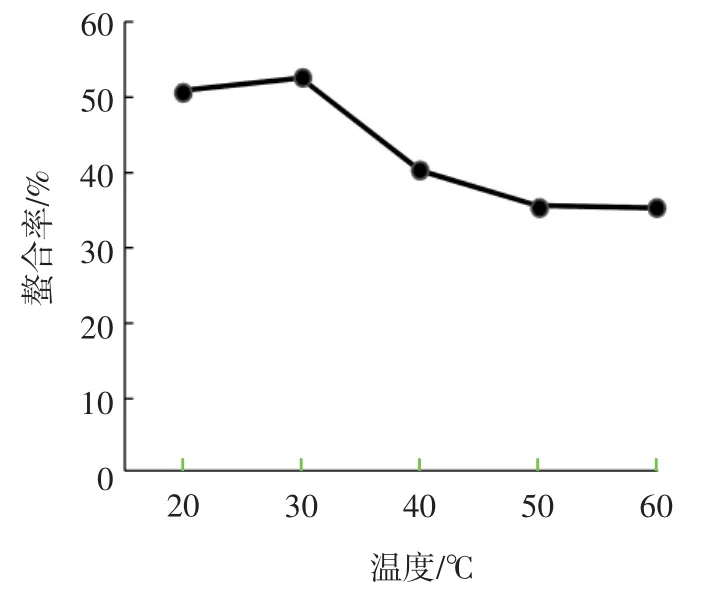
图2 温度对NOG-1H亚铁离子螯合率的影响Fig.2 Effect of temperature on ferrous-chelating rate of NOG-1H
2.4 不同pH值对NOG-1H亚铁离子螯合率的影响
pH值对NOG-1H亚铁离子螯合率的影响见图3。
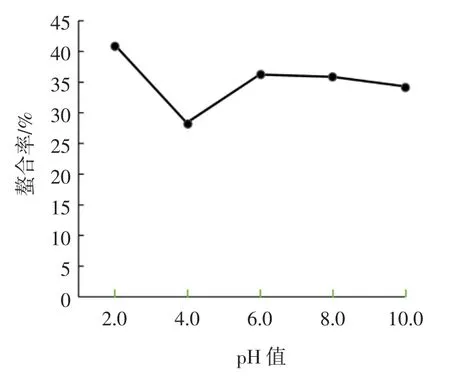
图3 pH值对NOG-1H亚铁离子螯合率的影响Fig.3 Effect of pH on ferrous-chelating rate of NOG-1H
图3中结果表明,NOG-1H在pH2.0时对Fe2+的螯合率最高;当pH 4.0时,NOG-1H对亚铁离子的螯合率最小;在pH6.0~pH10.0时,随pH值增大,NOG-1H与亚铁离子的螯合率略有下降。其原因可能有两个:1)pH值变化对NOG-1H溶解度的影响;2)pH值对反应体系重要稳定剂VC的影响。NOG-1H为稀酸溶解蛋白,因此在pH2.0时其溶解性较高,有更多的蛋白质分子参与对亚铁离子的螯合反应中,表现出更高的螯合率;而在pH 4.0,接近其等电点,溶解度最小,反应体系中参与螯合的蛋白质分子最少,表现出最低的螯合率;而在pH6.0~pH10.0时,随pH值增大,NOG-1H的溶解度也会逐渐下降,降低了NOG-1H的螯合能力。同时,VC在酸性环境中稳定,而高pH值会使其降低或丧失维系亚铁离子稳定的能力[10,12-13],从而使NOG-1H的螯合能力下降。
2.5 不同亚铁离子浓度对NOG-1H螯合率的影响
亚铁离子浓度对NOG-1H螯合率的影响如图4所示。
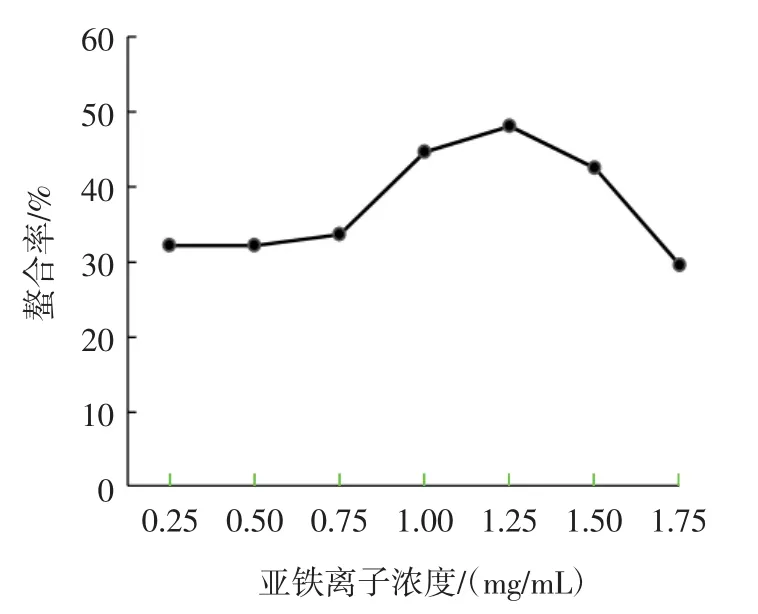
图4 不同亚铁离子浓度下NOG-1H的螯合率Fig.4 Effect of ion concentration on ferrous-chelating rate of NOG-1H
图4中结果显示,亚铁离子浓度在0.25 mg/mL~1.25 mg/mL,NOG-1H的螯合能力随亚铁离子浓度增大而升高;亚铁离子浓度进一步增加,NOG-1H的螯合能力反而下降。浓度增加,意味着更多的亚铁离子加入反应体系而被NOG-1H所螯合;而当浓度增大到一定程度时,多肽结构中的螯合位点趋于饱和,螯合率相对下降[11,14]。本试验螯合体系中,VC主要用来发挥抗氧化性,使亚铁离子避免被氧化为三价铁离子(Fe3+)。在VC浓度一定时,过量亚铁离子的加入意味着反应体系中没有足够VC来维持其亚铁离子状态,这会导致Fe3+的增加,并使反应体系的pH值升高,降低VC的活性,最终降低螯合率[12-13]。
2.6 不同时间对NOG-1H螯合率的影响
时间对NOG-1H亚铁离子螯合率的影响如图5所示。
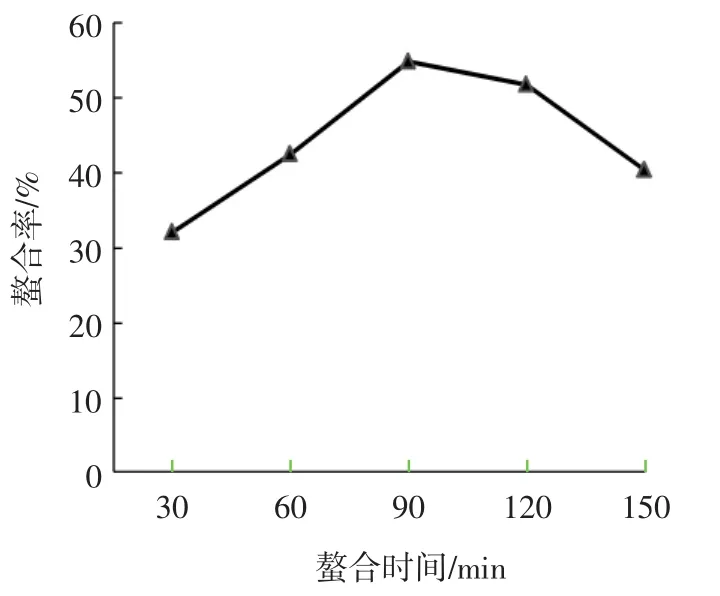
图5 时间对NOG-1H亚铁离子螯合率的影响Fig.5 Effect of time on ferrous-chelating rate of NOG-1H
由图5可知,时间从30 min到90 min,NOG-1H对亚铁离子的螯合率从32%上升至56%;在90 min~150 min内,NOG-1H的螯合率随时间延长而逐渐下降。部分原来被络合在多肽结构中的亚铁离子可能由于体系pH值的变化或螯合物稳定性较差而被释放到多肽结构外部,重新成为游离状态,最终使螯合率降低[12]。
3 结论与讨论
本试验的结果表明,水解度、温度、pH值等因素可以显著影响NOG-1H的螯合能力。当螯合时间为90 min,pH 2.0、温度为30℃、亚铁离子浓度为1.25 mg/mL时,NOG-1H的亚铁离子螯合率均较高。在蛋白质多肽与亚铁离子的螯合反应中,决定螯合率的主要因素是多肽链的氨基酸组成和空间结构。特殊的氨基酸基团如谷氨酸、谷氨酰胺和组氨酸等,由于含有较多的羧基、亚氨基,可以与亚铁离子形成氢键或化学键,表现出更高的螯合能力;同时,更加舒展的肽链结构,也意味着更多的活性基团被暴露,更多的亚铁离子可能被螯合[14-15]。此外,亚铁离子的价态是否稳定也是影响螯合率的重要因素。例如,VC具有还原性,可以使Fe2+不被氧化而保持在二价状态。温度、pH值等外部因素可以通过影响蛋白质在反应体系中的浓度、溶解度甚至结合位点的空间构象来影响其螯合能力。值得注意的是,在螯合反应中,维系Fe2+十分重要,pH值等外部因素可以通过改变稳定剂——VC的活性来影响螯合率。
