放线菌聚酮类化合物的合成生物学研究及生物制造
2021-03-30刘卫兵叶邦策
刘卫兵,叶邦策
(华东理工大学微分析与生物系统工程实验室,生物反应器工程国家重点实验室,上海200237)
聚酮类化合物是一大类天然产物的总称,也是次级代谢产物中最大的一类。聚酮化合物种类广泛,目前已发现的聚酮化合物超过10000种,由其衍生出的新化合物更是不计其数[1-2]。迄今已发现多种生物能合成聚酮化合物。如细菌(糖多孢红霉菌合成红霉素,erythromycin;金色链霉菌合成四环素,tetracycline)[3]、真菌(茄褐纹菌合成洛伐他汀,lovastatin)[4]、植物(大黄合成大黄素,emodin)[5]、昆虫(来自药材甲的雌性信息素,stegobinone)[6]等。其中,微生物生物合成是其主要来源途径,微生物可以通过不同的生物合成途径生成不同用途的药物,包括抗生素(如通过糖多孢红霉菌代谢合成红霉素,erythromycin A);抗真菌药物(如通过结节链霉菌合成两性霉素B,amphotericin B);抗寄生虫药物(如通过阿维链霉菌代谢合成阿维菌素,avermectins);杀虫剂(如多刺甘蔗多孢菌代谢合成多杀菌素,spinosyn A);免疫抑制剂(如吸水链霉菌合成雷帕霉素,rapamycin)及抗癌药物(如利用天蓝淡红链霉菌合成多柔比星,doxorubicin)等[7-13]。目前,全球约有70%的抗生素是由微生物制造,其中使用最多的是放线菌,约占所有微生物的2/3[14]。
聚酮化合物具有广泛的用途,特别是在医药领域,每年聚酮来源的药物销售额超过200 亿美元[15]。由于其在医药、健康等方面的巨大经济价值及应用前景,吸引了大量科学家的关注。随着合成生物学的发展及绿色制造的兴起,越来越多的研究人员对聚酮化合物进行深入研究,包括其代谢通路、合成途径、前体供应、底盘细胞优化、异源表达等,以期通过合成生物学的新技术不断改造和优化聚酮化学物的合成,同时利用绿色制造的理念,开发聚酮化合物生物合成的新思路。如Cheng 等[16]对正交柠檬烯生物合成(orthogonal limonene biosynthetic,OLB)途径进行了改造,用以高效生产柠檬烯,从而使柠檬烯生物合成比传统途径提升6倍,在补料分批发酵中可达917.7mg/L,是目前已知的最高产量。洛伐他汀(lovastatin)也是一种重要的聚酮类化合物,主要由土曲霉合成并被广泛用作降血脂的药物。包括洛伐他汀在内的他汀类药物占到降血脂药物市场总额的80%以上。Itoh 等[17]通过对土曲霉ATCC20542 的代谢途径进行改造,敲除其中甾醇调节元件结合蛋白和分裂激活蛋白可将洛伐他汀产量提高2.6倍和5.1倍。红霉素是一种典型的聚酮类化合物,也是医药和畜牧业中常用的大环内酯类抗生素,本文作者课题组[18-22]通过翻译后修饰代谢工程策略对红霉素工业高产菌进行代谢及调控通路改造,实现其产量翻倍(下文将详细介绍)。阿维菌素是知名的聚酮类大宗化学品,Wang等[23]通过改造阿维菌素合成途径中碳代谢流的策略使阿维菌素B1a 的工业生产效价达到史无前例的9.31g/L(详见下文介绍)。
聚酮化合物的生物合成途径中通常有多种酶系参与,其中,聚酮合酶直接参与聚酮化合物的合成过程;同时,在底盘细胞营养代谢与前体合成中也有大量不同类型的酶参与。此外,底盘细胞的营养代谢不仅涉及细胞本身的营养利用与生存,同时也关系到次级代谢产物合成时前体的供应。针对聚酮化合物生物合成途径中酶的调控与工程化改造能进一步优化聚酮化合物的生物合成网络。聚酮化合物的合成是以酰基辅酶A为起始单元和延伸单元,同时,酰基辅酶A 也是翻译后修饰中酰基化的供体。因此,酰基化等翻译后修饰不仅影响酰基辅酶A的代谢流,而且也会影响聚酮化合物合成中一系列酶的活性及功能。近年来,CRISPR 技术的应用为代谢途径改造提供了便利的平台,被大量用于聚酮化合物合成途径的改造。此外,聚酮化合物代谢调控网络优化、异源合成等都是聚酮化合物生物合成中广泛采用的策略,本文将针对以上几个方面,结合国内外最新研究成果,介绍当前聚酮化合物生物合成的研究进展。
1 放线菌聚酮类化合物的合成途径
1.1 聚酮化合物与聚酮合酶
聚酮类化合物作为具有重要价值的生物活性物质,其生物合成机制早期是由Birch 等[24]于1953 年提出的类似于脂肪酸生物合成的乙酰基合成途径假说,而且得到了众多实验室通过同位素标记方法的证实。此后,1990 年,Cortes 等[25]对红霉素的生物合成研究显示其合成基因在染色体上是成簇排列的,这一发现成为聚酮类化合物生物合成的里程碑,在此基础上,越来越多的聚酮类化合物生物合成基因簇被克隆。在聚酮化合物的合成中,聚酮合酶发挥了至关重要的作用,其催化机制与脂肪酸合成中脂肪酸合酶的催化机制类似,即通过酰基辅酶A 活化的底物进行重复脱羧而成[26-27]。聚酮类化合物生物合成酶根据其结构域的组织形式可以分为三类:Ⅰ型、Ⅱ型和Ⅲ型聚酮合酶(polyketide synthases,PKSs)。其中,研究最清楚的是1990 年发现的Ⅰ型PKS[28-29],它由多个具有不同功能的多肽组成。每一个多肽含有不同的结构域,它们分别参与聚酮链延伸时的单个生化反应。Ⅰ型PKS催化生成的聚酮化合物包括红霉素(erythromycin)、阿维菌素(avermectins)、利福霉素(rifamycin)、雷帕霉素(rapamycin)、洛伐他汀(lovastatin)及埃博霉素(epothilone)等。与Ⅰ型PKS 不同,Ⅱ型PKS 被称为迭代类(interative)PKS,其包含一套可重复多次催化相同反应的结构域,此类PKS 是1984年首次在细菌中被报道[30-31]。Ⅱ型PKS催化生成的聚酮化合物包括富伦菌素(frenolicin)、放线紫红素(actinorhodin)、多柔比星(doxorubicin)等。此外Ⅲ型PKS是在1999年被发现[32],Ⅲ型PKS是同型二聚体酶,具有两个同源的亚基,但是相比其他两型PKS,Ⅲ型酶结构更简单,而且它不依赖于乙酰磷酸,其他两类PKS常通过乙酰磷酸活化酰基辅酶A底物。Ⅲ型PKS主要催化芳香类聚酮化合物的生物合成,例如淡黄霉素(flaviolin)。除了结构和功能的差异,在遗传进化上,Ⅲ型PKS与其他两类PKS及FAS(脂肪酸合酶)的距离也较远。
通常绝大多数聚酮化合物都是由PKS催化,如红霉素的母体大环内酯糖苷配基是6-脱氧红霉内酯B(6-dEB),由一个起始单元丙酰辅酶A和六个甲基丙二酰辅酶A延伸单元经六个缩合步骤缩合而成[25,29]。阿维菌素生物合成的起始单元是异丁酰辅酶A(来自缬氨酸)或2-甲基丁酰辅酶A(来自异亮氨酸),而延伸单元是七个丙二酰辅酶A(用于乙酸酯单元)和五个甲基丙二酰辅酶As(用于丙酸单位)[33]。以上两种抗生素都是由Ⅰ型PKS 催化,Ⅱ型PKS催化的多柔比星是由丙酰辅酶A为起始单元,九个丙二酰辅酶A 为延伸单元缩合而成的[34]。大多数Ⅲ型PKS催化的聚酮化合物是以丙二酰辅酶A作为起始单元和延伸单元[35](见图1)。不同的聚酮化合物在结构上具有丰富的多样性,其中一个原因是合成过程中采用了不同的酰基辅酶A作为起始单元和延伸单元[36]。因此,作为聚酮合成前体的酰基辅酶A 的供给对于其生物合成是至关重要的。
1.2 聚酮类化合物生物合成的前体供应及优化
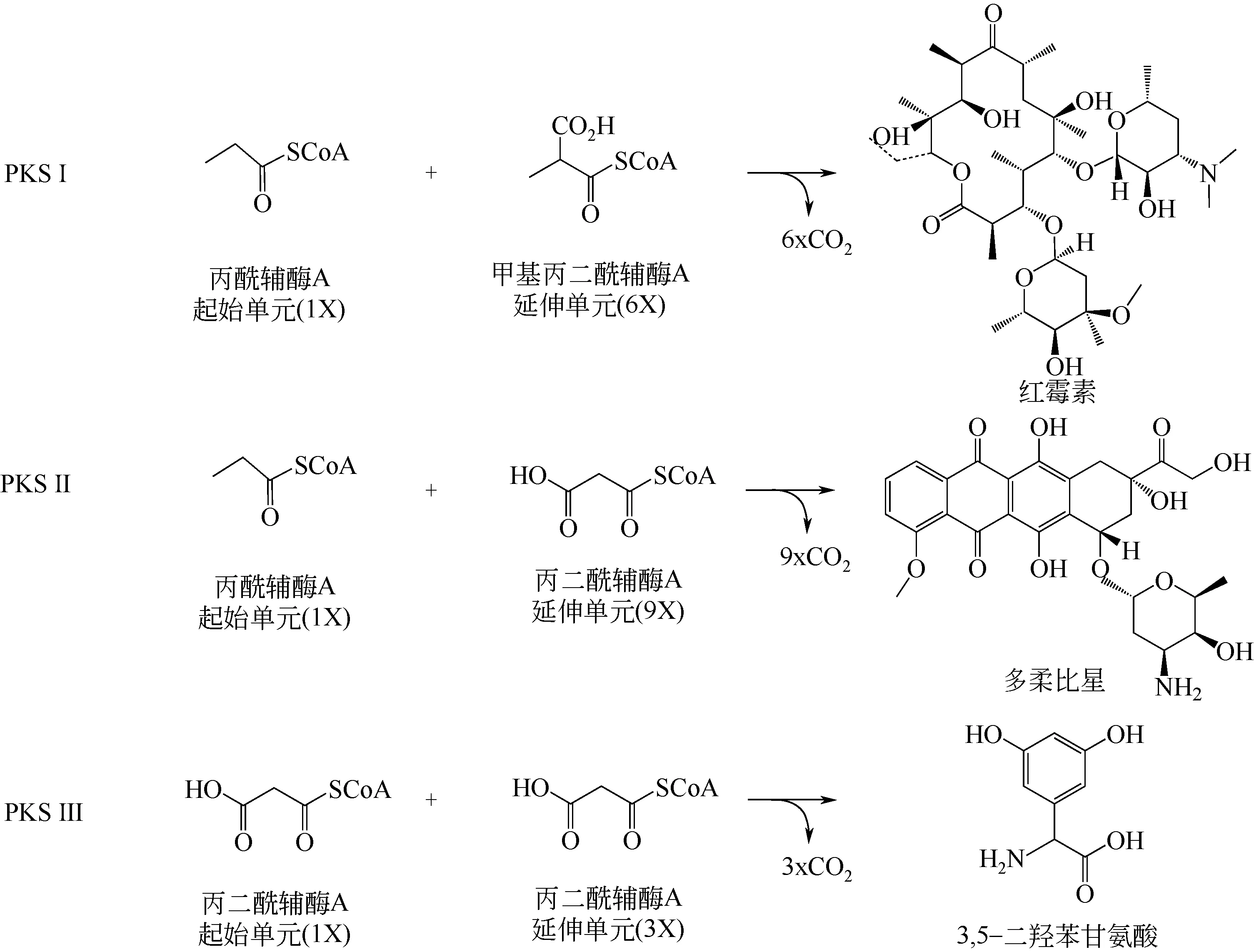
图1 三类PKS催化的代表性反应
聚酮化合物的生物合成过程中,酰基辅酶A是关键的前体物质,也是必要的延伸单元。其中,丙二酰辅酶A是重要的中心代谢产物,是微生物合成许多可药用的聚酮化合物以及包括生物燃料在内的脂肪酸衍生化合物的基本组成部分[37]。胞内产生的丙二酰辅酶A会被优先用于脂肪酸的合成而不是其他衍生物,这会导致胞内合成聚酮化合物等次级代谢产物的前体不足,从而限制聚酮化合物的生物合成[38-40]。因此,抑制脂肪酸的合成通路,有利于增加丙二酰辅酶A对聚酮类化合物合成的供给[41-44]。
随着合成生物学的发展,挑选合适的底盘宿主进行聚酮化合物等生物活性物质的异源合成已被普遍使用[45]。近年来,特别是酿酒酵母、大肠杆菌和谷氨酸棒状杆菌已被工程化改造以部分替代放线菌用于聚酮化合物的生物合成。然而,发达的菌株和工艺通常有生产率不足的困扰。通常,细胞内被严格调控的丙二酰辅酶A的可用性被认为是限制整体产品合成的决定性瓶颈。因此,为改善丙二酰辅酶A的利用率而进行的代谢工程改造对于设计高效的微生物细胞工厂以生产聚酮化合物至关重要[46](见图2)。
在大多数有机体中,丙二酰辅酶A是由乙酰辅酶A 羧化酶催化的乙酰辅酶A 羧化作用专一性合成。增加乙酰辅酶A的供给对于改善丙二酰辅酶A用于聚酮化合物合成的可用性是非常关键的。通常,调整中心碳代谢以使乙酰辅酶A作为直接的丙二酰辅酶A前体分子增加可用性,对于丙二酰辅酶A 合成和所有丙二酰辅酶A 衍生的产品都是有益的。如通过部分消除丙酮酸的羧化作用将糖酵解的代谢流集中于乙酰辅酶A,有助于促进在谷氨酸棒杆菌中合成丙二酰辅酶A 依赖的去甲丁香色原酮(一种药用植物芦荟中的五肽)[47]。谷氨酸棒杆菌中解除对iolT1 的表达限制,可以改善葡萄糖的吸收,提高酰基辅酶A的代谢池,进而增加聚酮化合物和羟基苯甲酸的合成[48-49]。
酰基辅酶A不仅作为起始单元和延伸单元参与聚酮化合物的合成,同时,在翻译后修饰中,酰基辅酶A也是酰基化的主要供体,参与聚酮化合物合成通路的翻译后修饰调控前体的供应。丙酰辅酶A是红霉素合成的直接前体,在红霉素生物合成过程中,一方面,丙酰辅酶A的积累有益于红霉素生物合成,另一方面,丙酰辅酶A 作为丙酰化的供体,其积累也有利于丙酰化的发生,但赖氨酸丙酰化会抑制红霉素生物合成途径中重要酶的活动。研究显示,NAD+依赖性的去酰基化酶的超表达可以规避高酰基辅酶A浓度的抑制作用。在其他酰基辅酶A衍生天然产物的生物合成中也存在类似的赖氨酸酰基化机制,如丙二酰辅酶A来源的生物碱和丁酰辅酶A来源的生物酒精等[50]。此外,为了提高红霉素合成前体(丙酰辅酶A)的供应,研究显示,还可以通过敲除丙酰辅酶A 转移酶基因acuA 和过表达SACE_1780 来绕过由丙酰化引起的反馈抑制作用,并使红霉素的产量提高22%[51]。这些改造不仅改善了前体供应以提高红霉素的产量,同时也为合成生物学提供了有效的翻译后修饰代谢工程学策略(PTM-ME),以改善次级代谢产物(见图3)。
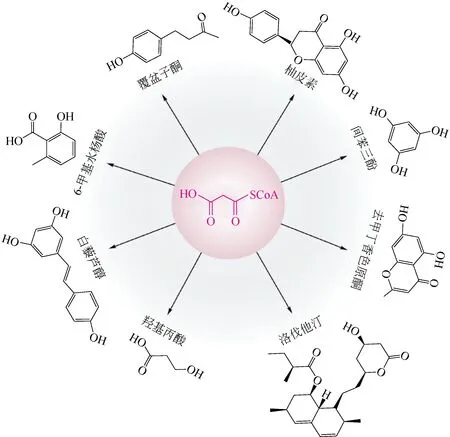
图2 不同微生物合成的丙二酰辅酶A衍生产物
1.3 聚酮类化合物合成代谢途径改造
对聚酮类化合物代谢途径的改造主要包括聚酮生物合成相关基因簇的工程化改造、调控网络改造及合成途径改造等。在基因工程改造方面,可以通过对目标产物生物合成代谢旁路的相关基因的精简、优化,从而减少底物的消耗,强化目标产物的生物合成,提高其产量。如在新型的链霉菌底盘细胞FR-008 中,通过选择合适的元件即可高效地表达聚酮化合物[52]。又如在纳他霉素的产生菌Streptomyces chattanoogensis L10 中通过敲除1.3Mb和0.7Mb 的非必需基因后得到的底盘细胞能明显提高聚酮天然产物的合成效率[53]。随着CRISPR 技术的发明和应用,基因工程操作更加便捷和精准,这也使得CRISPR 技术被越来越多的合成生物学研究人员所关注,并被大量用于链霉菌的基因工程改造[54]。链霉菌作为天然产物合成的底盘细胞具有酵母、大肠杆菌或其他微生物所不具有的诸多优点,CRISPR 等新技术的应用,更使这些优点得以充分发挥[55]。近年来,CRISPR-Cas9 作为“经典”的CRISPR 系统,被广泛用于链霉菌基因编辑。如通过CRISPR-Cas9 系统在基因组中插入启动子激活PKS、NRPS 等基因簇用以在多个链霉菌中合成新的产物[56]。在糖多孢红霉菌中,使用CRISPR-Cas9敲入启动子Pj23119-PkasO替换基因组上原生启动子用以激活红霉素的合成,能使得红霉素的产量提高58.3%[57-58]。随着CRISPR技术的广泛应用,越来越多的CRISPR 系统被开发出来用于链霉菌的代谢工程改造。Tong 等[59]开发了一套综合的CRISPR 工具包,其中包括CRISPR-Cas9 系统的多种变体,以及用于链霉菌的CRISPRi 和基于CRISPR 的编辑系 统(CRISPR-base editing systems, CRISPRBEST)。这些CRISPR 工具可用于生成随机大小的缺失文库,引入小插入或缺失,生成特定靶基因的框内缺失,可逆地抑制基因转录以及替代链霉菌基因组中的单碱基对等。此外,该工具包还包含基于Csy4 的多路复用选项,可在单个实验中引入多个编辑内容。通过使用该工具包,可以将链霉菌中失活靶基因的时间缩短到10 天以内,比其他可选方案要快得多。此外,Cobb 等[60]基于CRISPR-Cas 平台建立的pCRISPomyces 技术也能对多种链霉菌进行高效的基因编辑,快速获得20bp~30kb等长度不等的基因缺失。
聚酮生物合成相关基因簇的工程化改造中,大片段的克隆一直是一个难点。然而,大多数聚酮合酶的基因簇约为70~80kb,如何克隆这些大片段是对其进行工程化改造,特别是异源表达的关键。最近,Liang 等[61]结合CRISPR-Cas12a 剪切和细菌人工 染 色 体(bacterial artificial chromosome,BAC)文库构建的优势开发了一种简单、快速和高效的基因簇克隆方法(CAT-FISHING),即CRISPRCas12a 介导的快速直接生物合成基因簇克隆,可以直接克隆49~139kb 的基因簇。经过进一步优化后,该方法能够在链霉菌底盘中以较低的时间成本有效地克隆并表达87kb 长、富含GC(76%)的生物合成基因簇。

图3 酰基辅酶A前体供应与酰基化供体对酰基辅酶A合成天然产物的功能相互作用[50]
聚酮化合物合成基因簇的表达,受到诸多调控因子的严谨控制,因此,对各类调控因子的改造也是众多研究人员关注的重点之一,同时也是聚酮化合物代谢网络改造的常见策略。微生物具有复杂精密的初级和次级代谢网络,这其中,各种调控因子发挥着四两拨千斤的作用,其受到修饰、改造及调控时,会直接或间接影响相关的代谢调控网络。这些调控因子有些能控制全局,有些只参与特定的专一途径的调控。因此,对这些调控因子进行改造或修饰,可以实现微生物次级代谢网络的精细化调控。如通过对Streptomyces albus J1074 中调控因子CRP 的过表达,及基因pfk 的缺失突变等操作,可以实现放线紫红素的异源表达[62]。微生物的营养吸收与利用对初级代谢和次级代谢都至关重要,不仅关系底盘细胞的生长,还是次级代谢前体物资的重要来源。在碳、氮、磷等营养素代谢过程中,有多重调控因子参与其中。如DasR 作为链霉菌中的多效调控因子,能在多种链霉菌中调控N-乙酰氨基糖、柠檬酸盐等的利用,从而影响链霉菌的初级及次级代谢[63-65]。氮代谢全局调控因子GlnR不仅调控链霉菌的氮源代谢,同时也参与碳源的代谢。如在糖多孢红霉菌中,GlnR 不仅调控作为聚酮合成前体的酰基辅酶A的代谢,同时也能调控作为红霉素发酵生产的底物淀粉的代谢[65-70]。链霉菌中磷源代谢受双组分调控因子PhoR-PhoP 的控制,同时还参与呼吸作用、细胞分化和抗生素的生物合成调控及与其他营养素的协同调控。在糖多孢红霉菌中,PhoP 在转录水平上可以通过直接和间接两种方式控制红霉素生物合成相关基因的转录,在翻译后修饰水平上,PhoP 的活性受到赖氨酸丙酰化调控[18,68,71]。在天蓝色链霉菌中,PhoP 抑制了几种分化和多效性调控基因,这影响了菌体生长并间接影响了抗生素的生物合成。在阿维链霉菌中也存在类似的调控机制[72-73]。此外,GlnR 和PhoP 也可以协同调控氮、磷的代谢,从而影响链霉菌次级代谢产物的合成[67-68](见图4)。
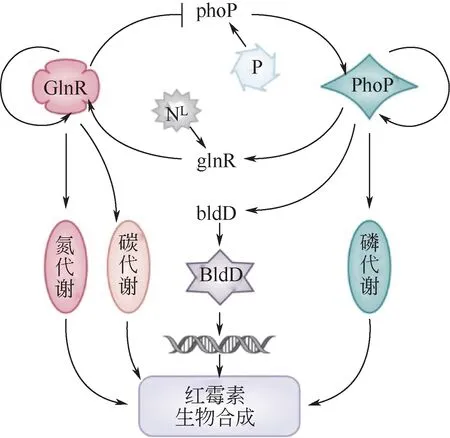
图4 GlnR和PhoP介导的糖多孢红霉菌中初级代谢与红霉素生物合成之间的交叉调控
除了产物合成相关基因的工程化改造以及调控因子的改造外,通过对聚酮化合物的传统合成途径进行改造,以减少能源消耗,提高经济效率,是当前绿色生物制造的发展趋势。在传统的聚酮合成途径中,乙酰辅酶A是连接糖酵解、三羧酸循环和脂肪酸合成的主要代谢节点。当前大多数的聚酮化合物生产平台都依靠漫长的糖酵解步骤来提供乙酰辅酶A,这一过程需要消耗大量辅酶和ATP,同时天然受到复杂的调控影响。通过探索使用乙酸代谢提供乙酰辅酶A可以作为乙酰辅酶A供给的捷径,从而规避传统糖酵解途径的缺点,相关策略已应用在聚酮化合物三乙酸内酯(triacetic acid lactone,TAL)的合成中[74]。三乙酸内酯是聚酮合酶合成的典型副产物,同时也是很多聚酮化合物合成的前体[75]。目前,已经有诸多代谢工程研究人员用大肠杆菌、酿酒酵母、解脂耶氏酵母等建立了许多产TAL 的宿主菌株[74-78]。其中,Liu等[74]通过改造解脂耶氏酵母中乙酸盐的吸收途径,用于高效生产TAL,同时便捷获得乙酰辅酶A用于聚酮化合物的高效、经济性的生物合成。通过此乙酰辅酶A代谢捷径的碳通量超过了天然糖酵解途径提供的碳通量。与葡萄糖相比,这种替代性碳源具有代谢优势,可释放内源性代谢途径的限制从而提高碳的转化效率和降低成本效益(见图5)。
在自然界中发现的聚酮类化合物是在聚酮合成酶(PKSs) 催化下,通过克莱森缩合反应(Claisen condensation)进行迭代脱羧合成的骨架。这一传统的代谢途径依赖于PKSs 的催化。然而,PKSs 存在复杂的结构、能源效率低下、复杂的调控以及与延伸单位丙二酰辅酶A 的必要代谢途径的竞争等缺点,这些因素会限制聚酮类生物合成的通量。Tan 等[79]在传统的PKS 催化途径之外,开发了一条新的依赖聚酮酰辅酶A 硫醚酶(PKTs)的代谢途径来催化聚酮类主链的形成,这一过程通过迭代非脱羧克莱森缩合反应来实现,因此提供了一种综合和高效的PKSs 替代方案(见图6)。并已实际用于具有代表性的内酯、烷基间苯二酚酸、烷基间苯二酚、羟基苯甲酸和烷基酚聚酮族的聚酮骨架的合成。PKT 催化的反应提供了一种聚酮合成的新途径,这一途径利用硫醚酶的简单结构来实现更高的ATP 效率,并减少与基本代谢途径的竞争,所有这些都规避了PKSs 合成聚酮产物的低效率等缺点。

图5 解脂耶氏酵母TAL合成代谢途径
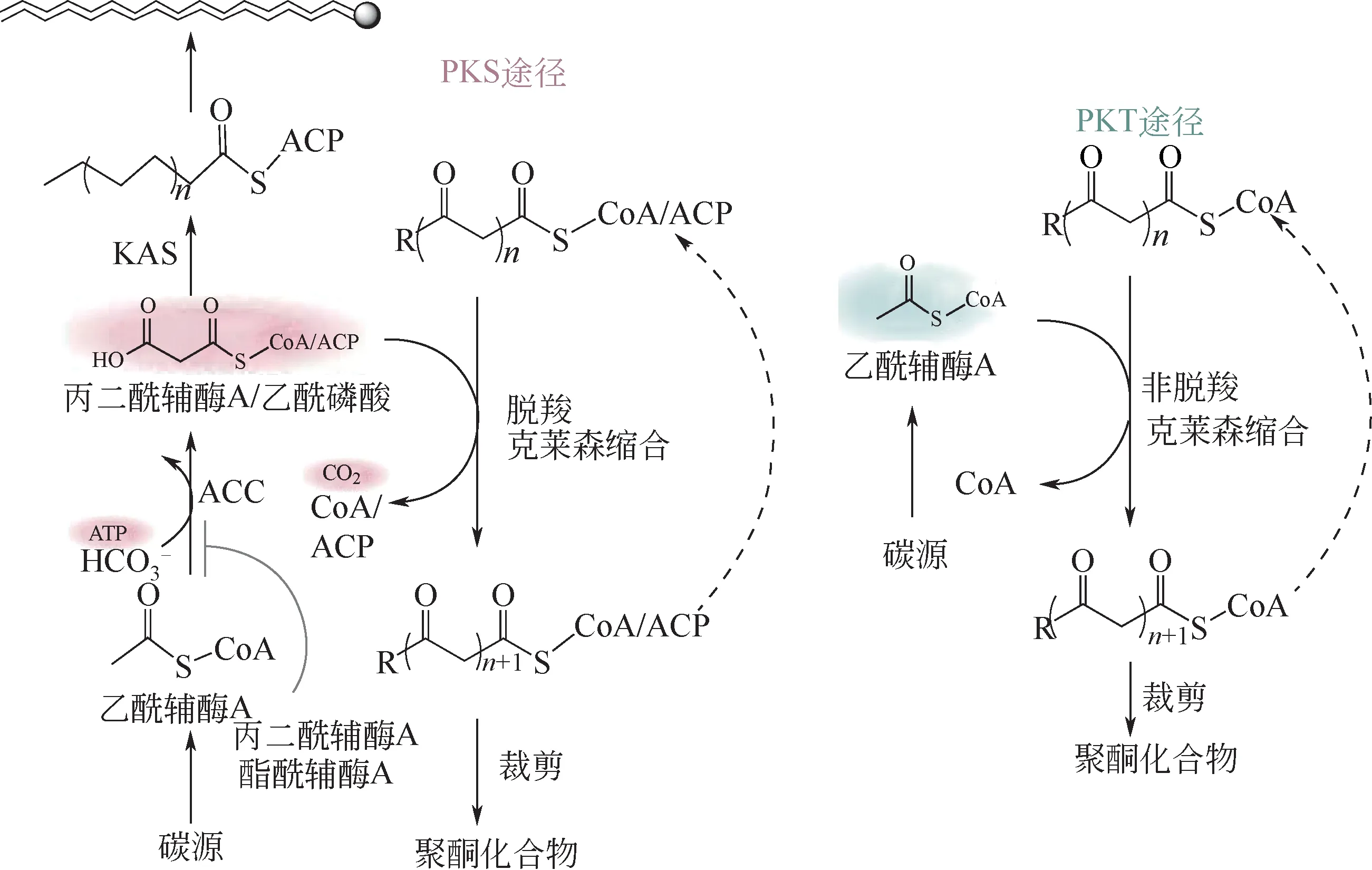
图6 聚酮生物合成中PKS途径与PKT途径的比较
2 放线菌聚酮类化合物合成的应用
聚酮类化合物数量庞大、结构多样、活性丰富,是新药开发的重要前体。在聚酮化合物生物合成的多种底盘细胞中,放线菌具有多种不同的系统,可以用于合成不同结构和功能的聚酮化合物[80]。随着合成生物学的兴起和应用,在传统聚酮化合物合成机理的基础上,充分运用合成生物学系统化设计和工程化构建的策略,对聚酮化合物的合成途径进行改造在众多聚酮化合物的合成中取得了成功。如针对底盘细胞的调控网络优化、代谢流的改造以及聚酮合成基因簇的异源表达等在红霉素、阿维菌素及多杀菌素的生物合成中的应用,使得相关聚酮化合物的产量得到了突破性的提升。
2.1 红霉素的生物合成研究进展
红霉素及其衍生物在临床治疗及畜牧业中应用广泛,目前有大量研究工作以提高糖多孢红霉菌的红霉素产量,并且糖多孢红霉菌已作为一个抗生素生产系统模型被广泛研究[81]。在红霉素生物合成过程中,改善前体供应[51]、改造糖多孢红霉菌的次级代谢通路[57]、优化红霉素合成调控网络[18,66,71,82]是常见的几种提高红霉素产量的策略。在红霉素生物合成中,丙酰辅酶A是其直接前体,同时也是丙酰化的酰基供体。丙酰辅酶A的过量供应会引起超丙酰化,这被证明对糖多孢红霉菌中红霉素的合成有害[18,50-51,83]。红霉素的高效生物合成需要作为前体的丙二酰辅酶A的充足供应,但是过量的酰基辅酶A 激活代谢酶的酰基化,从而反馈抑制产物的合成。Xu 等[18]使用酰基化修饰组学技术结合生物信息学分析,发现酰基辅酶A浓度与蛋白质酰基化水平及红霉素产量之间的相关性。在此基础上,通过酰基化组学与酶学分析,研究人员揭示了丙酰化是影响红霉素合成的关键因素,并提出了阻碍丙酰化及优化PhoP 介导的磷源与碳源协同调控网络,从而对酰基化酶脱敏以消除丙酰化对红霉素合成的抑制作用。通过PTM-ME 策略实现工业生产用糖多孢红霉菌中红霉素的产量翻倍[18-22](见图7)。
2.2 阿维菌素的生物合成研究进展
阿维菌素作为制药公司的大宗商品,年销售额达10 亿美元,其生物合成主要通过阿维链霉菌在发酵生长的稳定期作为次生代谢产物产生。阿维菌素的合成前体主要是丙二酰辅酶A,其主要是通过乙酰辅酶A和丙酰辅酶A羧化产生。其中酰基辅酶A 羧化酶(ACCases)起到了关键的作用,通过对ACCases 的调控,能影响阿维菌素合成的前体供应。研究人员发现阿维链霉菌AccR 能结合并抑制accD1A1-hmgL-fadE4 操纵子进而抑制胞内乙酰辅酶A和丙酰辅酶A的同化。而甲基巴豆酰-、丙酰-和乙酰辅酶A 能充当效应子,将AccR 从其靶DNA释放,从而通过去阻遏作用增强靶基因的转录,提高前体供应。甲基巴豆酰-和丙酰辅酶A对AccR的亲和力强于乙酰辅酶A。敲除accR能使短链酰基辅酶A(乙酰-、丙酰-、丙二酰-和甲基丙二酰辅酶A)的浓度增加,从而使阿维菌素产量增加14.5%[84]。在微生物的初级代谢和次级代谢中都存在碳代谢阻遏现象。Lu 等[85]的研究显示,ROK 家族调控因子Rok7B7 直接控制阿维链霉菌中碳分解代谢物的阻遏、抗生素的生物合成和形态发育,通过敲除Rok7B7 解除碳代谢阻遏,可以增加阿维菌素的产量。与改造前体供应的调控网络不同,Wang 等[23]采用重构阿维菌素合成通路中的碳代谢流的策略来提高阿维菌素的产量。首先通过多组学技术揭示了在初级代谢过程中积累的细胞内三酰基甘油(TAGs)在稳定期被降解。这个过程中将碳流量从细胞内TAG 和细胞外底物引导到聚酮化合物的生物合成中。他们设计了一种名为“TAG 的动态降解”(ddTAG)的策略,以调动TAG 池并增加聚酮化合物的生物合成。使用ddTAG,提高了天蓝色链霉菌、委内瑞拉链霉菌、龟裂链霉菌和阿维链霉菌中放线紫素、杰多霉素B、土霉素和阿维菌素B1a 的滴度。将ddTAG 策略应用在180m³工业规模发酵中将阿维菌素B1a 的效价提高了50%,达到9.31g/L,这是有史以来最高的效价(见图8)。
2.3 多杀菌素的生物合成研究进展
多杀菌素是具有重大商业价值的广谱杀虫剂之一,是由刺糖多孢菌合成的一组大环内酯类杀虫剂。尽管刺糖多孢菌可用于工业规模生产多杀菌素,但是却具有诸多缺点,包括生长周期长、发酵生物量低和淀粉利用效率低等。为了克服这些缺点,通过合成生物学的手段进行多杀菌素异源表达合成具有重要的意义。Zhao等[86]通过BAC载体将完整的多杀菌素合成基因簇(74kb)以及结合转移和位点特异性整合所需的元件引入不同的链霉菌宿主中用以构建多杀菌素的异源生产菌株。使用这种方法构建的天蓝色链霉菌和淡紫色链霉菌异源合成菌株,多杀菌素的产量可分别达到1μg/mL和1.5μg/mL[86]。此外,基于多组学分析的异源表达改造可以使异源表达突变株的构建更高效且具有针对性,Tan 等[87]使用多组学方法指导链霉菌内多杀菌素异源表达的代谢途径优化,使多杀菌素的产量比原始菌株提高了1000 倍。这些研究提供了通过异源宿主中的遗传操作生产多杀菌素及其类似物的潜在替代途径,也为聚酮化合物绿色制造提供了可选的策略。
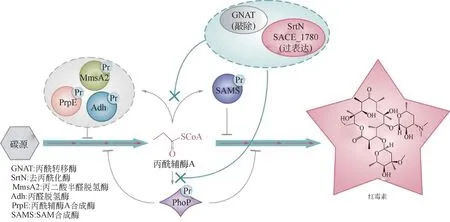
图7 PTM-ME应用促进红霉素的高效合成
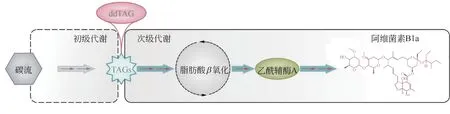
图8 ddTAG策略在阿维菌素B1a生物制造中的应用
3 结语及展望
聚酮化合物应用广泛,其工业化生产主要利用微生物特别是放线菌发酵。随着合成生物学的蓬勃发展,全球的研究人员以产物为导向,围绕微生物底盘细胞进行全方位的改造与优化,不仅涉及前体供应、底物利用、代谢途径改造、调控网络优化,还涉及目标产物的异源表达与合成等。在这些方面的努力已经取得了一定的成绩,但是依然有众多瓶颈亟待解决。
首先,如何更好地平衡初级代谢与次级代谢,最大化地利用底物和前体合成目标产物依然是亟待解决的问题。虽然现在已经有很多研究人员采用阻断竞争旁路、强化前体利用的代谢途径来提高前体的利用效率,但是如何智能、精准地找到初级代谢和次级代谢的平衡点,使前期初级代谢进行细胞富集与后期次级代谢产品合成最优化的配合,依然是巨大的难点。这可能需要计算机、数学、分析化学、合成生物学等多学科配合进行进一步的探索。
其次,随着合成生物学的发展,在改造传统底盘细胞的同时,不断开发生长快速、操作简单的新型底盘细胞用于聚酮化合物的异源表达与合成也是目前合成生物学的热点。通过基因工程手段将聚酮化合物代谢通路移植到新的底盘细胞并与其调控网络进行优势互补,构建新型、优势底盘细胞,解决异源代谢网络与调控网络的适配性是目前面临的又一个难点。
最后,随着环保、绿色制造的理念日益深入人心,聚酮化合物的工业化发酵生产也面临碳排放与绿色经济的压力。在传统利用PKS催化进行聚酮化合物生物合成过程中,存在反应动力学缓慢、能源效率低、碳经济性差等缺点。在这一过程中,约有1/3 的碳以二氧化碳的形式损失掉,这不仅增加了碳排放的压力,同时也是碳源的损失。因此,通过合成生物学手段进行聚酮化合物生物合成代谢网络的重新设计与改造,在降低能耗与碳损失的同时,不断提高目标产物产量是当前合成生物学面临的挑战。相信随着研究的不断深入,以上这些瓶颈和挑战终将被克服。
