生物丁醇分离技术的研究进展及发展趋势
2021-03-30蔡的李树峰司志豪秦培勇谭天伟
蔡的,李树峰,司志豪,秦培勇,谭天伟
(北京化工大学生命科学与技术学院,北京100029)
(正)丁醇(C4H10O)是一种重要的大宗化学品和潜在的替代燃料。用作液体燃料时,相比传统的燃料乙醇,丁醇分子碳链更长、碳氢比例更高、热值更大、汽油相容性更好、挥发性更低,具有显著优势[1](表1)。因此,通过丙酮-丁醇-乙醇(ABE)发酵,生物催化转化非粮生物质制备丁醇是生物能源领域研究的热点和重要方向之一[3]。尽管ABE 发酵的研发历史悠久,生物转化技术较为成熟,然而受制于ABE 发酵复杂的产物组成和较高的细胞毒性,生物丁醇的分离成本高、难度大[4-6]。据估算,在传统工艺中,生物丁醇的分离成本占总生产成本的14%以上,占比仅次于原料成本,是制约产业化应用的主要瓶颈之一[7]。
为解决生物丁醇分离的技术难题,近年来,在实验室和中试规模上应用并验证了多种新型分离技术[8-9]。相比于传统的“发酵-精馏”过程,这些分离技术可显著降低ABE溶剂产物分离的能耗[10]。值得注意的是,一些技术具有较低的细胞毒性和操作稳定性,并可以在温和条件,如发酵温度下实现产物的高效分离[11]。这样,通过分离模块与生物反应器的耦合,可以实现溶剂代谢-分离平衡,将发酵醪液中的产物浓度维持在较低水平[12-13]。其优势在于:耦合系统内的反应器具有较低的溶剂浓度,可显著降低溶剂对细胞的毒性,提升菌体对目标溶剂的代谢能力,促进底物代谢向产物方向移动;部分耦合系统可实现连续发酵-分离操作,提升溶剂生产速率;原位分离可显著提升ABE 溶剂浓度,显著降低生物丁醇的分离成本[14-16]。
如表2所示,用于ABE发酵醪液中溶剂产物回收的技术按照分离方式可分为:基于汽液平衡的分离、基于相转移的分离及膜分离技术。其中,基于汽液平衡的分离除传统的精馏系统外,还包括了汽提、闪蒸(真空分离)等;基于相转移的分离方式包括吸附、液液萃取、盐析、浊点萃取等;膜分离技术包括渗透气化、渗透萃取、膜蒸馏、反渗透等。本文梳理了不同类型分离方法的基本原理和在生物丁醇分离领域的应用实例,综述了相关工艺路线的最新研究进展,并结合技术发展趋势,对新型分离技术在生物丁醇制备过程中的应用前景进行了展望。
1 基于汽液平衡的生物丁醇分离方法
构建高产、高耐受菌株是生物丁醇制备的难点之一。近年来,大量研究采用代谢组学和进化工程手段对产丁醇菌株进行改造,并对传统发酵过程进行调控和强化,以期从源头上改善丁醇分离效率,但多级研究仍存在发酵浓度低、发酵副产物多等问题[17-20]。一般而言,现有技术无法使ABE发酵醪液中的丁醇体积分数突破2.5%。除代谢产生的丙酮、丁醇、乙醇等挥发性溶剂产物外,醪液中还含有高沸点有机酸副产物,如乙酸、丁酸等[21]。针对汽液平衡的分离技术而言,ABE 混合物含有许多极性化合物,因此表现出较强的非理想性;另一难点是发酵溶剂产物中的丁醇-水、乙醇-水可形成共沸物,增加了生物丁醇的分离难度[22-23]。据估算,采用传统精馏技术纯化0.5%丁醇-水混合物的分离能耗高达79MJ/kg(制备脱水丁醇),远高于正丁醇的燃烧热[23]。
1.1 汽提
汽提的分离效果受底物浓度、温度、载气种类和流量、气泡分布、冷凝温度等因素影响[24-25]。受制于溶剂的汽液平衡局限,汽提法分离ABE的效率较低,节能效果有限;但该过程操作相对简单,无细胞毒性,适用于与发酵过程耦合,并将ABE随载气带离生物反应器,进而显著降低发酵产物毒性,提升溶剂产率和底物对溶剂转化率[26-29]。
强化溶剂分离效率以获取更高浓度ABE 冷凝液,进而减少整体分离能耗是汽提技术发展的主要方向。由于丁醇的极性较低,水溶性较差,在室温下质量分数高于7.7%的丁醇水溶液可发生自然分相。而在ABE 溶液中,尽管极性更高的乙醇以及丙酮等副产物对ABE 分相产生一定不利影响,但在一定溶剂比例和浓度下依旧可产生相分离现象[29-31]。研究表明,在原位分离过程中,获得分相的ABE 溶剂可显著降低下游产物精制和纯化过程的能耗和设备投资。例如,对分相的ABE 有机相和水相分别进行精馏,与有机相、水相混合后直接精馏相比能耗和总成本可降低约25.8%和17.4%[32]。

表2 不同生物丁醇分离技术原理及对比
根据汽提分离原理,发酵醪液浓度与ABE 冷凝液浓度存在明显的正相关性。为获得浓度高、分相明显的ABE 汽提冷凝液,提升发酵醪液中待分离溶剂浓度是关键。因此,在发酵过程中采用高丁醇耐受性突变菌株、利用细胞固定化技术提升产丁醇梭菌耐受性等是实现ABE 高产的有效策略。例如,Xue 等[33]利用进化工程筛选得到的高产、高耐受突变株进行发酵,并与汽提分离耦合,在优化汽提速率和冷凝温度后,可获得溶剂浓度达195.9g/L的分相冷凝液(其中丁醇浓度为150.5g/L)。Cai等[34]将突变的丙酮丁醇梭菌固定在多孔秸秆表面,构建类悬浮床生物催化反应器。在载气扰动下,载体悬浮并促进底物传质,打碎气泡,提升气泡的停留时间,显著改善ABE 的汽提效率。此外,也有研究采用提升发酵液浓度,强化汽提分离并获得分相冷凝液的报道[35],采用间歇汽提与连续或补料分批发酵过程耦合,可将发酵罐中的ABE 浓度控制在高位,亦可实现在冷凝液中富集较高浓度的溶剂[33,36]。表3 汇总了近年来生物丁醇发酵耦合汽提的研究进展。
1.2 真空/闪蒸分离
真空/闪蒸分离的原理与减压蒸馏过程类似,通过构建减压体系,在发酵温度或较低温度下影响发酵醪液中溶剂的组分分压,从而促进液相内挥发性溶剂产物向气相传质。近年来,相关研究报道较少,主要原因是构建减压系统需要排出发酵产生的CO2、H2等气体,造成碳质底物代谢扰动,进而影响底物对溶剂转化效率[46]。此外,发酵罐或闪蒸罐的负压状态易造成发酵系统染菌,醪液中较低的ABE浓度导致冷凝液难以自然分相[47]。
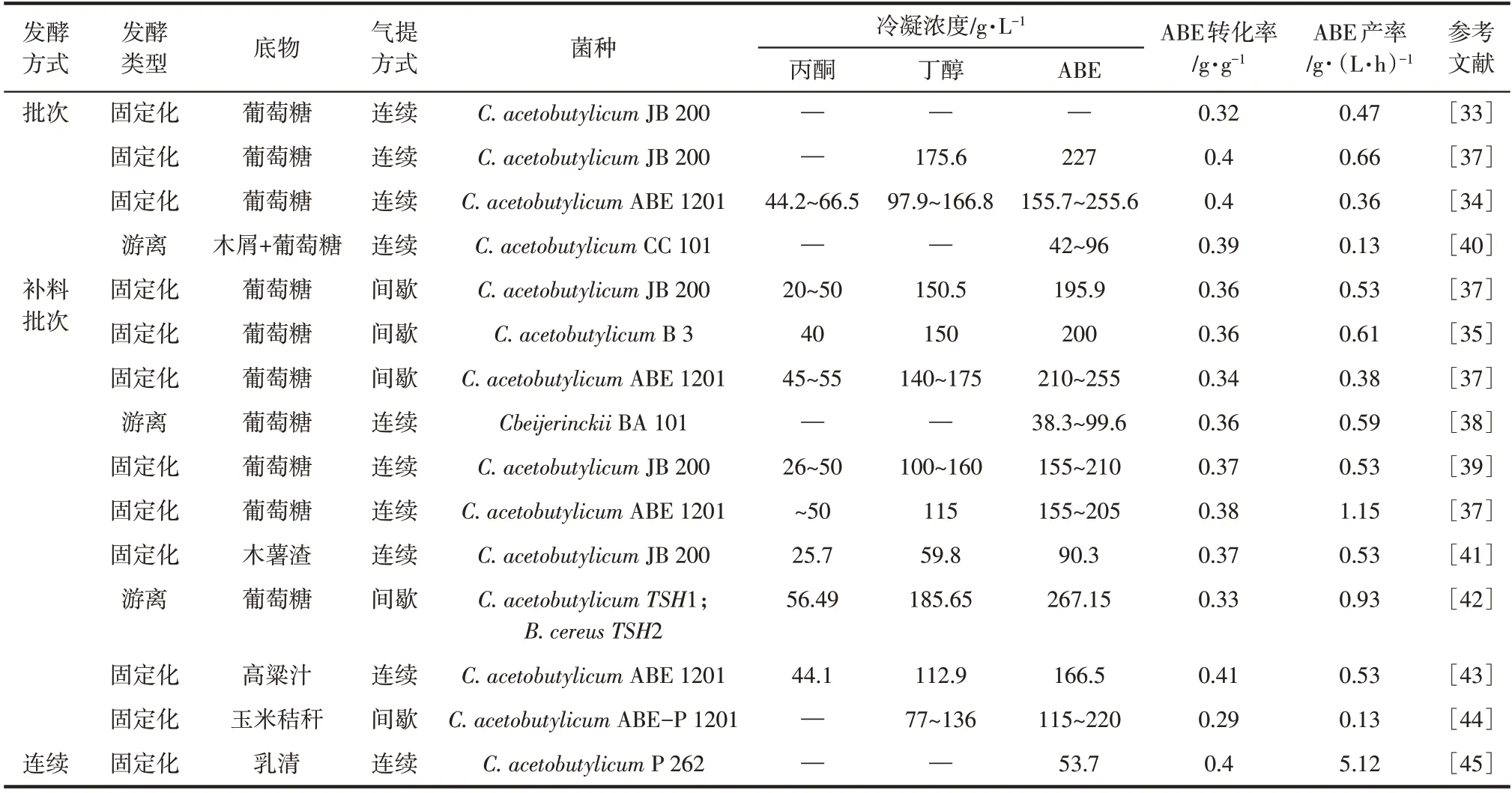
表3 生物丁醇发酵耦合汽提的研究进展
受制于上述原因,真空分离多以间歇形式与ABE过程耦合。例如,Mariano等[46]采用真空分离与批次发酵耦合,当采用连续真空分离时,糖底物对ABE转化率降至0.22g/g,仅为非耦合系统的62.9%,而采用间歇真空分离时,底物对ABE转化率可小幅提升,但也仅能达到非耦合过程的62%~83%。真空分离与ABE发酵耦合的优势在于可一定程度上降低溶剂的总分离能耗。相较于传统的“批次发酵-精馏”系统,通过“批次发酵-真空分离-精馏”,全工艺能耗理论上降低约18%[48]。Mariano 课题组[49-50]对“闪蒸-精馏”分离系统的评估表明,丁醇分离能耗较传统工艺降低39%,可达到17MJ/kg水平。
2 基于相转移的生物丁醇分离方法
尽管基于汽液平衡的生物丁醇分离方法操作相对简单,工艺易于实现,但受制于分离原理,存在ABE 溶剂分离效率较低的共性缺陷,导致分离能耗普遍较高[51-53]。相较而言,另一类生物丁醇方法,即根据ABE 发酵液中溶剂分子极性差异实现相转移分离,往往具有更高的溶剂选择性和分离效率,分离能耗相较汽液平衡分离更低。下面对近年来研究较多的主流技术领域进行综述。
2.1 吸附
吸附法分离ABE 发酵液中的生物丁醇已有较长的研发历史,被证明是一种分离能耗相对较低的生物丁醇分离方法。吸附法利用溶剂分子和水之间的极性差异以及溶剂官能团差异性,通过发酵液中溶剂分子与多孔材料表面间的物理和化学作用以及后续溶剂或加热洗脱吸附在固相介质上的溶剂实现分离。开发回收率高、富集能力强、丁醇选择性高、成本低的吸附剂是近年来该类研究的主要发展趋势。
Xue等[51]探究了商业活性炭吸附柱与ABE发酵系统耦合的可行性。发酵液流经活性炭柱后,含有较低浓度ABE 溶剂的滤出液回收至发酵罐中并补入新鲜培养基实现补料分批发酵。在解吸过程中,溶剂产物通过热空气吹扫脱附。因产物抑制显著降低,丁醇的产率较批次非耦合过程提升32%,回收溶剂中丁醇浓度达167g/L。也有研究采用磁性多孔碳吸附水溶液中的丁醇,分散在溶液中的吸附介质可通过磁场回收,丁醇回收率达93%[52]。Shu 等[53]采用聚丙烯酰胺修饰的PDMS海绵吸附ABE发酵液中的丁醇,并与批次发酵耦合,相比传统批次发酵,耦合系统内丁醇产量提升102%。此外,吸附-解析过程效率与吸附柱空间结构和传质有关。研究表明,在金属骨架上原位生长的Silicalite-1比散堆吸附填料平衡时间更短,在解吸后可获得88.5%的ABE 回收效率[54-55]。也有研究采用膨胀床分离补料批次发酵液中的ABE溶剂产物[56],之后利用真空解吸疏水树脂Dowex Optipore L-493 上的溶剂并实现膨胀床再生,净生产ABE 40.7g/L,较传统方法提升2.3倍。
采用吸附法分离生物丁醇的问题主要有两方面,一是ABE 发酵液中的杂质污染吸附介质,造成吸附材料再生困难,影响吸附材料使用寿命;二是发酵液中的副产物,除丙酮、乙醇外,有机酸、残糖等与目标产物丁醇存在竞争性吸附,导致实际分离效率降低[57-58]。吸附材料对丁醇的选择性主要由材料结构特性决定[59]。因此,选择高丁醇亲和性及选择性的吸附载体尤为关键[60]。Lin 等评价了不同类型大孔吸附树脂的丁醇吸附动力学[61-63],并利用筛选出的KA-I 树脂与丙酮丁醇梭菌膜生物反应器内的发酵过程耦合,发酵溶剂产物浓度和产率分别提升了4~6倍和3~5倍[64]。
2.2 液液萃取
生物丁醇的液液萃取过程和吸附过程类似,利用ABE在有机相萃取剂中的溶解度不同实现分离,萃取剂经回收后可重复利用[65-66]。相比其他分离方法,液液萃取过程的最大优势在于ABE 萃取剂容量大、丁醇选择性好、分离能耗低。液液萃取对ABE 的分离效率取决于萃取剂的物化性质。因此,开发高溶剂选择性、高分配系数、不乳化、无毒的廉价萃取剂是相关研究的主要目标[67-68]。在既往研究中,对不同溶剂分离ABE 的性能进行了评价。结果表明,油醇因具有较高分配系数和低毒性,将其用作丁醇萃取剂进行萃取发酵时,可显著降低丁醇的产物抑制,提升发酵强度[69-71]。然而,油醇萃取的问题在于萃取剂成本偏高且回收能耗较大,产物分离不完全。为进一步提高萃取效率,可采用油醇与苯甲酸苄酯、正癸醇等有机物制备复合萃取剂[72-75]。例如,在应用正癸醇-油醇复合萃取时,萃取剂毒性对生物丁醇产生抑制,但当调节耦合系统pH至4.5后,萃取剂的毒性相对较低。在最优条件下,含20%正癸醇的复合萃取剂与ABE 发酵耦合,丁醇代谢可提升72%[75]。此外,生物柴油等可再生溶剂也可用作丁醇的萃取剂[76]。一般而言,低细胞毒性萃取剂用于原位ABE 分离时,可显著提升生物丁醇生产的连续性。例如,采用超临界CO2萃取发酵液中丁醇,丁醇最高分离浓度为573.2g/L,丁醇选择性可达204.8[77]。
除传统萃取剂外,离子液体也被视为有效的ABE 萃取剂[79-80]。虽然离子液体萃取面临成本较高、生物相容性较差等问题[81-82],但由于溶剂蒸汽压极低,离子液体萃取剂具有回收能耗相对较低的优势。离子液体对生物丁醇的萃取效率和选择性主要取决于极性。例如,基于[Tf2N]-的离子液体(如[Omin][Tf2N])具有较高的丁醇分离效率,丁醇的选择性和分配系数分别可达132 和1.939,丁醇萃取率74%[82]。最新研究表明,由氢键受体和氢键供体组成的低共熔溶剂表现出较高的经济可行性和生物相容性,可作为潜在的ABE萃取剂替代品[83-84]。
2.3 浊点萃取
含有亲-疏水基团的表面活性剂可用于ABE的分离。在浊点萃取过程中,向生物反应器中加入非离子表面活性剂可提高溶剂与微生物的生物相容性[85]。表面活性剂在低温下溶于水溶液,当溶液温度高于浊点时,表面活性剂会聚集并形成胶束[86],在富表面活性剂相中实现丁醇分离。虽然浊点萃取的选择性往往低于其他分离技术,但该技术在降低木质纤维素水解物和产物毒性方面表现出明显优势[87]。Dhamole 等[86]比较了非离子表面活性剂Triton X114、L62LF、L61 和L62 的分离性能。将L62 表面活性剂用作萃取剂时,正丁醇可浓缩6倍。萃取后,表面活性剂相中的生物丁醇可在120~130℃下通过蒸发分离[88]。
2.4 盐析
向ABE 发酵液中加入无机盐,可提高水溶液对有机溶剂产物的排斥作用[89]。随着无机盐的加入,ABE 分子从水溶液中分离出来,形成双相体系[90]。传统盐析过程需要无机盐与萃取剂共同参与,才可将ABE溶剂萃取至有机相中。相比之下,无萃取剂辅助的盐析过程无需额外添加有机物,可有效降低萃取剂回收能耗及潜在的环境危害[91]。盐的析出效率取决于无机盐的水化效应,因此优选水相溶解度高、稳定性强的盐析剂。目前主要使用常温水相溶解度较高的钾盐(如K2CO3、K2HPO4、KH2PO4、K3PO4和K4P2O7)[92-93]。
由于ABE 发酵产物中的低浓度溶剂在水相中具有较好的溶解性,因此仅当发酵液中盐浓度达到较高水平时才会出现分相[90]。盐析法分离ABE的问题较为突出,除不易实现发酵-分离耦合外,无机盐的加入量大、易造成设备腐蚀、成本高且回收困难。除传统无机盐外,已有研究采用高浓度碳水化合物(如糖类化合物等)分离溶剂产物[94]。然而,糖脱除过程同样面临糖回收率低、残糖无法回收利用等技术局限。此外,尽管盐析的有机相可获得100%的生物丁醇回收率,但盐析对水溶性更好的乙醇、丙酮副产物的分离效率比丁醇低[95-97]。因此,ABE 萃取不完全及盐回收能耗大限制了该技术的实际应用[98-99]。据估算,采用NaCl 进行盐析后,生物丁醇的下游纯化过程费用高达1.84 USD/kg[100]。
3 生物丁醇膜分离技术
3.1 渗透汽化
渗透汽化是指料液中的待分离组分溶解进入膜材料,并在组分两侧蒸汽分压差(料液侧-渗余侧)推动下扩散通过膜,在渗余侧汽化并被收集的过程。渗透汽化技术基于膜材料与待分离组分间的亲和性差异,实现料液组分的选择性分离。相比传统分离技术,渗透汽化过程无需引入其他物质,可在微生物发酵温度下进行,因而适于与发酵系统耦合以实现丁醇的原位分离。Li 等[101]指出ABE 批次发酵耦合渗透汽化分离工艺相较于批次发酵工艺溶剂产率可提高21%,而在连续发酵过程中的溶剂产率可提升81%。此外,相比传统精馏,渗透汽化过程所需能耗较低,可节能约50%[102]。然而,目前将渗透汽化技术用于分离发酵液中丁醇时仍面临一些问题。首先,渗透汽化技术的核心是渗透汽化膜,而当前研究最广的聚二甲基硅氧烷(PDMS)膜虽可将发酵液中丁醇富集至140~180g/L(表4),但从整体工艺能耗考量,仍有待进一步开发高选择性、高通量的渗透汽化膜。
尽管无机膜具有通量高,但对丁醇选择性较差,而聚合物膜具有选择性优异但通量低的不足。因此,通常采用有机无机共混策略制备混合基质膜,使其兼具有机膜和无机膜的优点同时克服两者的不足(图1)。目前多采用以下策略制备混合基质。①向基膜中引入多孔疏水材料,提高渗透汽化膜对丁醇的溶解吸附能力及扩散能力。例如,Mao 等[112]向PDMS 中引入2D 的金属骨架有机化合物(ZIF-L),该混合基质膜在40℃下分离1.0%丁醇水溶液时表现出优异的分离性能,分离因子和渗透通量分别为57.6 和407g/(m2·h)。②由于多孔疏水无机材料与聚合物PDMS 共混时存在相容性差、填充量小的问题,可在多孔疏水材料表面接枝活性基团,从而改善两者的相容性。例如,Hu等[113]在制备Silicate-1/PDMS 混合基质膜过程中,利用甲氧基可与PDMS 反应形成交联结构,不仅可以极大减少PDMS 与Silicate-1 之间形成的非选择性缺陷孔,同时可改善Silicate-1 的分布、提高填充量(63%)。

图1 渗透汽化膜分离丁醇性能

表4 近年来利用渗透汽化技术原位分离ABE的研究进展及对比(以合成培养基为底物)
在基于大分子聚合物的渗透汽化膜成膜过程中,通常使用大量易燃易爆的有机溶剂,膜固化需在室温下挥发掉大量有机溶剂后在高温环境下进行[图2(a)],至少需要数小时才能完全固化[114]。因此,膜生产效率低、成本高等瓶颈导致传统方法聚合的渗透汽化膜难以满足规模化需求。针对上述困难,研究人员主要着眼于以下几个方面进行探索。①针对溶剂大量使用,Li等[115]开发了绿色成膜技术,该技术革除了有机溶剂的使用,通过向铸膜液体系中直接引入水,促进二月桂酸二丁基锡的水解,实现铸膜液的交联固化。②针对无法连续生产的问题,Li等[114]提出了分段调控策略,通过降低涂覆前铸膜液温度、减少铸膜液中水用量、向铸膜液中添加乙醇等延长铸膜液的可涂覆时间,采用升高涂覆后铸膜液温度、增加催化剂用量等促进涂覆后铸膜液的固化;采用上述策略后,PDMS铸膜液的可涂覆时间可达88.3min;PDMS 膜的可收卷时间缩短至11min。Fan 等[116]则提出了同步喷涂、固化策略,通过高压装置将PDMS和交联剂的乙醇溶液交替喷涂在支撑层表面并通过红外灯加热使薄层迅速固化,在2.6min内实现PDMS膜制备[图2(b)]。Si等[117]对端羟基PDMS进行改性,使其接枝紫外光响应型基团(丙烯酸酯),涂层可在紫外光下30s 内完成固化[图2(c)]。相比传统端羟基PDMS制备的渗透汽化膜,使用丙烯酸酯改性PDMS制备的渗透汽化膜表现出优异的丁醇分离性能,相比前者,丁醇选择性提高了9.3%,而渗透通量仅略低于前者。
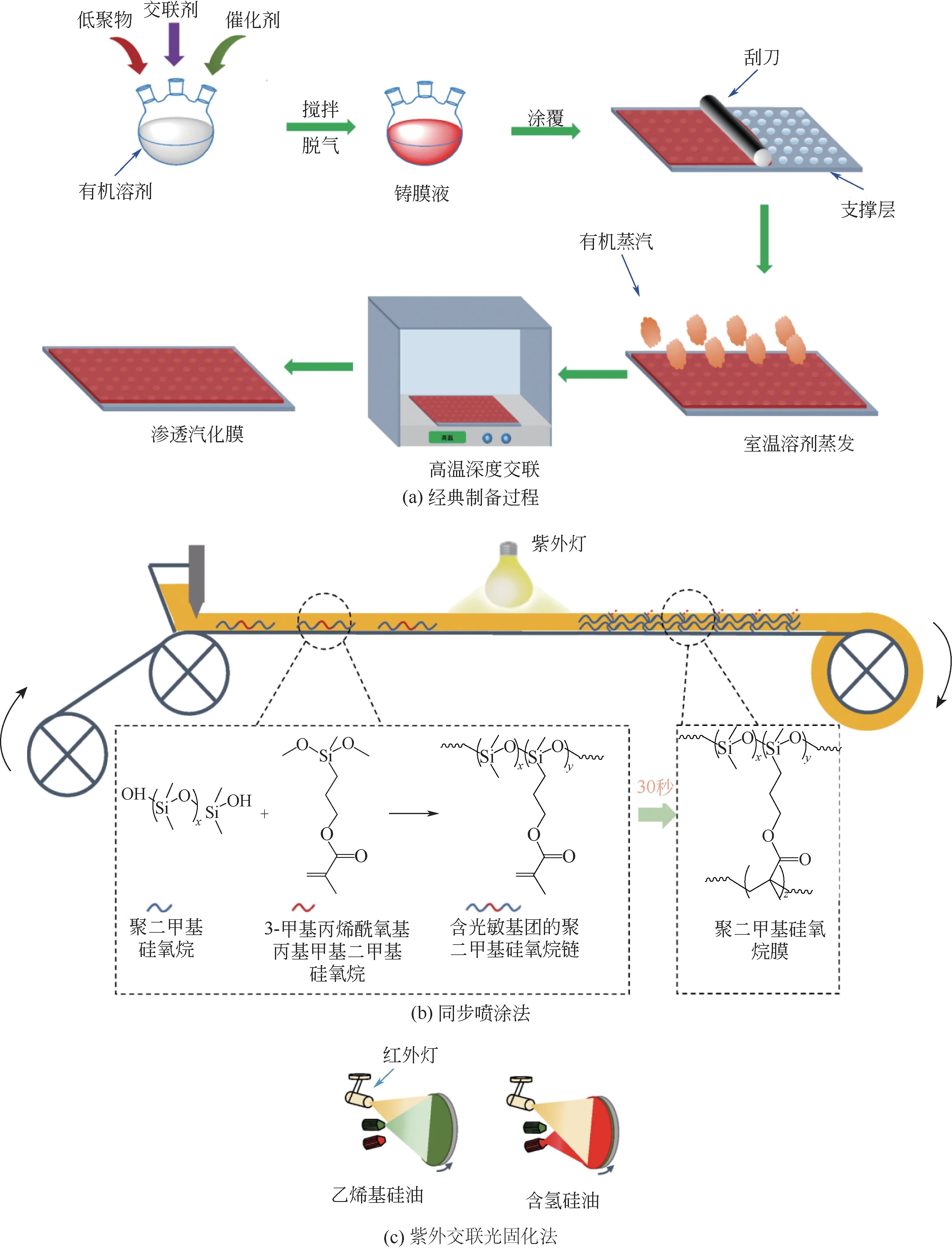
图2 PDMS渗透汽化膜的制备过程
当疏水渗透汽化膜与ABE 发酵耦合时,由于发酵液中成分复杂,悬浮颗粒及微生物菌体易于在PDMS膜表面沉积、生长,进而导致膜分离性能下降、膜使用寿命缩短等问题。针对上述问题,Zhu等[118]采用氟硅烷与PDMS反应构建具有低表面自由能的活性层表面,可有效缓解膜表面的生物粘附。此外,由于部分MOFs 类材料在酸性环境下不稳定,以MOFs 材料添加制备的PDMS 混合基质膜用于分离发酵液时,受发酵液中乙酸、丁酸等有机酸的影响,长期分离时膜性能损失较大[119]。为解决上述问题,Si 等将ZIF-8 煅烧后,将碳化ZIF-8 填充于PDMS膜;该膜在分离ABE发酵液时表现出良好的稳定性[119]。
3.2 渗透萃取
渗透萃取是一种特殊的萃取技术,该技术基于膜分离和液液萃取,膜上游侧与发酵液接触,下游侧与萃取剂接触。在渗透萃取过程中,发酵液中的挥发性有机物溶解、扩散通过膜,为下游侧萃取剂所萃取,从而实现富集分离。该技术通过膜构建了发酵液和萃取剂的物理隔离,革除了萃取剂毒性对发酵液中微生物的影响。但是,膜的存在同时也降低了传质效率,使得产物收率较低。Qureshi等[120]采用硅橡胶膜/油醇萃取耦合ABE连续发酵策略,相较于批次发酵,ABE 浓度提升10.6 倍(由9.34g/L 至98.97g/L),ABE产率则达到0.27g/(L·h)。需要指出的是,由于渗透萃取过程中膜直接与发酵液中的微生物、悬浮颗粒等接触,因而易出现膜污染问题[121]。
3.3 膜蒸馏
膜蒸馏技术使用疏水微孔膜将发酵液与接收侧(液体或吹扫气体)分隔开来,由于表面张力作用,常压下液体无法透过微孔;在运行过程中,通过调节两侧温度,在蒸汽分压差推动下,挥发性产物的蒸汽则通过微孔扩散至接收侧。与其他膜分离技术相似,膜蒸馏过程中,无需向发酵液中引入新物质,从而避免了对微生物的影响。Gupta 等[122]将碳纳米管固定至聚四氟乙烯(PTFE)膜表面,将其用于分离ABE 水溶液,膜料液侧采用微波辅助加热,透过侧则采用气体吹扫方式收集。相比原始PTFE 膜蒸馏,采用上述策略在40℃下进行膜蒸馏时,丙酮、丁醇、乙醇的通量分别提高了100%、105%和375%。这是由于PTFE 表面的碳纳米管促进了上述有机物的吸附和扩散,同时,微波加热有助于在局部形成过热环境,破坏氢键连接的ABE-水簇,从而促进了有机物分子的逸出,提高了膜通量。
3.4 反渗透
在反渗透过程中,在发酵液侧施加一定压力,水分子沿着与自然渗透相反的方向进入另一侧的水中,而有机物、菌体、营养成分等则被膜所截留,从而实现有机物富集浓缩的目的。据Huang等[81]估算,反渗透过程所需能耗高于疏水渗透汽化,这是由于前者的运行压力远高于后者。需要指出的是,多数反渗透膜易溶于丙酮,因此在分离发酵液时膜结构会受到破坏,因而限制了其应用。Gautam等[123]提出可将反渗透技术用于提高木质纤维素原料水解液中糖浓度,经反渗透处理后,水解液中葡萄糖、木糖和阿拉伯糖等糖类的截留率均可达90%以上;然而,糠醛、5-羟甲基糠醛、乙酸等丁醇发酵抑制物的截留率也高于77%。
4 面向终产物的多级分离系统级联
虽然前几节介绍的分离技术可以实现发酵液中ABE 溶剂产物的原位脱除与浓缩,提高生物丁醇的生产强度和生产连续性,但第一步分离提浓结束后,尚需进行进一步提浓并级联后续精馏系统,才可实现终产物的制备与纯化,即获得丁醇、乙醇、丙酮纯溶剂。由于精馏技术的局限性(受制于ABE-水四元组分共沸),传统蒸馏所得溶剂浓度无法越过共沸组成。因而,后续产物精馏脱水环节的能耗和成本依旧较高。为解决这一问题,获得总浓度越过共沸组成的ABE 浓缩液,降低后续产物精馏精制过程能耗,近年来针对ABE 分离技术的研究除面向溶剂浓度较低的发酵醪液系统外,也有部分学者着眼于ABE 原位分离产物的进一步提纯脱水环节进行工艺开发和设计。
4.1 多级分离级联原位分离ABE溶剂
表5列举了近年来开发的多级原位分离级联纯化ABE 溶剂的方法。例如,采用萃取-汽提工艺,对液液萃取所得的有机相进行进一步气提提纯,可获得较高浓度的ABE 冷凝液[124-125]。然而,上述工艺虽然一定程度上降低了萃取剂回收的成本,但萃取剂依旧对产丁醇梭菌代谢有一定的毒性。在二级汽提过程中,第一阶段气提冷凝液的水相作为第二阶段气提的原料。最后,将第一段冷凝液的有机相与第二段冷凝液的有机相混合,可获得671.1g/L的ABE 溶液[126]。该级联分离系统继承了传统单级汽提过程细胞毒性低、操作简单等优势,同时一定程度上弥补了单级汽提工艺分离浓度低的问题。需指出的是,二级汽提工艺基于汽液平衡实现ABE 浓缩分离,因此最终所得ABE 溶剂浓度仍无法突破共沸溶剂浓度。

表5 多级分离级联原位ABE分离工艺的原理及对比
相比之下,基于二级渗透汽化的原位分离系统可以获得更高的溶剂产物浓度,其原因是渗透汽化基于溶剂在膜活性层的吸附-扩散-解析而实现分离[111]。然而,这一过程的缺陷在于,在第一级渗透汽化过程中,与单级渗透汽化相同,生物丁醇发酵液直接接触膜表面,导致渗透汽化膜存在膜污染等问题,膜的使用寿命受限。此外,有研究提出了渗透汽化-盐析和汽提-盐析工艺,针对ABE 原位分离浓缩液进行第二级盐析分离,这一过程极大地降低了传统面向低浓度发酵醪液直接盐析过程中的盐用量,因而降低了盐回收过程中水的蒸发能耗。该工艺的另一大优势在于规避了传统盐析工艺只适用于离线ABE 分离的问题,而相比于其他分离技术,在第二级溶剂分离过程中,盐析的溶剂分离效率更高,操作也相对简单[127-128]。
除上述方法外,也可采用汽提-渗透汽化级联分离工艺[129-130]。该工艺选择性高,同时克服了汽提选择性低和渗透汽化存在膜污染的问题。然而,汽提-渗透汽化工艺的局限性是需要重新加热第一级分离得到的ABE 冷凝液,以进行第二级分离。因此,这一过程需要额外消耗能量。为解决这一问题,可对汽提-渗透汽化二级分离系统进行进一步整合,即形成汽提渗透(GSVP)[又称蒸汽渗透(VSVP)]分离模块[131-132]。在该过程中,汽提回收的气体直接进入渗透汽化膜组件。就工艺装置而言,传统渗透汽化与GSVP过程的唯一不同是,在GSVP过程中,通过载气分散在气体中的ABE在疏水膜表面溶解并扩散至透过侧,而在常规渗透汽化过程中,水溶液中的ABE为疏水膜所分离(图3)。因此,理论上GSVP过程中仅有水和挥发性产物与膜接触,革除了传统渗透汽化的膜污染问题[133]。然而,由于汽提回收气体中丙酮和乙醇等副产物占据相当高的分压,利用GSVP技术原位分离ABE溶剂时,其效率远低于汽提-渗透汽化过程(GSVP仅可将ABE富集至330g/L左右,而汽提-渗透汽化则可富集至约660g/L)[130,134]。
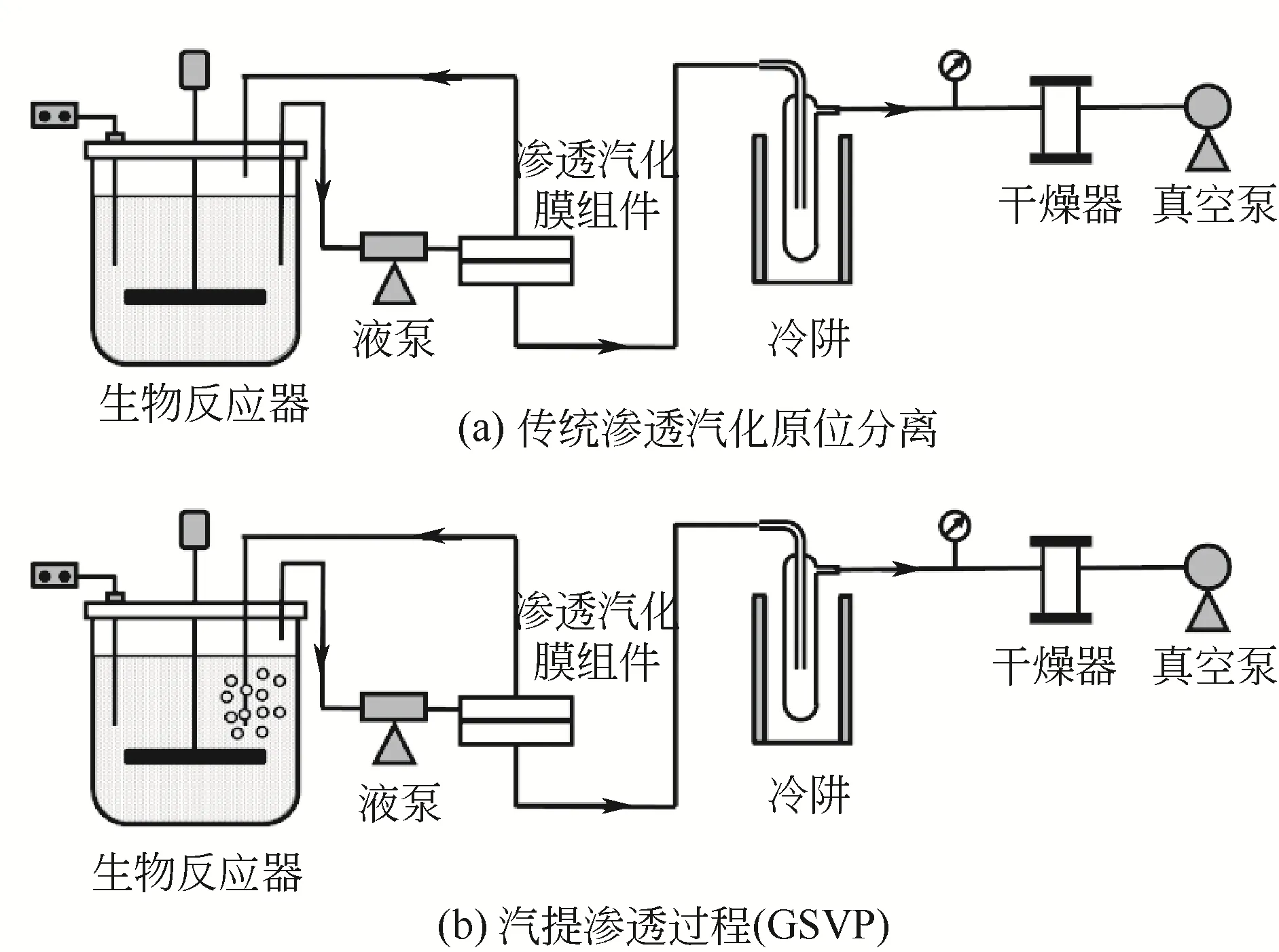
图3 传统渗透汽化原位分离和汽提渗透过程(GSVP)的工艺流程对比
虽然许多文献对多级分离级联的节能效果进行了讨论,但多数研究仅进行了定性分析,对多级分离级联的定量描述报道不多。Cai 等[129]比较了单级汽提和汽提-渗透汽化过程的能耗。结果表明,与单级汽提相比,包含二级分离级联系统的发酵-分离工艺整体能耗节省了1.37MJ/kg,这主要得益于两段分离后的ABE 浓度较高,更少量的水进入下游精馏系统。
4.2 终产物精馏
精馏是最传统的生物丁醇分离手段之一,ABE可以通过沸点差异逐一分离。然而,由于ABE 发酵溶剂产物浓度低,直接利用精馏分离ABE 发酵液能耗极高,丁醇分离效率也因受共沸物影响而偏低[135-136]。正丁醇/水二元混合物的汽液平衡如图4(a)所示,其中x 为液相正丁醇质量分数,y 为气相正丁醇质量分数[137]。如前所述,由于正丁醇在水中的溶解度偏低,在高浓度下可实现分相[32]。前人基于此提出双塔-分相器精馏(TCD)系统,在无萃取剂的情况下即可生产无水生物丁醇[135,137][图4(b)]。TCD 系统与其他蒸馏塔组合在一起,形成精馏序列,一般按溶剂产物沸点的升序/降序分离ABE 发酵液中的低挥发性副产物丙酮、乙醇。
图4(c)是基于产物沸点逐步升高的ABE精馏序列[139-142]。该类精馏序列的优势在于适用性强,除直接用于ABE 发酵液分离外,也可用于原位分离得到的ABE 浓缩液[129]。虽然此类精馏序列在文献和实际应用中报道较多,但存在一些技术瓶颈。例如,由于ABE 产物中的乙醇比例较低,导致该序列中乙醇塔热负荷高。受制于乙醇-水共沸,乙醇塔顶采出浓度偏低,仅有80%水平。该序列的另一类问题是乙醇塔釜中的痕量乙醇流入TCD系统,由于沸点较低,乙醇会逐渐积累在丁醇塔和脱水塔塔顶无法排出,导致分离效率下降,精馏系统稳定性低。通过构建新的精馏序列可有效解决上述问题。Chen 等[129]提出将TCD 系统中的回流分相器物流导入乙醇塔中部,形成“乙醇塔-丁醇塔-分相器-脱水塔”闭合循环(E-TCD)系统[图4(d)]。该系统不但避免了痕量乙醇在丁醇塔、脱水塔中的积累,同时由于乙醇塔热负荷降低,可在乙醇塔顶分离得到95%的乙醇产品,在进一步优化压差精馏和系统换热后,基于E-TCD 的精馏序列相比传统的基于TCD 的精馏序列对ABE 原位汽提冷凝液的分离能耗可降低17.5%[129]。
按沸点由高到低的顺序依次分离ABE 的精馏序列比较复杂。但对于原位分离得到的ABE 浓缩液的精馏而言,由于浓缩液溶剂浓度较高,部分研究将传统序列中的分相器前置,即在提浓塔之前分离有机相和水相,之后通过脱水塔和丁醇塔进一步对水相和油相浓缩脱水,浓缩产物重新混合后进入前置分相器[图4(e)][12,143]。
无论采取何种精馏序列,都需要投入多个塔器才能实现ABE 的有效分离,这无疑增加了工艺分离复杂性和设备成本。近年来,有研究在构建塔器间热耦合系统基础上[145-146],提出采用间壁塔替代传统精馏序列中的部分塔器。间壁塔采用热耦合塔器拓扑结构[147-148]。例如,Patraşcu 等[149]提出了面向ABE 汽提冷凝液的基于单间壁塔分离序列。在此过程中,通过丙酮-乙醇塔、分相器和闪蒸罐的辅助,可以实现丙酮、乙醇、正丁醇和水的分离[图4(f)]。然而,目前多数研究仅能实现通过构建单间壁塔替代传统序列中的两个精馏塔,能量和成本收益相对较少。同时,间壁塔相对普通塔而言控制难度增大,尚无搭建实物样机进行实际应用的报道。
利用萃取精馏实现ABE精馏的强化报道较多,也更容易实现。其过程为液液萃取后的萃取液导入精馏塔完成溶剂产物分离和萃取剂回收,由于萃取液中水含量少,因此水的相变能耗可大幅降低。近年来提出了多种萃取精馏序列,与常规不添加萃取剂的普通精馏过程相比,有报道指出萃取精馏分离ABE 的能量成本可降低约75%[150]。Kraemer 等[151]使用三甲基甲苯作为热集成萃取剂,理论上生物丁醇的分离能耗可以降低至4.8MJ/kg。Dìaz 和Tost[152]设计了类似的萃取蒸馏序列,精馏分离ABE 的总能耗可维持在6.4~8.3MJ/kg。由于萃取剂的理化性质存在差异,萃取剂类型对精馏成本影响较大。Ave和Adams[153]比较了8 种萃取剂(包括4 种有毒萃取剂和4种无毒萃取剂)对ABE精馏的影响。为进一步强化精馏过程,有研究整合间壁塔和萃取精馏系统,利用间壁塔进行萃取精馏时,较非传统塔器萃取精馏工艺的经济性和环境效益可望分别提升22%和18%[154]。

图4 面向ABE分离的精馏系统
5 展望
除面向解决生物质糖化与生物转化的固有瓶颈外,对生物丁醇分离技术领域的研究日益深入,大量基于汽液平衡、相转移、膜分离技术等的新型分离方式涌现。然而,受制于整体工艺路线的经济局限性,目前还鲜有将这些新型分离技术应用于实际生产中的实例。一些对生物丁醇新型分离技术的探索因放大效应和规模化应用难度限制尚无法最终走向市场应用。
另一方面,未来面向生物丁醇分离的研究离不开对上下游工艺路线的整体考量和对生物炼制系统集成性的宏观把握。探索与上下游生物炼制路线深度整合的高效分离系统是目前研究的趋势和热点。例如,面向纤维基生物丁醇制备路线有机废水减排,有报道提出将渗透汽化离线分离后的渗余侧含酸的脱ABE 醪液作为纤维糖化缓冲液实现废水循环利用,废水减排可望在86%以上[155]。针对ABE发酵废水COD 高的问题,Cai 等[156-158]提出在批次ABE 发酵后期利用无菌空气作为载气,通过汽提分离挥发性溶剂产物,同时向生物反应器内接入好氧产油微生物。在此过程中,厌氧的产丁醇梭菌因发酵液溶氧提升而灭活,发酵副产物乙酸、丁酸等有机酸被产油微生物代谢为微生物油脂。发酵废水的COD 因有机物被产油微生物固定和转化而显著降低。木质纤维素生物转化丁醇过程中,一大难点是纤维素糖化过程中产生大量呋喃化合物,抑制梭菌代谢进而影响糖底物对溶剂的转化率。为解除糠醛对发酵的抑制,有报道提出了“一膜多用”的策略整体提升ABE发酵-分离性能。该方案首先利用疏水性渗透汽化膜分离木质纤维素水解液中的糠醛,之后利用渗透汽化脱毒后的纤维水解液完成丁醇发酵,进而继续利用该渗透汽化膜完成ABE 溶剂的浓缩和分离[133,159]。
发酵底物成本高而产物附加值低一直是生物丁醇发酵经济可行性的主要制约因素。为提升生物丁醇过程的整体经济性,另一研究趋势是将ABE 生物催化过程进一步与下游的化学或生物催化过程级联,制备高密度、高热值替代燃料或高附加值精细化学品。在此过程中,丁醇的分离往往起到“承上启下”的作用。既要实现ABE 的高效分离,也要保证分离出的溶剂产品能够满足下游催化提质工艺的需要。例如,利用ABE 脱水溶剂制备中长链烃的提质工艺中,丙酮作为醇醛缩合的桥接分子在化学催化剂的作用下与丁醇或乙醇聚合,之后通过催化加氢脱氧得到目的产物[160-162]。显然,采用传统精馏过程实现ABE 发酵与催化的衔接相对繁琐。相比之下,通过萃取、盐析或二级汽提-渗透汽化获取的高浓度ABE 混合物直接进行化学催化不仅工艺过程简单,同时更加高效节能[163-165]。在面向精细化学品的制备方面,Chen 等[166-168]报道了利用汽提或渗透汽化原位分离得到的ABE 浓缩液与油酸反应,在全细胞催化剂催化酯化下,制备油酸丁酯和油酸乙酯的混合物。油酸在此过程中作为反应底物,而反应获得的油酸酯作为ABE 溶剂的萃取剂。因此,从上下游工艺过程角度分析,该“反应-萃取精馏”过程不仅可以获得更高附加值的酯类化合物,同时可显著降低溶剂的下游分离成本。
一些研究对发酵-渗透汽化分离耦合过程进行动力学建模和描述,并进行耦合过程的动态优化[169]。Lim等[170]对ABE发酵的离线吸附过程进行动力学建模,并指导发酵生产,在最优条件下丁醇产率提升1.21倍,底物糖成本降低1.67倍。Dìaz等[171]对生物丁醇的真空分离耦合过程进行建模。并将模型用于选择最优生产策略,以确定并行反应器操作对热泵系统规模的影响。然而,目前的多数研究尚停留在提升ABE 发酵过程产物产率和底物转化率的宏观表征上,而欠缺在微观尺度上对耦合系统中细胞的碳质底物代谢强化原理分析。然而目前的发酵-分离耦合研究多局限于野生菌或突变菌为基础的工艺系统,而利用定向改造基因工程菌耦合系统的报道还不多,有待研究。
6 结语
本文重点综述了近年来面向生物丁醇高效分离的研究,对近年来出现的基于汽液平衡、相转移、膜分离等ABE 分离技术和相应的发展趋势进行总结。总体而言,开发低能耗、低毒性、高选择性的生物丁醇分离技术是该领域的主要研究方向。相比应用单一技术的生物丁醇分离,采用多级分离集成可以实现低能耗下更高浓度的产物富集,同时规避了不同类型分离技术固有不足。面向终产物脱水溶剂的分离,新型精馏系统主要面向原位分离得到的浓缩ABE-水四元混合物纯化。通过精馏序列的合理设计、物质流向的重新规划、热耦合技术和间壁塔的设计与应用,可显著降低传统产物精制过程的能耗和设备投资。除对不同分离技术和单元进行强化和持续改进外,目前的丁醇分离技术还逐渐向三个方面展开。一是与生物炼制系统深度融合,在固有的促进发酵和降低分离成本研究基础上,部分分离技术的引入可为生物炼制过程的减排提供助力。二是要面向生物丁醇的提质和转化。生物丁醇的分离不但需要兼顾溶剂分离效率,也要兼顾与下游催化转化过程的衔接,实现上下游流程整体效益的最大化。三是对发酵-分离过程进行系统梳理,对整体工艺流程的能量流、物质流强化,并根据分离工艺特点开发适用性强的生物催化剂。尽管现阶段生物丁醇的规模化制备依旧受制备成本高、传统和新型石化路线冲击等因素制约,但相信经过不断的工艺、技术改进和完善,特别是对分离技术的持续研究,生物丁醇产业发展的春天必将到来。
