立体选择性羰基还原酶及其在手性醇合成中的应用
2021-03-30张晓健刘倩柳志强郑裕国
张晓健,刘倩,柳志强,郑裕国
(1 浙江工业大学生物工程学院,手性生物制造国家地方联合工程研究中心,浙江杭州310014;2 浙江工业大学生物工程学院,浙江省生物有机合成重点实验室,浙江杭州310014)
立体选择性羰基还原酶(carbonyl reductase,EC 1.1.1.148)可在还原型辅酶烟酰胺腺嘌呤二核苷酸(磷酸)[NAD(P)H]存在的情况下,催化手性酮不对称还原得到手性醇[1]。手性醇含有一个手性羟基官能团,是有机合成中重要的手性砌块,广泛应用于医药中间体、精细化工等领域[2-3]。传统的手性醇合成需要昂贵的手性贵金属催化剂、严苛的反应条件、易燃易爆的硼氢化物还原剂,且具有产物光学纯度低、分离纯化工艺复杂、“三废”处理困难、生产成本居高不下等缺点。立体选择性羰基还原酶催化的羰基不对称还原反应具有酶来源广泛、活性与立体选择性突出、反应条件温和、产物光学纯度高、生产成本低廉、环境友好等突出优势,在手性醇的合成中应用前景广阔。近年来,立体选择性羰基还原酶的筛选、改造与应用研究备受各界重视并不断取得进展,有力地推动了手性医药中间体与精细化学品绿色制造领域的发展。
1 羰基还原酶的发现与分类
1.1 羰基还原酶的筛选
羰基还原酶广泛存在于细菌、真菌与动植物体内,种类与数量众多,来源广泛。因微生物易于获得、生长周期短且具有丰富的多样性,科学家常直接从环境样品,如土壤、海水等中筛选含羰基还原酶的微生物,并进一步分离、鉴定,获得对应的羰基还原酶。酿酒酵母、克鲁维酵母、假丝酵母、毕赤酵母、不动杆菌、假单胞菌、乳酸杆菌等细菌或真菌来源的羰基还原酶已得到分离、鉴定,并应用于手性醇产品的不对称合成。Chen等[4]开发了一种改进的手性高效液相色谱酶活性分析方法,成功分离出了一株能够将2-苯甲酰胺基1-3-氧代丁酸酯还原为(2S,3R)-甲基-2-苯甲酰胺基甲基1-3-羟基丁酸酯的含羰基还原酶新菌株Burkholderia gladioli ZJB-12126。Luo 等[5]克隆并表达了来自黏红酵母R.glutinis XP1463的羰基还原酶CaAKR和来自乳酸克鲁维酵母K. lactis XP1461 的KlAKR,催化6-氰基-(5R)-羟基-3-羰基己酸叔丁酯的不对称还原,e.e.值均大于90%。
传统从环境样品中筛选含酶微生物的方法往往工作效率低下,时间与经济成本高昂。近年来,随着DNA 测序技术、分子生物学等的快速发展,公共基因数据库的容量快速扩充,生物信息学分析与发掘技术日益成熟,从基因数据库中分析挖掘目的酶已成为发现新酶、新基因的主流技术。基因组狩猎是常用的生物信息学分析手段之一,可基于已知的酶/基因序列信息,对某种微生物的全基因组序列进行搜索、比对与分析,获得潜在的新酶/基因,对其进行克隆、表达与功能分析,即可获得所需新酶。多种新型羰基还原酶已经得到分析与鉴定。Kaluzna 等[6]利用酿酒酵母(S.cerevisiae)全基因组信息,成功获得18 种关键的羰基还原酶。Xu 等[7]通过分析Yarrowia lipolytica 基因组,获得羰基还原酶YlCR2,可催化3mol/L 的4-氯-3-羰基丁酸乙酯(COBE)不对称还原,制备产物(S)-CHBE,e.e.>99%。Chen 等[8]对唐菖蒲伯克霍尔德氏菌B.gladioli ZJB12126 和圆红冬孢酵母R. toruloides ZJB2014212 进行基因组狩猎分析,获得22 种新型羰基还原酶。
基因挖掘则是以已知酶/基因序列为探针,在含海量信息的DNA 数据库中进行搜索、比对,获得具有较高相似度的酶/基因,进行克隆、表达与活性测定,从而筛选获得所需要的酶[2]。Wang 等[9]将已知能催化4-氯乙酰乙酸乙酯生成(S)-4-氯-3-羟基丁酸乙酯的羰基还原酶序列作为出发序列,在GenBank数据库中进行BLAST,获得具有高活力与高选择性的羰基还原酶ScCR。Chen 等[10]以来自于L.brevis 的LbADH 为探针序列,根据序列、结构和功能的相互关系,从多个公共数据数据库(GenBank、SwissProt 和Brenda 等)中进行挖掘,获得立体选择性羰基还原酶RtSCR9,可用于度洛西汀手性中间体的生物合成。
1.2 羰基还原酶的分类
羰基还原酶是一类能够催化醇与醛/酮之间双向可逆氧化还原反应的酶类,需要辅酶NAD(H)或NADP(H)作为氢传递体[11]。目前羰基还原酶主要分布于三个超家族:短链脱氢酶/还原酶(short-chain dehydrogenase/reductases,SDRs)[12],中链脱氢酶/还原 酶 (medium-chain dehydrogenases/reductases,MDRs)[13]和 醛 酮 还 原 酶(aldo-ketoreductases,AKRs)[14]。虽然三者的催化功能相似,但在结构上差异较大。
1.2.1 短链脱氢酶
短链脱氢酶(SDRs)是一种非金属依赖酶,一般含有250~350 个氨基酸残基。自19 世纪70 年代发现昆虫乙醇脱氢酶和细菌核糖醇脱氢酶以来,短链脱氢酶数量不断扩充,目前GenBank数据库中收录的短链脱氢酶的数量已超过99000 种[15-16]。短链脱氢酶来源广泛,序列多样性高,自然界中25%的脱氢酶属于短链脱氢酶家族[17]。据辅酶结合域及催化活性位点的序列结构特征,科学家将短链脱氢酶 分 为“classical”“extended”“intermediate”“complex”“divergent”“atypical”和“unassigned”7 种,其中“classical”和“extended”是研究最清楚的两类短链脱氢酶[18-19]。虽然该家族成员的不同种类蛋白之间序列一致性较低(20%~30%),但其高级结构高度保守。短链脱氢酶通常以单体、二聚体、四聚体、八聚体或十聚体等同源多聚体的形式存在。每个亚基均由含有多条β折叠交替α螺旋的Rossman 折叠结构组成,底物结合区域位于C 端,辅酶结合区域位于N 末端[20],辅酶的类型[NAD(H)/NAD(P)H]由N 末端的GXXXGXG 下游20 个氨基酸左右的氨基酸残基决定,酸性氨基酸残基可特异性结合NAD(H)核糖环上2’和3’位羟基,碱性氨基酸残基则在与NADP(H)的结合中起重要作用[21],底物特异性由高变异区C 末端片段决定。Asn-Ser-Tyr-Lys 是SDRs 的催化四联体,Tyr 起着Lewis 酸/碱催化的作用,Lys 以及氧化型辅酶能降低Tyr 的pka值,推动羰基还原反应进行。Lys ε 位的氨基与辅酶核糖环上的羟基形成氢键,Ser 则与底物的羰基氧形成氢键,促进底物羰基的极化,利于还原反应发生。Asn 能形成一个特征螺旋扭结(helical kink),其羰基与Lys 周围的水分子结合并与Lys 形成氢键,激发Lys的活性(图1)[22-24]。
1.2.2 中链脱氢酶
中链脱氢酶(MDRs)是一类约含350 个氨基酸残基的锌或非锌-依赖型脱氢酶。根据迭代隐马尔可夫模型(HMMs),中链脱氢酶可分为86 类,包括MDR001-ADH、MDR002-PTGR、MDR003-FAS 及MDR010-CAD 等,不同种类间序列同源性在40%~90%之间。中链脱氢酶一般是以单聚体、二聚体或四聚体的形式存在。每个亚基含有两个结构部分[图2(a)][25],N端与C端共折叠区域形成一个裂缝结构,为活性中心口袋,辅酶结合域覆盖了包括Rossman 结构在内的C 端大部分区域[26-28]。细菌中的中链脱氢酶通常为非锌-依赖型,而真核生物中的中链脱氢酶一般为锌-依赖型[29-30]。锌离子有多种结合方式,有的辅酶结合域和活性中心均结合一个锌离子,有的只有活性中心结合一个锌离子,有的则不需要锌离子。中链脱氢酶的催化过程往往需要锌离子的参与,锌离子一般与Cys、His、Asp及一个水分子形成一个含羧基配体的四面体结构,参与酶与底物的结合过程[27]。中链脱氢酶催化醛酮还原的过程中,羰基底物首先进入活性中心,与活性中心His、Ser 和His 残基连接的Zn+及辅酶核糖环上的两个羟基作用稳定构象,接收来自还原型辅酶C4位上的[H],转化为对应的醇产物[图2(b)][28]。

图1 人类激素3-β-脱氢酶的结构示意图[19]及短链脱氢酶的催化机理[22]
1.2.3 醛酮还原酶
醛酮还原酶(AKRs)是一类含有320 个左右氨基酸的非金属依赖型羰基还原酶,广泛存在于动物、植物、原核生物中,并大多以单体形式存在[31-33]。目前其超家族成员超过190 个,分布于AKR1-AKR15 的15 个家族[34],每个家族成员之间的序列同一性大于40%。根据功能又可分为醛糖还原酶(aldose reductases)、醛还原酶(aldehyde reductases)以及羟类固醇脱氢酶(hydroxysteriod dehydrogenases)等。醛酮还原酶底物谱广,不仅参与内源性物质如糖醛、醛类脂以及酮前列腺素等的代谢,也可催化烷基、芳基醛酮、多环芳香族烃、黄曲霉毒素醛等外源性物质的代谢[35-40]。醛酮还原酶在功能上与短链脱氢酶类似,但三维结构与其差异较大。醛酮还原酶主要结构框架为(α/β)8桶状结构,又称TIM 结构,即中央由8 个β 折叠旋转交错排列,周围由8 个α 螺旋围绕,TIM 结构外围还存在H1 和H2 两条α 螺旋链[图3(a)][32,40-42]。醛酮还原酶的辅酶结合区域位于TIM结构中央,活性中心则位于TIM结构的C端及延伸出的三个高变异的loop 区。醛酮还原酶活性中心关键催化位点为Asp-Tyr-Lys-His。Tyr 起Lewis 酸/碱 催 化 作 用,Asp和Lys通过降低Tyr的pKa促进氢的传递,His与底物形成氢键[图3(b)][43-45]。

图2 来源于Thermus sp.ATN1的中链脱氢酶TADH三级结构示意图[27]及中链脱氢酶催化机理[28]
2 羰基还原酶立体选择性催化机制与分子改造
2.1 羰基还原酶催化立体选择催化机制

图3 家蚕醛酮还原酶AKR2E4的三级结构示意图[42]及醛酮还原酶不对称还原的原理[44]
立体选择性羰基还原酶遵循顺序Bi-Bi 动力学催化机制催化手性醇的合成,酶与辅酶NAD(P)H结合组成全酶,底物进入酶的活性中心,形成酶-底物复合体,底物获得辅酶传递的质子被还原为手性醇,NAD(P)H 失去质子被氧化为NAD(P)+,手性醇与NAD(P)+随后与酶分离,NAD(P)+可通过辅酶再生途径转化为NAD(P)H进入下一次催化反应[46]。由于底物酮的羰基C属于sp2杂化,呈平面结构,其平面前侧为re-面(re-face),后侧为si-面(si-face),如图4。辅酶NAD(P)H烟酰胺环C4上的[H]可通过4条途径传递给底物的羰基C,[H]传递途径取决于底物与酶结合的构象。当[H]以E1或E2的方式从底物羰基C 的si-面进攻时,反应遵循anti-Prelog 规则,获得(R)-醇;反之,当[H]以E3或E4途径从羰基C 的re-面进攻羰基C 时,反应遵循Prelog 规则,得到(S)-醇。此外,酶的类型与结构决定了辅酶烟酰胺环C4上的pro-(R)-H 还是pro-(S)-H 传递给底物。Martins等获得NADH依赖型(R)-2-羟基戊二酸脱氢酶(HGDH)的晶体结构,揭示该酶在催化2-酮戊二酸生成(R)-2-羟基戊二酸中的氢传递机理,NADH 烟酰胺环C4 上pro-(R)-H 进攻底物si-面,生成R型产物[23]。
2.2 羰基还原酶的分子改造

图4 NAD(P)H烟酰胺环上的[H]向底物羰基传递的立体化学途径示意图
从自然环境筛选或数据库挖掘获得的野生羰基还原酶活性、稳定性与选择性一般较差,不能满足高强度工业生产的要求。对野生羰基还原酶进行改造,提升酶在有机合成过程中的催化性能,尤其是对非天然底物的活性与选择性成为手性醇生物合成领域的关键。近年来,随着对羰基还原酶分类、结构与立体选择性催化机制研究的不断深入,羰基还原酶的底物通道、辅酶结合域、活性中心结构、酶-底构效关系、质子传递过程及分子热、动力学原理逐步得到揭示,对羰基还原酶的理性/半理性改造不断取得可喜进展。Wei 等[47]通过半理性设计提高了羰基还原酶AcCR 对11 种前手性底物的活性,获得了三个阳性双突变体(mut-E144A/G152 L、mut-G152 L/ Y189 N 和mut-I147 V/G152 L),这 些突变体缩短了底物与Tyr155 的羰基的氧原子之间的距离,比酶活提高了17~61 倍,催化效率(kcat/Km)也得到了明显的提高。Gong等[48]通过定向进化对来自Lactobacillus brevis 的天然酮还原酶LbCR 进行分子改造,获得了最佳突变体LbCRM8(M154I/A155D/V198I/A201D/A202L),40℃下半衰期增加了1944倍,催化效率提高了3.2倍,导致热稳定性提高是由于V198I/M154I/A155D的突变,酶活性增加是A201D/A202L 导致的。Honda 等[49]通过定向进化提高了来自于Ogataea minuta 的羰基还原酶OCR的稳定性,50℃时的半衰期得到了明显提高,酶稳定性的提高主要是由于V166A 的氨基酸取代。Qin等[50]以来自于Lactobacillus fermentum 的短链脱氢酶(LfSDR1)作为出发酶,确定了几种SDR酶序列中控制立体选择性的关键位置,这种方法应用于与LfSDR1具有21%~48%序列相似性的其他五种SDR酶,它们不对称还原的立体选择性也可以在Prelog和anti-Prelog之间切换,可以有效地提高酶的立体选择性。Zhang 等[51]通过分析晶体结构和多序列比对,确定了关键位点F25 和W113,通过对这两个位点定点突变进一步提高了醛酮还原酶YvgN 的催化活性和立体选择性。
3 羰基还原反应的辅酶再生
羰基还原酶为辅酶NAD(P)H 依赖型酶,其催化的手性醇制备过程需要辅酶参与。但外源辅酶价格昂贵,无法大量添加,细胞内的天然辅酶再生系统又无法满足高强度工业催化的需要,高效的辅酶再生技术成为手性醇生物合成的重要研究方向。目前主要的辅酶再生技术包括酶法、电化学法、光化学法和化学法等。酶促辅酶再生技术工艺简单、成本低廉,与羰基生物不对称还原过程相容性好,在羰基还原酶催化领域应用最为广泛。根据酶与底物偶联方式的不同,可将其分为“酶-偶联”法和“底物-偶联”法[52-55]。“酶-偶联”法即双酶双底物偶联法,需要脱氢酶以及辅底物参与氧化型辅酶NAD(P)+转化为还原型辅酶NAD(P)H,或将还原型辅酶转化成氧化型。目前已报道的脱氢酶包括甲酸脱氢酶(FDH)、葡萄糖-6-磷酸脱氢酶(GDPH)、葡萄糖脱氢酶(GDH)及醇脱氢酶(ADH)等。对应的辅底物分别为甲酸、葡萄糖-6-磷酸、葡萄糖、乙醇和异丙醇等(表1)。Liu 等[56]成功构建了羰基还原酶和葡萄糖脱氢酶共表达的重组大肠杆菌,在水-有机两相反应体系中催化4-氯-3-氧代丁酸乙酯(COBE)不对称还原,(S)-4-氯-羟基丁酸乙酯(S)-CHBE 的产率为97.2%,e.e.为99%。“底物-偶联”法即单酶双底物辅酶再生体系,与“酶-偶联”法相比较为简单,仅需一种羰基还原酶同时催化羰基不对称还原与辅酶再生,具有较高的催化效能,该技术常用的辅底物有异丙醇、乙醇等[55]。Zhang 等[57]利用来源于Lactobacillus kefiri 的羰基还原酶,构建酶-辅酶共固定化技术,以异丙醇为底物实现辅酶循环利用,催化(3R,5S)-6-氯-3,5-二羟基己酸叔丁酯的合成,底物浓度达200g/L,无需外源辅酶添加,固定化酶重复利用40 批次,各批次产物产率均大于96%,e.e.>99%。

表1 “酶-偶联”法辅底物再生体系
4 立体选择性羰基还原酶在手性醇医药中间体合成中的应用
4.1 降血脂药物
他汀类药物是3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,可通过抑制肝脏内胆固醇合成降低低密度脂蛋白胆固醇(LDL-C)浓度,是治疗高胆固醇血症的首要药物种类。阿托伐他汀钙是第三代全合成他汀药物,降血脂效果突出,在心脑血管疾病防治领域应用广泛,是目前唯一累积销售额超过1500 亿美元的处方药。6-氰基-(3R,5R)-二羟基己酸叔丁酯是生产阿托伐他汀钙的关键双手性醇中间体,构成阿托伐他汀钙的药效基团。由于其含有两个手性羟基中心、四个对映异构体,立体选择性构筑难度极大。传统的手性羟基合成方法是以硼氢化物为还原剂,利用手性过渡金属催化剂催化羰基不对称还原。该方法立体专一性不足,导致反应过程非对映诱导不充分、产物光学纯度低,且该反应存在需深低温等苛刻反应条件、硼氢化物易燃易爆、安全隐患大、硼化物废物处理困难、生产成本昂贵等突出问题。采用羰基还原酶顺序催化构建双手性羟基(如图5),代表了阿托伐他汀钙双手性醇中间体合成技术开发与应用的发展方向。
阿托伐他汀钙第一个手性羟基的构建是以4-氯-3-氧代丁酸乙酯(COBE)为原料,酶促不对称还原制备(S)-4-氯-羟基丁酸乙酯(S)-CHBE。Codexis 公司及其他研究团队[58-61]利用含羰基还原酶的假丝酵母、毕赤酵母、念珠菌等成功进行了(S)-CHBE 的不对称还原。Cai 等[62]描述了来自Candida albicans NADPH 依赖型山梨糖还原酶的生物催化过程,可将2.5mol/L 的COBE 转化为(S)-CHBE,产率为93.6%,e.e.为99.6%。Wang等[9]用含有来自于Streptomyces coelicolor 还原酶的E.coli BL21工程菌细胞催化合成(S)-CHBE,采用2-丙醇进行辅酶再生,3.6mol/L COBE 在水/甲苯双相系统反应22h,产率为93%,e.e.>99%。Luo 等[63]通过基因挖掘手段获得羰基还原酶BsCR,催化4-氯乙酸乙酯不对称还原,(S)-CHBE收率达到89.9%,e.e.>99%。最近,Yang 等[64]将来自Stenotrophomonas maltophilia 的SmADH31 与来自Bacillus subtilis 的葡萄糖脱氢酶共表达并催化合成(S)-CHBE,660g/L(4.0mol/L)的底物完全转化,产物e.e.>99%,时空产率达2664g/(L·d),显示了在(S)-CHBE 工业生产中的良好应用潜力。
6-氰基-(3R,5R)-二羟基己酸叔丁酯的第二个手性羟基是以(R)-6-氰基-3-羟基-5-羰基己酸叔丁酯(R-HN)为底物,利用羰基还原酶不对称还原构筑。Luo 等[5,65]从K.lactis XP1461中挖掘一株野生型醛酮还原酶KlAKR,催化R-HN 立体选择性还原,产物d.e.和e.e.值均大于99%。通过两轮位点饱和诱变,KlAKR 的催化效率(kcat/Km)提高了11.25 倍。基于来源于K. marxianus ZJB14056 的醛酮还原酶KmAKR 进行定向改造,获得突变酶KmAKRW297H/Y296W/K29H/Y28A/T63M,与GDH 构建辅酶再生耦联体系,可催化450g/L底物浓度7h完全转化,产物d.e.>99.5%,时空产率为1.24kg/(L·d)[66-68]。Gong 等[48]使 用1g/L LbCRM8和 葡 萄 糖 脱 氢 酶(BmGDH)共表达的冻干大肠杆菌细胞,6h 内催化300g/L R-HN完全转化,产物d.e.>99.5%,时空产率为1.05kg/(L·d)。Wu 等发现了来自于Acinetobacter baylyi ATCC 33305 的二酮还原酶(rDKR),能够立体选择性还原(3R,5S)-6-羟基-3,5-O-异亚丙基- 3,5-二羟基己酸酯,d.e.和e.e.均大于99.5%。为了使该酶可用于工业用途,以葡萄糖为共底物,可以在3h内完成转化,底物浓度为5g/L,产率为83.9%。进一步降低成本构建并优化了由重组DKR和葡萄糖脱氢酶组成的共表达体系,可以催化80g/L 的 底 物[69-71]。 He 等[72]利 用 来 源 于Lactobacillus kefir DSM 20587 的 醇 脱 氢 酶LkADH 催化6-氯-3,5-二氧代己酸叔丁酯(CDOH)到(S)-6-氯-3-羟基-5-羰基己酸叔丁酯[(S)-CHOH]的不对称还原,底物浓度为100g/L,产率达94%,e.e.>99.5%。
瑞舒伐他汀钙是新一代他汀药物,具有疗效显著、副作用小的突出优势,自上市以来临床应用迅速扩大,被誉为“超级他汀”。(3R,5S)-6-氯-3,5-二羟基己酸叔丁酯[(3R,5S)-CDHH)]是降血脂药物瑞舒伐他汀钙手性侧链合成的重要手性砌块。羰基还原酶催化(S)-6-氯-5-羟基-3-氧代己酸叔丁酯[(S)-CHOH]不对称还原合成(3R,5S)-CDHH 具有反应条件温和、立体选择性高等特点。Wu 等[73-74]从羰基还原酶RtSCR9 出发,通过随机突变和定点饱和突变获得突变体mut-Gln95As、mut-Ile144Lys和mut-Phe1156Gln,比酶活分别提高了2.47、4.00和2.26 倍,催化效率kcat/Km分别提高了1.93 倍、3.15 倍和1.97 倍。催化1mol/L(S)-CHOH 不对称还原,产率达98.9%,e.e.>99%,最高时空产率为542.83mmol/(L·h·g)湿细胞。在此基础上,Zheng等[75]在大肠杆菌工程菌中构建羰基还原酶-葡萄糖脱氢酶共表达体系,实现辅酶高效再生,并采用底物分批补料技术,总底物浓度达400g/L,反应12h,底物转化率达98.5%,产物e.e.值大于99%。
依泽替米贝(Ezetimibe)也称依折麦布,是首个β-内酰胺单环类的胆固醇吸收抑制药物[76],广泛应用于心脑血管疾病的治疗。(4S)-3-[(5S)-5-(4-氟苯基)-5-羟基戊酸]-4-苯基-1,3-唑烷-2-酮[(S)-ET-5]手性中间体的制备是合成依泽替米贝的关键步骤(图6)。Liu等[77]将Lactobacillus kefir 来源的羰基还原酶CR125在E.coli工程菌中异源过表达,在水-甲苯双相反应体系中对150g/L前体酮底物进行不对称还原合成(S)-ET-5,转化率99.1%,d.e.值大于99.9%。进一步构建羰基还原酶CR125-葡萄糖脱氢酶GDH 双酶共表达系统,通过对双酶催化体系优化,同时实现了羰基不对称还原与辅酶高效再生,底物浓度225g/L,辅底物葡萄糖浓度150g/L,反应12h,产物得率达98.9%,e.e.>99.9%,最高时空产率为24.7g/(L·d),为目前文献报道最高水平[78]。
4.2 碳青霉烯类抗生素

图5 阿托伐他汀双手性醇的酶法合成路线

图6 依泽替米贝关键手性中间体(S)-ET-5的酶法合成
新一代的β-内酰胺类抗生素青霉烯和碳青霉烯具有广泛的抗菌谱、突出的抗菌活性以及对大多数β-内酰胺酶的稳定性,被认为是治疗严重医院感染的“一线药物”。4-乙酰氧基氮杂环丁酮[(2R,3R)-3-(R)-1-(叔丁基二甲基甲硅烷基氧基)乙基-4-氧杂氮杂丁-2-基乙酸酯]是生产青霉烯和碳青霉烯的关键手性中间体,其中(R)-1,3-丁二醇[(R)-2]则是生产4-乙酰氧基氮杂环丁酮衍生物的关键前体物质[图7(a)]。(R)-2 的生物合成主要是通过不对称还原4-羟基-2-丁酮(1)制备。Matsuyama等[79]利 用 Candida parapsilosis IFO 1396 和Kluyveromyces lactis IFO 1267细胞还原前体酮1分别产生(R)-和(S)-2,e.e.分别为97%和99%。Yamamoto等[80]报道了一种来自C.parapsilosis 的新型(S)-特异性醇脱氢酶CpSADH,催化(R)-2 合成的产量达72.6g/L,e.e.为95%。此外,Zheng 等[81]分离获得C. krusei ZJB-09162 菌株,实现了酶催化1 不对称还原为(R)-2,底物浓度45.0g/L,转化率为83.9%,产物e.e.为99.0%。
(2S,3R)-2-苯甲酰胺甲基-3-羟基丁酸酯衍生物3a-3c[图7(b)]也是合成4-乙酰氧基氮杂环丁酮的关键中间体。传统的(2S,3R)-4a-4c 的制备是使用钌催化剂催化外消旋3a-3c的不对称拆分,反应成本昂贵,反应条件苛刻[82]。条件温和、反应成本低廉的酶促合成过程已有报道[83-84]。Rimoldi 等[85]使用P. glucozyma CBS 5766 和K. marxianus CBS 1553细胞以高产率和高立体选择性将3c 还原为4c,前者生成的(2R,3S)-4c具有>99%e.e.和70%d.e.,而后者提供催化制备的(2R,3R)-4c 具有高于99%的e.e.和88%的d.e.。Codexis公司利用来源于Lactobacillus brevis 的醇脱氢酶作为催化剂催化3a 合成(2S,3R)-4a,e.e.>99%,d.e.>89%[86]。Chen等[8]从Burkholderia gladioli鉴定一株新型羰基还原酶BgADH2,它可用于不对称合成(2S, 3R)-4a,e.e.为99%,d.e.为98.5%。
(R)-3-羟基硫杂环戊烷是碳青霉烯药物舒仑培南合成的关键中间体[87]。Codexis 公司针对来源于Lactobacillus kefir 的羰基还原酶ADH 进行蛋白质工程改造,获得系列突变体,对四氢噻吩-3-酮不对称还原的立体选择性大幅提升,产物(R)-3-羟基噻吩e.e.>99%。该工艺经放大至100kg 水平验证后,已应用于工业生产[88]。
4.3 抑郁症治疗药物

图7 4-乙酰氧基氮杂环丁酮手性中间体的生物催化制备工艺[84-85]
度洛西汀,化学名(S)-N-(+)-甲基-3-(1-萘氧基)-3-(2-噻吩基)-丙胺盐酸盐,是一种新型的抗抑郁药,为5-羟色胺和去甲肾上腺素再摄取的双重抑制剂,不仅可以治疗抑郁症,还可用于治疗压力性尿失禁、肥胖和糖尿病周围神经病性疼痛,对抑郁症伴发慢性疼痛也有一定的疗效。度洛西汀合成过程中,N,N-双甲基-3-酮-3-(2-噻吩基)-1-丙胺的还原反应是一个关键步骤。美国Eli Lilly 公司首先报道了由前体酮5a-5f 不对称还原制备(S)-度洛西汀手性醇中间体6a-6f 的化学合成技术[89](图8)。但该技术存在反应条件严苛、产物光学纯度低、产率低、生产成本居高不下等问题。利用羰基还原酶催化制备手性醇中间体6a-6f具有反应条件温和、产物光学纯度高、生产成本低廉等突出优点。Soni 等[90]筛选到了一株含羰基还原酶的Candida viswanathii,并应用于(S)-6b 的不对称合成,底物转化率达81%,产物e.e.>99%。Codexis公司开发羰基还原酶ADH 突变体,大幅提升不对称还原制备(S)-6a的活性,进一步采用异丙醇为辅底物实现NAD(P)H 再生,底物5a 浓度达150g/L,产物 产 率 大 于90%, e. e. >99%[91]。 Wang 等[92]从Candida albicans XP1463 (CCTCC M 2014382) 中鉴定一株醛酮还原酶CaAKR,对度洛西汀中间体的催化活性高达160U/mg,产物e.e.值>99%。Chen等[10]筛选获得一株来源于R. toruloides 的羰基还原酶,利用葡萄糖构建辅酶再生体系,底物5a 浓度为100g/L,转化率100%,产物e.e.值>99%。
贝氟沙通(Befloxatone),化学名5(R)-(甲氧甲基)-3-[4-[4,4,4-三氟基-3(R)-羟基丁氧基]苯基]-2-唑烷酮,是一种唑烷酮衍生物,可选择竞争性抑制人体内单胺氧化A(MAO-A),阻止脑内5-羟色胺和去甲肾上腺素降解,同时增加脑内突触间隙5-羟色胺和去甲肾上腺素的浓度,起到强效抗抑郁作用[93]。4,4,4-三氟乙酰乙酸乙酯(EOTB)不对称还原制备(R)-4,4,4-三氟-3-羟基丁酸乙酯[(R)-EHTB]为贝氟沙通合成的关键步骤。Zhang等[94]首次利用含NADPH依赖型羰基还原酶与葡萄糖-6-磷酸脱氢酶(GPDH)的Bacillus pumilus Phe-C3 细胞催化EOTB 合成(R)-EHTB,底物浓度为60mmol/L,产率为67%,e.e.达95% (图9)。He 等[95]利用Saccharomyces uvarum SW-58 全细胞为催化剂,构建水-有机两相反应体系,底物EOTB 浓度0.2mmol/L,反应4h,转化率达85%,产物e.e.为85.2%。含羰基还原酶的Kluyveromyces marxianus 细胞也被应用于(R)-EHTB的合成,但产物产率与e.e.值 均 较 低[96]。 Kara 等[97]最 近 利 用 来 源 于Lactobacillus kefir 的ADH evo-1.1.200 在无水介质中催化该反应,底物浓度5mmol/L,反应24h,转化率为39.2%,选择性明显提高(e.e.>99.9%)。

图8 度洛西汀关键手性中间体的酶法合成[89]

图9 贝氟沙通手性中间体不对称合成[94-95]
丁螺环酮是一种强效的5-羟色胺5HT1A受体部分激动剂,在脑中侧缝际区与5-HT1A受体高度结合,能减少体内5-羟色胺受体敏感性起到抗抑郁的作用。丁螺环酮无镇静、催眠、中枢性肌肉松弛等副作用,无成瘾性,广泛应用于抑郁症、焦虑症等的临床治疗。丁螺环酮在体内代谢活化为6-羟基丁螺环酮,并发挥药理功能,研究显示(R)-6-羟基丁螺环酮与(S)-6-羟基丁螺环酮在药效、药物代谢动力学与毒副作用方面并无明显差异,6-羟基丁螺环酮成为潜在的抗抑郁药物。Patel 等[98]从150余株菌株中筛选到含羰基还原酶Rhizopus stolonifer SC 13898 细胞,催化6-酮丁螺环酮不对称还原合成(S)-6-羟基丁螺环酮,产率达53%,e.e.>96.6%。同时筛选到的Candida maltose SC 16112可催化制备(R)-6-羟基丁螺环酮,产率大于57%,e.e.>97%。Goldberg 等[99]从Hansenula polymorpha SC 13845中筛选得到一株NADPH 依赖性羰基还原酶,与来源于Saccharomyces cerevisiae 的葡萄糖-6-磷酸脱氢酶重组共表达后,可催化50g/L 6-酮丁螺环酮还原制备(R)-6-羟基丁螺环酮,产率与e.e.值均达99%以上。另外一株来源于Pseudomonas putida SC 16269 的羰基还原酶,可在相同底物浓度下催化制备(S)-6-羟基丁螺环酮,产率>98%,e.e.>96.9%。
陈卫平对后勤保障的期望,就是预防患者就医过程的不安全因素,避免二次伤害,减少了医院在患者安全方面的财务支出。
4.4 抗哮喘药物
孟鲁斯特(Montelukast)是第三代白三烯受体拮抗剂药物,由Merk 公司开发,用于成人及儿童哮喘的预防和长期治疗,具有疗效稳定持久、安全性高、副作用少等突出优势。由2-[3-[3-[(E)-2-(7-氯-2-喳琳基)乙烯基]苯基]-3-氧代丙基]苯甲酸甲酯(酮酯M)不对称还原制备2-[3-(S)-[3-[2-(7-氯-2-喹啉基)乙烯基]苯基]-3-羟基丙基]苯甲酸甲酯[(S)-羟酯]是孟鲁司特合成的关键环节(图10)。1996 年,Microbacterium sp.MB 5614 被首次应用于(S)-羟酯的合成,产物e.e.>95%[100]。Codexis 公司基于羰基还原酶ADH 进行定向进化,开发了系列突变体,催化(S)-羟酯合成效率提高了2000倍,底物浓度为100g/L 时,产率为99.3%,e.e.达99.9%[101]。来源于 Candida albicans XP1463 (CCTCC M 2014382)的醛酮还原酶CaAKR,也对(S)-羟酯不对称合成展现出高催化活性与立体选择性,比酶活达145U/mg,产物e.e.>99%[92]。
(R)-(-)-3-奎宁醇含有一个含氮双环,是抗哮喘药物他沙利定、瑞伐托酯等药物合成的重要前体。不同的(R)-(-)-3-奎宁醇化学制备方法包括外消旋3-奎宁醇的动力学拆分、3-奎宁酮不对称还原等都已获报道[102-103]。Chen 等[104]利用奎宁酮还原酶(QNR)与葡萄糖脱氢酶(GDH)制备酶聚集体催化剂,催化3-奎宁酮不对称还原,底物浓度33g/L,反应3h,转化率达100%,产物e.e.>99.9%。该团队进一步构建了羰基还原耦联辅酶再生全细胞催化剂,催化(R)-(-)-3-奎宁醇的合成,反应速率较天然纯酶提升3 倍,底物浓度达468g/L,产物e.e.>99.9%,时空产率达1505.5g/(L·d),均为文献报道最高值,具有良好的应用前景[105]。
4.5 抗高血压药物
(R)-2-羟基-4-苯基丁酸乙酯是合成重要的抗高血压药物血管紧张素转换酶(angiotensinconverting enzyme,ACE)抑制剂,如贝那普利、赖诺普利和依那普利等的重要手性中间体(图11)。包括外消旋2-羟基-4-苯基丁酸乙酯动力学拆分、2-氧代-4-苯基丁酸乙酯的不对称还原等在内的方法都已得到报道。具有不对称还原2-氧代-4-苯基丁酸乙酯活性的菌株有Candida boidinii CIOC21、 C. krusei SW2026、 Rhodotorula mucilaginosa CCZU-G5 与C. magnoliae CGMCC 2.1919 等多种[106-110]。Qian 等[111]将来自C.glabrata 的酮还原酶CgKR2重组表达于P.pastoris工程菌细胞,并进行(R)-2-羟基-4-苯基丁酸乙酯的不对称合成,底物浓度1.0mol/L 时,产物产率达77.9%,e.e.为97.3%。Wang 等[112]对Thermotoga maritima 来源的羰基还原酶进行半理性设计改造,获得突变体Tm1743,催化2-氧代-4-苯基丁酸乙酯还原的选择性由(S)型转变为(R)型,产物e.e.值由76.5%(S)转变 为99.6%(R),催 化 效 率 提 升 至0.81mL/(mol·s)。Candida glabrata 来源的羰基还原酶与葡萄糖脱氢酶BmGDH(M6)耦联以提高辅酶再生效率,催化2-氧代-4-苯基丁酸乙酯的不对称还原,总转化数(total turnover number) 达18000,应 用 前 景 巨大[113]。羰基还原酶不对称合成(R)-2-羟基-4-苯基丁酸乙酯技术反应效率高、成本低廉、绿色环保,代表了ACE抑制剂类药物合成技术的发展方向。
4.6 抗凝血药物
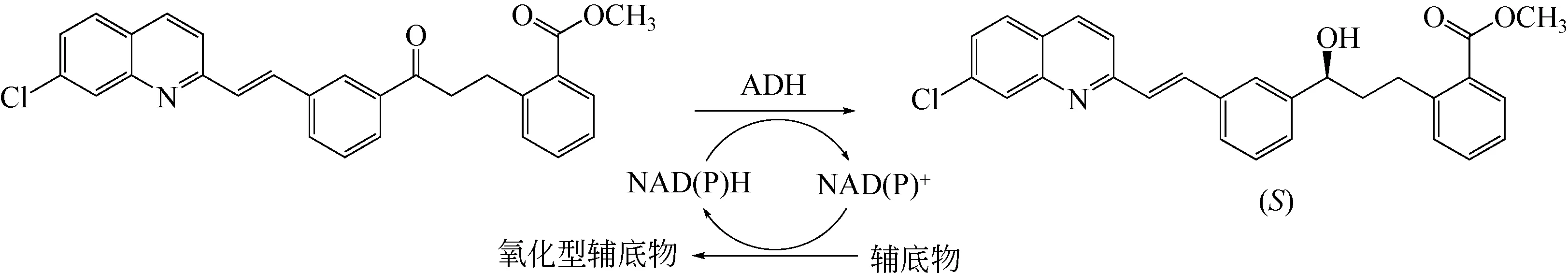
图10 羰基还原酶不对称还原制备孟鲁司特手性中间体[100]

图11 贝那普利、利诺普利和依那普利中间体合成[104]
(S)-氯吡格雷(Plavix)是一种选择性血小板凝集抑制剂,由法国赛诺菲(Snaofi)公司开发,用于治疗因血栓引起的心肌梗死和缺血性卒中,是目前世界上最畅销的药物之一。在已报道的(S)-氯吡格雷合成途径中,(R)-邻氯扁桃酸甲酯的合成是关键步骤(图12)。Jeong等[114]利用邻氯苯乙酮酸甲酯为底物,以Saccharomyces cerevisiae全细胞为催化剂,不对称还原获得(R)-邻氯扁桃酸甲酯,e.e.达96.1%。一株来源于Thermus thermophilus 的羰基还原酶也得到纯化与鉴定,使用该酶催化邻氯苯乙酮酸甲酯的还原,产率达95%,产物e.e.为92%[115]。Ma 等[116]对C. glabrata 基因组进行分析,挖掘获得一株新型羰基还原酶CgKR1,在与葡萄糖脱氢酶共表达构建辅酶再生体系后,催化邻氯苯乙酮酸甲酯不对称还原生成(R)-邻氯扁桃酸甲酯,底物浓度达300g/L,产率为87%,e.e.达98.7%。Ni 等[117]将来源于Bacillus sp.的醛酮还原酶与葡萄糖脱氢酶共表达后,催化(R)-邻氯扁桃酸甲酯的合成,底物浓度进一步提升至500g/L,时空产率达812g/(L·d),e.e.>99%。Xu 等[39]发现,甘油可提升NADPH 依赖型醛酮还原酶YtbE 的热稳定性与操作稳定性,在1mol/L底物浓度下,使(R)-邻氯扁桃酸甲酯的产率由70.5%提高到96.6%。Zheng 等[118]对羰基还原酶CgKR1 进行分子改造,获得CgKR1-F92C/F94W,用于系列手性醇医药中间体的制备,其中催化(R)-邻氯扁桃酸甲酯合成的活性提高了8倍。
凝血酶直接作用于血液凝固过程的最后一步,促使血浆中的可溶性纤维蛋白原转变成不溶的纤维蛋白,并可诱发血小板聚集及继发释放反应,是抗凝血药物开发的重要靶点。(R)-3,3-二甲基-2-羟基丁酸[(R)-DHBA]是凝血酶抑制剂合成的关键中间体。 Nelson 等[119]利用商业化醛酮还原酶KRED1001,以3,3-二甲基-2-氧代丁酸乙酯为底物,经羰基不对称还原、产物分离纯化及皂化脱酯后,产物(R)-DHBA的收率达82%,e.e.达99.5%。
4.7 抗癫痫药物
他仑帕奈(Talampanel)是新型癫痫治疗药物,作为一种高选择性、非竞争性的α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid(AMPA)型受体拮抗剂,可通过靶向抑制神经突触后膜AMPA受体的谷氨酸活性,减少与癫痫发作相关神经元的过度兴奋,从而达到预防和治疗癫痫疾病的目的。(S)-α-甲基-1,3-苯并二唑-5-乙醇[(S)-MBE]是他仑帕奈合成的关键中间体,利用羰基还原酶催化3,4-亚甲基二氧苯基丙酮(MDA)不对称还原制备(S)-MBE 的技术受到科学家的关注。Zygosaccharomyces rouxii 和Debaryomyces hansenii 首先被用于催化合成(S)-MBE,产率可达到90%以上,e.e.>99%[120]。Simon 等[121]研究了多种羰基还原酶催化还原MDA 的能力,获得两种高活性羰基还原酶:来源于Rhodococcus ruber的ADH-A和来源于Theromanaerobacter的ADH-T,底物浓度75mmol/L,(S)-MBE 产率达95%以上,e.e.>99%。Haq 等[122]利用来源于Z.rouxii 的酮还原酶构建细胞催化剂,同步催化羰基还原与辅酶再生,用于(S)-MBE 的合成,反应效率较游离酶大幅提升,产率达95%,e.e.>99%。

图12 (S)-氯吡格雷手性中间体的酶法合成
4.8 非甾体抗炎药物
布洛芬类药物是非甾体抗炎药物的重要种类,作为环氧化酶的非特异性抑制剂,可通过花生四烯酸途径抑制前列腺素的合成,从而起到抗炎、解热、镇痛的作用。(2S)-2-芳丙醇(8a-8f)是布洛芬类药物合成的关键手性中间体(图13)。2007年,Giacomini 等[123]发现马心醇脱氢酶(HLADH)可在有机溶剂或磷酸盐缓冲液中催化不对称拆分反应制备8a 和8b。接下来,针对未反应的另一构型醛基底物,科学家开发了化学消旋技术,将原料利用率突破了传统动力学拆分技术理论转化率不高于50%的限制[124]。来源于Sulfolobus solfataricus的羰基还原酶SsADH-10 被鉴定与纯化,并用于8a-8f 的动力学拆分制备,展现了较高的产率与良好的立体选择性[125]。接下来纯化的与固定化的HLADH 被报道用于催化2-芳基丙醛(7a-7f)的不对称还原制备(2S)-2-芳丙醇8a-8f[124,126],展现了羰基还原酶在布洛芬类药物合成中的良好应用潜力。

图13 酶法不对称合成布洛芬类药物中间体[124-126]
4.9 抗癌药物
紫杉醇是二萜生物碱类化合物,通过稳定细胞微管结构抑制癌细胞的有丝分裂并触发细胞凋亡,进而有效阻止癌细胞的增殖,起到抗癌作用。临床应用于乳腺癌、卵巢癌、头颈癌、肺癌等的治疗。(2R,3S)-N-苯甲酰-3-苯基异丝氨酸乙酯[(2R,3S)-10]是紫杉醇C-13 侧链合成的手性中间体。关于(2R,3S)-10 的酶法制备技术研究开始较早,1994年,酵母细胞催化的2-酮-3-(N-苯甲酰氨)-3-苯基异丝氨酸乙酯(9)不对称还原制备(2R,3S)-10过程(图14)已经得到报道[127]。Patel等[128]利用含羰基还原酶的Hansenula polymorpha 13865 与H. fabianii 13894 细胞催化(9)不对称还原制备(2R,3S)-10,产率>80%,e.e.>98%。近年来,来源于Clostridium acetobutylicum 的一种新型羰基还原酶被用于催化3-苯基-2-氯-3-氧代丙酸乙酯(11)的羰基不对称还原,制备紫杉醇C-13侧链合成的手性砌块(2S,3R)-2-氯-3-羟基-3-苯基丙酸乙酯[(2S,3R)-12],产率达95%,e.e.达99%,d.e.为95%[129]。

图14 紫杉醇侧链中间体的生物还原制备工艺[127,129]
布立尼布是一种新型血管内皮细胞生长因子VEGF 受体与成纤维细胞生长因子FGF 受体拮抗剂,临床用于肝癌及其他实体瘤的治疗。(R)-1-[4-(4-氟-2-甲基-1H-吲哚-5-乙氧基)-5-甲基吡格[2,1-f][1,2,4]三嗪-6-乙氧基]-丙烷-2-醇[(R)-MPO]是布立尼布合成的重要前体。Codexis 公司利用基于醇脱氢酶ADH-LK 和ADH-LB 开发的多个羰基还原酶突变体催化1-[4-(4-氟-2-甲基-1Hindol-5-吲哚)-5-甲基-吡格[2,1-f][1,2,4]三嗪-6-乙氧基]-丙烷-2-酮的羰基不对称还原,在以葡萄糖或异丙醇为辅底物促进辅酶再生的条件下,底物浓度12g/L,产物(R)-MPO e.e.>99%[132]。
4.10 抗艾滋病药物
阿扎那韦是蛋白酶抑制剂类的抗逆转录病毒药物,用于治疗人类免疫缺陷病毒(HIV)的感染。(1S,2R)-[3-氯-2-羟基-1-(苯甲基)丙基]氨基甲酸,1,1-二甲基乙酯[(1S,2R)-CADE]是阿扎那韦合成的关键手性中间体。生物法合成催化(1S,2R)-CADE技术已得到开发。采用R. erythropolis SC 13845 细胞,可催化(1S)-[3-氯-2-氧代-1-(苯甲基)丙基]氨基甲酸,1,1-二甲基乙酯不对称合成(1S,2R)-CADE,产率与e.e.值分别达95%与99.4%[133]。Wu等[134]基于来源于Novosphingobium aromaticivorans 的短链脱氢酶NaSDR 进行分子改造,获得突变体muSDR(G141V/I195L),kcat较野生酶提高3.57倍,于甲苯-水两相反应体系中,底物浓度500mmol/L,底物基本转化,e.e.>99%。
4.11 肾上腺素受体激动剂
(R)-地诺帕明、(R)-(-)-α-(3,4-二甲氧基苯乙基氨甲基)-4-羟基苯甲醇与(R)-沙美特罗、(R)-4-羟基-α-1-[[[6-(4-苯基丁氧基)己基]氨基]甲基]-1,3-苯二甲醇是新型选择性β-肾上腺素受体激动剂,是充血性心衰、哮喘的重要治疗药物。以前体酮13a-13e为底物,可通过酶促不对称羰基还原反应制备对应的手性醇中间体(R)-14a-14e,并进而合成(R)-地诺帕明与(R)-沙美特罗(图15)。来源于Daucus carota根部的羰基还原酶最先报道用于催化(R)-14a 与(R)-14b 手性醇的高立体选择性合成[135]。以前体酮13c 和13d 为底物,以Rhodotorula rubra 细胞为催化剂,可立体选择性制备(R)-14c 和(R)-14d,产率达78%~80%,e.e.值为95%[136]。近年来Rhodococcus sp.1-0130细胞被报道可用于催化底物13d、13e分别制备(R)-14d与(R)-14e,并进一步用于(R)-沙美特罗的合成,产物e.e.>99%[137]。

图15 合成(R)-地诺帕明和(R)-沙美特罗中间体的生物还原过程[129-131]
其他手性纯的α-卤醇在β-肾上腺素受体激动剂的合成中也起着重要作用。含羰基还原酶的微生物细胞如Saccharomyces cerevisiae CGMCC 2.396、Aspergillus sydowii Ce19和Pichia minuta JCM 3622等对(R)-或者(S)-α-卤醇的不对称合成均具有良好的活性与立体选择性[138-140]。Xu 等[141]利用来源于Kluyveromyces thermotolerans 的底物耐受性羰基还原酶KrtCR 催化多种前体酮制备手性α-卤醇,当以苯氯乙酮为底物时,KrtCR 的催化转化数达到5000,反应浓度达154g/L,产物浓度达92%,e.e.达99%。
(R)-苯肾上腺素[(R)-PE]是一种选择性α1-肾上腺素受体激动剂,作为伪麻黄碱的安全性替代药物,临床上广泛用于感冒等症状的缓解。Codexis公司利用基于Lactobacillus kefir ADH 改造获得的系列羰基还原酶,催化1-(3-羟苯基)-2-(甲胺)乙酮(HPMAE)不对称还原合成(R)-PE,相对原始酶,突变酶活力提升10 倍以上,产物e.e.可达99%以上[142]。 Peng 等[143]筛 选 获 得 来 源 于 Serratia marcescens BCRC 10948的短链脱氢酶SM_SDR可立体选择性制备(R)-PE,底物浓度为10mmol/L,产物产率达51.06%,e.e.>99%,时空产率达0.57mmol/h。进一步,利用SM_SDR,经大肠杆菌重组表达与启动子替换后,全细胞催化(R)-PE 合成的底物浓度提升至50mmol/L,产物e.e.>99%,产率达47.5%,时空产率达1.98mmol/h[144]。而来源于S.quinivorans BCRC 14811 的短链脱氢酶催化制备(S)-PE 的e.e.>99%,产率达86.6%,时空产率为20.2mmol/h[143]。
5 立体选择性羰基还原酶在精细化工品合成中的应用
5.1 手性γ-戊内酯
γ-戊内酯(GVL)可用作树脂溶剂、增塑剂、润滑剂、燃料添加剂,并可用于香精、色素及燃料添加剂的合成。使用ADH 从乙酰丙酸甲酯生产γ-戊内酯已得到报道。Díaz-Rodríguez 等[145]使用分别来自Rhodococcus ruber 的ADH-A、Lactobacillus brevis 的LBADH和Ralstonia sp.的RasADH催化合成一系列手性纯的羟基酯和内酯,转化率>99%,产物e.e.>99%。
5.2 (2S,3S)-2,3-丁二醇
2,3-丁二醇是一种有具有广泛工业应用前景的化学品,具有两个邻近立体中心的光学纯2,3-丁二醇被用作手性化合物的重要组成部分。羰基还原酶能够将二乙酰还原为乙酰丁酸酯,然后还原为2,3-丁二醇的不同异构体[146](图16)。Wang 等[147]分离获得的Rhodococcus erythropolisWZ010菌株,可将二乙酰还原为光学纯的(2S,3S)-2,3-丁二醇,从该菌株中分离纯化的羰基还原酶催化制备(2S,3S)-2,3-丁二醇不对称合成,产率为98%,e.e.为100%。He 等[148]构建了大肠杆菌工程菌共表达(2S,3S)-2,3-丁二醇脱氢酶和甲酸脱氢酶,用于从(S)-3-羟基丁酮生产(2S,3S)-2,3-丁二醇,产率达38.41g/L,e.e.达98.03%。

图16 羰基还原酶催化不对称合成(R)-1,3-丁二醇[147]
5.3 苯乙醇
光学活性苯乙醇及其衍生物是合成手性醇药物和精细化学品的重要中间体。Singh 等[149]使用Metschnikowia koreensis 全细胞来不对称还原具有各种取代基的苯乙酮,以25mmol/L 苯乙酮为底物,转化率可达92%,产物手性苯乙醇e.e.>99%。此外,Vitale 等[150]发现一种耐热Kluveromyces marxianus 菌株,可用于不同的苯乙酮衍生物生物还原为(S)-醇。来自hermus thermophilusHB27 的短链脱氢酶可将2,2,2-三氟苯乙酮不对称还原为(S)-α-(三氟甲基)苄醇,e.e.为96%[151]。从Thermococcus kodakarensis KOD1 中纯化的羰基还原酶TkADH 可催化2,2,2-三氟苯乙酮还原为(R)-2,2,2-三氟-1-苯基乙醇,也显示了良好的立体选择性(产物e.e.>99.6%)[152]。Zhang等[153-155]从Candida parapsilosis中发现了一种(S)-选择性的羰基还原酶SCRII,通过定点突变获得E228S,进一步与葡萄糖脱氢酶共表达后,在12h 内,产物(R)-苯乙醇的化学纯度为99.5%,产率为92.2%。而后将E228S/SCRII 和GDH共同固定在S.cerevisiae AN120 osw2Δ中,在乙酸乙酯中经4~6 次循环后,产率超过70%且e.e.>99%。Qin 等[156]对来自于Candida glabrata 的CgKR1进行工程改造,可催化不同取代基的α-卤素取代苯乙酮(e.e.>99%)。
6 结语
本文介绍了立体选择性羰基还原酶的催化机制、筛选与改造技术及在手性醇医药与精细化工品合成中的应用。作为工业应用最为广泛的氧化还原酶,羰基还原酶在心脑血管疾病、抑郁症、重症感染等疾病治疗药物及手性苯乙醇等精细化工品的绿色制造技术发展中起到重要作用。随着社会和经济的不断发展,手性药物与精细化学品的需求迅速增加,手性醇作为医药与化工中间体的重要性将不断增强。立体选择性羰基还原酶是手性醇制造领域最重要和最有前景的生物催化剂,基于生物信息学和人工智能的数据挖掘、筛选与探索酶的活性与立体选择性的分子机制,以期获得适合工业化强度生产的鲁棒性生物催化剂。近年来,多酶组合催化及多手性中心复杂化合物的合成成为研究热点,实现高性能、精准调控的羰基还原酶催化剂的创制,为我国手性药物制造业转型升级和可持续发展提供重要助力。
