CASC19通过维持巨噬细胞M1型极化状态保持对结直肠癌的抑制作用
2021-03-28葛将吴静张澍田闵力刘揆亮李倩李楠杉
葛将 吴静, 张澍田 闵力 刘揆亮 李倩 李楠杉
作者单位:100038 北京 1首都医科大学附属北京世纪坛医院消化科;100050 北京 2首都医科大学附属北京友谊医院消化分中心,国家消化系统疾病临床医学研究中心,消化疾病癌前病变北京市重点实验室,北京消化中心;100730 北京 3首都医科大学附属北京同仁医院科技处
结直肠癌(colorectal cancer,CRC)是全球死亡人数排名第二的恶性肿瘤[1]。CRC具有被大量免疫细胞浸润的微环境,即肿瘤微环境(tumor microenvironment,TME),包括肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)、单核细胞、树突状细胞、自然杀伤细胞等,其中TAMs是TME中最丰富的免疫细胞[2]。TAMs来自单核细胞的定向分化,一般来说,单核细胞被肿瘤细胞的分泌因子CCL2、CCL3、VEGF等招募到TME中,又被TME中的其他因子(如IL-12等)诱导分化为TAMs。在不同刺激条件下TAMs还会继续分化为两种重要亚型:经典活化的M1型和替代活化的M2型[3]。有研究显示,单核细胞浸润到不同组织分化成巨噬细胞这一复杂的分化过程需要非编码RNA(non-coding RNAs,ncRNAs)、转录因子、细胞因子的协同作用[4]。但是,不同亚型TAMs之间相互转化的关键分子机制并不清楚。
长链非编码 RNA(long non-coding RNAs,lncRNAs)是长度超过200个碱基对、不编码蛋白质的内源性RNA[5]。既往研究表明正常巨噬细胞在不同条件下诱导极化后具有特征差异显著的lncRNAs表达谱,且lncRNAs异常表达可能在调控巨噬细胞极化中发挥重要作用[6]。lncRNAs还可通过调控巨噬细胞极化影响肿瘤细胞迁移和侵袭[7],如lncRNA cox-2能调控巨噬细胞极化方向,从而抑制肝癌细胞侵袭和迁移[8]。lncRNA ANCR则能通过抑制M1极化促进胃癌细胞侵袭和迁移[9]。癌症易感基因19(the cancer susceptibility 19,CASC19)是位于染色体8q24.21上324 bp的lncRNA,研究表明CASC19在CRC组织中表达缺失,且与CRC进展密切相关[10]。然而,CASC19如何调控CRC进展以及是否通过调控TAMs或其他TME相关细胞发挥作用及其机制目前尚不清楚。本研究旨在探讨CASC19诱导巨噬细胞从M1型向M2型转化的潜在功能,并明确这一过程对TAMs及结肠癌细胞增殖及迁移的影响。
1 材料与方法
1.1 主要材料及试剂
人单核细胞型淋巴瘤细胞系Thp1、结直肠癌细胞系SW480购自中国医学科学院;RPMI-1640培养基购自美国GIBCO公司;胰蛋白酶购自Solarbio公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTS)购自武汉博士德公司;二甲基亚砜购自北京鼎国昌盛生物技术有限责任公司;佛波酯-12-肉豆蔻酸-13-乙酸酯(PMA)、LPS 购自 SIGMA 公司;IFN-γ、IL-4 购自PEROTECH 公司;CCL22、CD206、IL-10、CD40、IL-1β、CD163、GAPDH引物购自上海生工生物工程股份有限公司;FBS、LipofectamineTM3000购自Thermo Fisher Scientific公司;siRNA CASC19及内参购自广州锐博生物科技有限公司;总RNA提取试剂盒、TaqMan MicroRNA Reverse Transcription Kit逆转录和Fast Star Universal SYBR Green Mastermix扩增(RT-qPCR)试剂盒购自日本TaKaRa公司;Transwell迁移小室购自Millicell公司。
1.2 细胞培养及不同亚型巨噬细胞诱导
人单核细胞型淋巴瘤细胞系Thp1用含10%FBS的RPMI-1640完全培养基,于37℃、5%CO2全湿培养箱中培养。取对数生长期的细胞(2×106/mL)铺至6孔板中,使用终浓度100 ng/mL PMA诱导48 h为贴壁巨噬细胞M0。吸除原培养基,设为M0组、M1组、M2组,M0组用含10%FBS的RPMI-1640完全培养基培养24 h,M1组用含100 ng/mL LPS和 20 ng/mL IFN-γ的10%FBS的RPMI-1640完全培养基培养24 h,M2组用含100 ng/mL IL-4的10%FBS的RPMI-1640完全培养基培养24 h。
1.3 RT-qPCR检测M1/M2分子标记及CASC19 mRNA表达水平
采用TRIzol试剂法提取M0组、M1组和M2组细胞的总RNA,按照TaKaRa反转录试剂盒将RNA逆转录为cDNA。以cDNA为模板,进行RT-qPCR扩增CCL22、CD206、IL-10、CD40、IL-1β、CD163、GAPDH、CASC19,以GAPDH为内参。反应条件:95℃预变性30 s;95℃变性 5 s,60 ℃退火/延伸 1 min,共 40 个循环。用 2-ΔΔCt法计算目的基因的相对表达量。引物序列见表1。

表1 目的基因的引物序列Tab.1 Primer sequence of target gene
1.4 细胞转染与分组
取M1型巨噬细胞接种于6孔板(2×106/孔)中,分别转染200 nmol/L NC-siRNA 以及50 nmol/L、100 nmol/L、200 nmol/L的CASC19-siRNA,依次记为NC-siRNA组、50 nmol/L组、100 nmol/L组、200 nmol/L组,按照LipofectamineTM3000转染试剂盒说明进行操作。
1.5 条件培养基的制备
NC-siRNA组和CASC19-siRNA组M1型巨噬细胞培养48h后,收集两组上清分别为M1 NC-CM组和M1 SI-CM组,12 000 r/10 min离心,去除沉淀,将多次收集的上清混匀,-80℃保存备用。
1.6 活细胞实时动态成像检测细胞增殖能力
SW480细胞消化离心接种至96孔板(2×103/孔),分别加入M1 SI-CM或M1 NC-CM 100 μL/孔进行培养,4 h拍照1次,置于活细胞实时动态成像仪下观察,根据仪器指南手册记录并统计数据,实验重复3次。
1.7 MTS法检测细胞增殖能力
取对数生长期的SW480细胞消化后接种于96孔板(1×103/孔),分别加入M1SI-CM或M1NC-CM 100 μL/孔进行培养,分别于 0 h、24 h、48 h、72 h 时每孔加入MTS试剂20 μL继续孵育2 h。酶标仪测定各孔490nm波长处光密度(OD)值,每组重复3次,取平均值。细胞增殖活力(%)=[(实验组OD值-空白对照组OD值)/空白对照组OD值]×100%。
1.8 Transwell实验检测细胞迁移能力
SW480细胞消化后重悬,取适量细胞悬液接种于Transwell上室(8×104/孔),每孔体积 300 μL;下室分别加入M1 SI-CM或M1 NC-CM,700 μL/孔,于37℃、5% CO2全湿培养箱中培养,孵育24 h。PBS清洗3次,用0.1%结晶紫甲醇工作液染色,棉签擦去上室内细胞,PBS冲洗干净后置于正置显微镜下观察,分别选取膜上侧、膜左侧和膜右侧3个视野拍照,计算穿膜细胞数。
1.9 统计学方法
采用Graphpad Prism 8、Image J进行数据分析,以均数±标准差(±s)表示。M0、M1、M2 分子标记和CASC19 mRNA表达水平比较采用单因素方差分析(One-way ANOVA),采用D′Agostino-Pearson和Shapiro-Wilk检验进行正态分析,若差异有统计学意义,则采用LSD-t法进行多重比较。CASC19敲降效果比较采用独立样本t检验。细胞增殖数据比较采用二因素方差分析检验,细胞迁移数据比较采用独立样本t检验。以双侧P<0.05认为差异有统计学意义。
2 结果
2.1 不同亚型巨噬细胞的获取与鉴定
2.1.1 PMA诱导M0型巨噬细胞的形成 100 ng/mL PMA诱导48 h后,悬浮状态呈串珠状的Thp1细胞转变为贴壁状态M0细胞(图1),表明巨噬细胞M0诱导成功。
图1 PMA诱导M0型巨噬细胞的形成(比例尺:100 μm)Fig.1 PMA induced the formation of M0 type macrophage(scale bar:100 μm)
2.1.2 巨噬细胞M0诱导极化 RT-qPCR检测结果显示,M2型巨噬细胞分子标记CCL22、CD206、IL-10在M2中高表达(图2A~C);M1型巨噬细胞分子标记IL-1β、CD40在 M1中高表达(图 2D~E);以上标志物在M1和M2间的表达差异有统计学意义(均P<0.05),表明巨噬细胞亚型M1/M2极化成功。

图2 巨噬细胞M0诱导极化Fig.2 Induction of macrophage M0 polarization
2.2 巨噬细胞中CASC19 mRNA的表达水平及CASC19敲降效果验证
RT-qPCR检测结果显示,与M0组和M2组比较,CASC19在M1组中的表达水平明显升高(P<0.05,图3A);与 NC-siRNA 组比较,50 nmol/L、100 nmol/L和200 nmol/L组CASC19的表达水平均降低(P<0.05,图3B)。其中选取敲降效率最佳的200 nmol/L浓度siRNA进行后续实验。
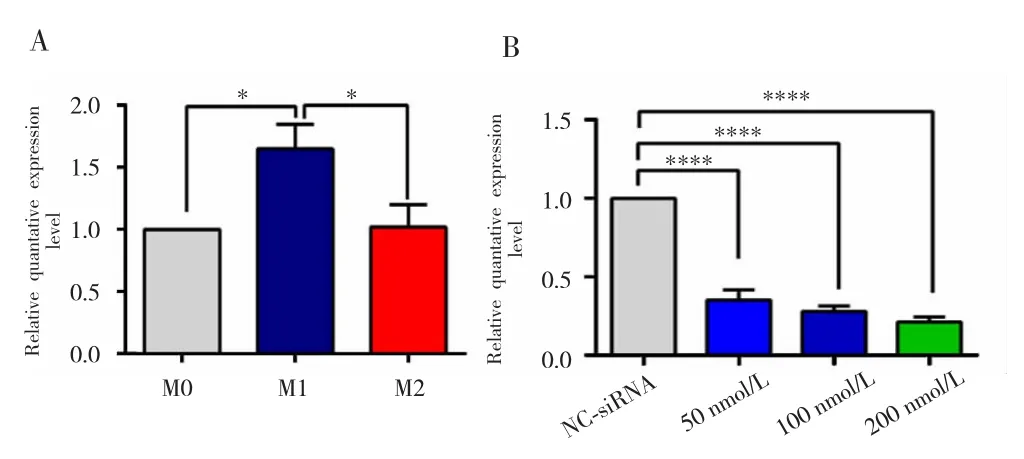
图3 巨噬细胞中CASC19 mRNA的表达水平及CASC19敲降效果验证Fig.3 Expression of CASC19 mRNA in macrophages and testing transfection efficiency of knockdown CASC19
2.3 敲降CASC19对SW480细胞增殖和迁移的影响
活细胞实时动态成像检测结果显示,与M1 NC-CM处理组比较,M1 SI-CM处理组中SW480细胞增殖速度显著增高(P<0.05,图4A)。MTS法检测结果显示,与M1 NC-CM处理组相比,0 h、24 h、48 h、72 h时M1 SI-CM处理组细胞增殖活力均显著增高(图4B)。Transwell法检测结果显示,SW480细胞中,M1 SI-CM处理组迁移细胞数较M1 NC-CM处理组显著增多(图4C),差异有统计学意义(P<0.001)。
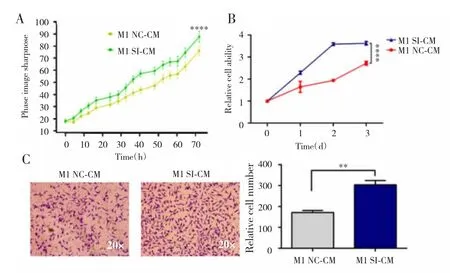
图4 敲降CASC19对SW480细胞增殖和迁移的影响Fig.4 Effect of proliferation and migration on SW480 cells by knockdown CASC19
2.4 敲降CASC19使M1型巨噬细胞的M1亚型分子特征消除
在M1型巨噬细胞中敲降CASC19后,RT-qPCR检测结果显示,与NC组比较,SI组细胞的M2分子标记CD206、IL-10、CD163 表达水平升高(图 5A~C),M1分子标记CD40、IL-1β表达水平降低(图5D~E),差异均有统计学意义(均 P<0.05)。
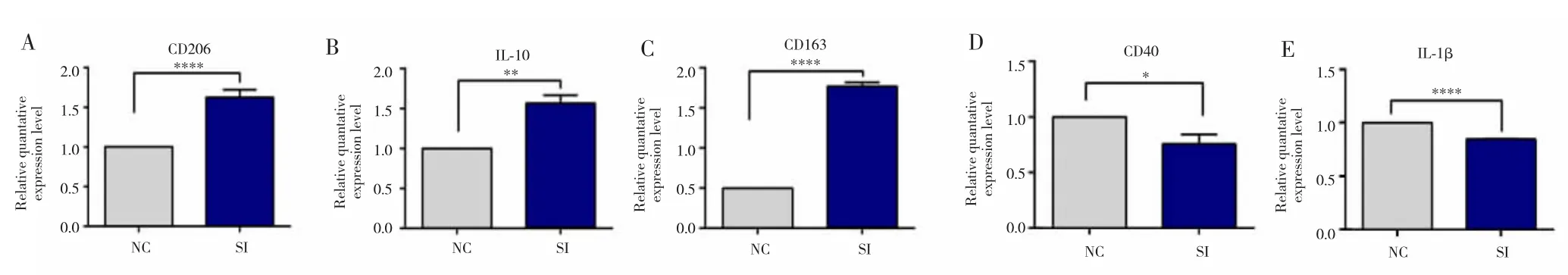
图5 敲降CASC19使M1型巨噬细胞的M1亚型分子特征消除Fig.5 Eliminating M1 macrophage molecular markers with knockdown CASC19 in M1 macrophage
3 讨论
肿瘤组织中异常表达的lncRNA可以通过不同机制对肿瘤发展产生促进或抑制作用,越来越多的证据表明lncRNA CASC19与多种不同类型肿瘤相关,例如能促进非小细胞肺癌[11]、透明细胞肾癌[12]、结直肠癌[13]等多种肿瘤细胞增殖和转移,且与进展期胃癌进展及预后不良相关[14]。然而lncRNA CASC19在肿瘤细胞以外的TME其他组分中是否具有其他功能目前并不清楚。本研究以TAMs作为核心研究对象,探究CASC19在M1亚型巨噬细胞中的作用。本研究成功将巨噬细胞分化为M1型和M2型两种亚型,在M1型巨噬细胞中发现CASC19高表达。然后通过收集敲降CASC19后的M1型巨噬细胞上清培养结直肠癌细胞SW480,发现CASC19敲降后,M1型巨噬细胞对SW480细胞增殖和迁移的抑制能力显著减弱,同时M1型巨噬细胞敲降CASC19后M2分子标记CD206、IL-10、CD163的表达明显升高,而M1分子标记CD40、IL-1β表达则明显下降,表明M1型巨噬细胞敲降CASC19后丧失了其对M1型巨噬细胞关键分子特征的维持,从而可能间接丧失了对SW480细胞增殖和迁移的抑制作用。考虑敲降CASC19可能通过竞争性内源性RNA(ceRNA)机制影响转录过程以及下游蛋白表达而促使M1型巨噬细胞向M2方向极化,然而具体机制还需根据CASC19在M1型巨噬细胞中的定位进一步分析。目前已知CASC19可以靶向miR-301b-3p/LDLR轴[11]及miR-140-5p/CEMIP轴[13],然而这些ceRNA功能是否通过某种机制,例如影响某种诱导M2的细胞因子表达或分泌过程,从而影响巨噬细胞极化仍需进一步探索。
TME是一个复杂的生理和生化系统,在肿瘤发生发展和转移方面起重要作用[7]。作为数量最丰富的TME相关免疫细胞,TAMs可通过抑制免疫细胞活性、诱导新生血管形成和支持癌症干细胞等多种不同方式促进肿瘤生长[15]。本研究显示lncRNA CASC19在维持M1型巨噬细胞对结肠癌细胞增殖和迁移的抑制功能中起关键作用,而这种作用可能依赖于其对巨噬细胞M1极化状态的保持,这是lncRNA参与巨噬细胞与肿瘤细胞相互作用的一种较为新颖的机制模式,其中是否还有其他lncRNA或分子原件参与仍有待进一步探索。
综上所述,CASC19在M1型巨噬细胞中高表达,敲降M1型巨噬细胞中的CASC19表达可促进结直肠癌细胞增殖和迁移,其机制可能与极化为M2型巨噬细胞相关。未来通过全面揭示lncRNA在肿瘤组织及其微环境中的其他组分中的作用,有望为临床肿瘤诊治提供新的思路和方法。
