定向诱导为神经元样细胞的骨髓间充质干细胞对大鼠坐骨神经损伤的修复作用研究
2021-03-27胡安全冯祁军王正安
胡安全 冯祁军 王正安 秦 力 李 哲
浙江省嘉兴市第一医院骨科,浙江嘉兴 314000
周围神经损伤多见于高能量暴力损伤患者[1],尤其以坐骨神经损伤最难处理且术后恢复缓慢,这与周围神经的再生和修复能力有限、功能恢复差有关。目前骨髓间充质干细胞(BM-MSCs)已经成为组织工程、细胞治疗领域理想的种子细胞[2-3],尤其可用于周围神经损伤的再生细胞治疗[4]。但是由于干细胞移植在体内的存活率和分化率不理想,患者很难获得理想的临床效益[5-7]。为了提高BM-MSCs 移植对坐骨神经损伤的再生与修复作用,本研究在体外通过不同的诱导方法定向诱导BM-MSCs 向神经元样细胞分化,并进一步通过大鼠坐骨神经损伤模型,以证实在体外定向诱导为神经元样BM-MSCs 有促进大鼠神经损伤恢复和神经递质分泌的作用。
1 材料与方法
1.1 材料
12 只SPF 级4 周龄雄性SD 大鼠(175±10)g 和90 只SPF 级3 月龄雄性SD 大鼠(225±25)g 购自浙江维通利华实验动物技术有限公司[许可证号:SCXK(浙)2019-0001],动物房温度(22±1)℃,湿度(50±5)%,适应性喂养1 周后进行实验,实验过程中遵循“3R”原则。
BriCyte E6 型流式细胞仪购自深圳迈瑞医疗公司;β-巯基乙醇(货号:0482-250ML)和全反式视黄酸(货号:C20734-100mg)购自美国Sigma 公司;免疫印迹一抗脑源性神经营养因子(BDNF)(货号:ab108319)、髓磷脂碱性蛋白(MBP)(货号:ab20216)和生长关联蛋白43(GAP-43)(货号:ab75810)购自英国Abcam 公司。
1.2 BM-MSCs 分离培养及鉴定
取12 只4 周龄大鼠,窒息处死。参照Maridas 等[8]、Huang 等[9]方法取大鼠双侧股骨及胫骨分离骨髓细胞。细胞培养用常规细胞贴壁筛选法,通过多次1∶1传代在体外进行纯化。取1.0×106个/mL P3 代细胞加入适量鼠抗人抗体CD29、CD44、CD90 免疫荧光鉴定,流式细胞仪检测BM-MSCs 表面标志物。
1.3 BM-MSCs 定向诱导和分化
将BM-MSCs 细胞分为化学诱导分化组(β-巯基乙醇组和全反式视黄酸组)、Transwell 小室共培养组和对照组(不作处理)。化学诱导分化组按1.0×105个/mL浓度接种于盖玻片上,用低糖DMEM 培养基培养,达到70%融合时,换成含3 mmol/L β-巯基乙醇或1 μmol/L 全反式视黄酸的培养基诱导。Transwell 小室共培养组,取细胞悬液,培养贴壁细胞至有神经网状结构后,按1×106个/mL 的密度接种于Transwell 双层培养皿的底层,Transwell 内板中接种骨髓间充质干细胞。
诱导7 d 后,免疫组化法检测神经元特异性烯醇化酶表达。并用细胞免疫荧光染色法和流式细胞术法鉴定神经分化标志物胶质纤维酸性蛋白(GFAP)、神经营养素(NT3)、微管相关蛋白2(MAP2)、Tau、趋化因子基质细胞衍生因子-1 受体(CXCR4)、神经微丝蛋白200 kD(N200)、NESTIN、泛素(UBIQUITIN)、微管蛋白Ⅲ(TUBULIN Ⅲ)阳性表达情况。
1.4 大鼠坐骨神经缺损模型的建立和分组
取90 只3 月龄SD 大鼠,按照随机数字表法分为假手术组、模型组、普通细胞组与定向诱导组。除假手术组20 只外,其余70 只大鼠用钳夹法建立大鼠坐骨神经损伤模型[10]。操作方法:腹腔注射10%水合氯醛麻醉,固定。常规备皮、消毒后,钝性分离左大腿肌肉。显露坐骨神经,在大腿根部用动脉瘤夹钳夹坐骨神经,钳夹10 s,反复3 次,造成3 mm 的损伤区。手术过程中,显微镜观察到其外膜连续而神经轴突中断。含抗生素盐水清洁伤口后,缝合组织。术后,以大鼠左下肢反应迟钝,屈伸力量明显减弱,为造模成功的标准。假手术组大鼠仅暴露坐骨神经,而不用夹钳损伤神经,随后缝合组织。最终造模成功63 只,为了平衡每组动物数量,随机剔除3 只大鼠,确保每组20 只大鼠。术后用微量注射器将10 μL 的P3 代BM-MSCs 悬液(1×106个)和经定向诱导分化的神经元样细胞悬液(1×106个)分别植入普通细胞组和定向诱导组大鼠坐骨神经损伤处。假手术组和模型组注入等量生理盐水。注射3 min,留针5 min。注射完成后,继续饲养12 周。
1.5 坐骨神经功能指数(SFI)评估
自制大鼠足迹行走箱,采集四组2、4、8、12 周(细胞移植后)大鼠足印,根据Bain 公式[11]计算并比较各组大鼠的SFI。SFI 测定结果介于-100(完全失去神经支配功能)~0(运动正常)。
1.6 大鼠运动功能评估
采用Basso Beattie Bresnahan(BBB)运动功能评分法评估大鼠运动功能,自大鼠造模后2、4、8、12 周(细胞移植后)对大鼠模型进行盲法评分。BBB 分值介于0(完全失去神经支配功能)~21 分(运动正常)[12]。
1.7 肌湿重恢复率比较
实验结束后,取大鼠实验侧(E)和健侧(N)小腿三头肌称重,根据公式[13](肌湿重恢复率=E 肌湿重/N肌湿重×100%)计算肌湿重恢复率。
1.8 大鼠坐骨神经中BDNF、MBP 和GAP-43 蛋白表达水平检测
BBB 运动功能评分后,通入过量二氧化碳,将大鼠安乐死。收集大鼠坐骨神经组织,提取总蛋白。经BCA 法测定蛋白浓度后,加入适量样品缓冲液调节蛋白浓度为0.5 μg/μL,100℃水浴5 min 后,SDS-PAGE胶上每孔上样20 μL。120 V 40 min 后转膜7 min。至5%的脱脂奶粉中封闭30 min。加入相应的一抗(1:1000)稀释液,4℃储存,过夜;加HRP 标记二抗(1:1000),水平摇床,室温封闭1 h 后,TBST 洗3 次,每次10 min,显影。
1.9 统计学方法
采用GraphPad Prism 6 统计学软件进行数据分析。计量资料用均数±标准差()表示,不同时间点比较采用重复测量方差分析,两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 BM-MSCs 形态变化及鉴定
大鼠BM-MSCs 培养24 h 后,只有少数细胞贴壁生长;贴壁细胞在常规培养72 h 后开始增殖,逐渐出现出现长短不一的突起,并呈集落样生长。P3 代细胞生长态势均一,排列紧密,呈涡旋状集落,见图1。经流式细胞术鉴定,P3 代BM-MSCs 可高表达CD29、CD44、CD90,几乎不表达CD45,见图2。

图1 倒置显微镜下观察BM-MSCs 细胞形态(100×)
2.2 不同诱导方法对BM-MSCs 神经元特异性烯醇化酶阳性表达率的影响
整体比较:不同诱导方法对BM-MSCs 神经元特异性烯醇化酶阳性表达率组间、时间及交互作用比较,差异均有统计学意义(均P<0.05)。组内比较:对照组各时间点BM-MSCs 神经元特异性烯醇化酶阳性表达率比较,差异无统计学意义(P>0.05)。β-巯基乙醇组、全反式视黄酸组、Transwell 小室共培养组各时间点比较,差异均有统计学意义(均P<0.05)。组间比较:第1 天,Transwell 小室共培养组BM-MSCs神经元特异性烯醇化酶阳性表达率高于β-巯基乙醇组、全反式视黄酸组;全反式视黄酸组BM-MSCs 神经元特异性烯醇化酶阳性表达率低于β-巯基乙醇组;β-巯基乙醇组BM-MSCs 神经元特异性烯醇化酶阳性表达率高于对照组。第3、5、7 天,四组各时间点组间两两比较,差异均有统计学意义(均P<0.05)。见表1。

图2 流式细胞术检测P3 代BM-MSCs 细胞表面抗原
诱导7 d 后,β-巯基乙醇组BM-MSCs 神经元特异性烯醇化酶阳性表达率高于其他三组,故而选择β-巯基乙醇组定向诱导分化7 d 后的BM-MSCs 用于后续动物实验。
表1 不同诱导方法对BM-MSCs 神经元特异性烯醇化酶阳性表达率的影响(%,,n=3)

表1 不同诱导方法对BM-MSCs 神经元特异性烯醇化酶阳性表达率的影响(%,,n=3)
注:与同组第1 天比较,*P <0.05;与同组第3 天比较,#P <0.05;与同组第5 天比较,&P <0.05;与对照组同期比较,aP <0.05;与β-巯基乙醇组同期比较,bP <0.05;与全反式视黄酸组同期比较,cP <0.05。BM-MSCs:骨髓间充质干细胞
2.3 β-巯基乙醇定向诱导分化7 d 后的BM-MSCs神经分化标志物检测
免疫荧光染色法显示,神经分化标志物CXCR4、GFAP、NT3、MAP2、Tau、N200 表达率为75%~100%,NESTIN 阳性表达率为50%~75%,而UBIQUITIN、TUBULIN Ⅲ检出率为25%~50%,见图3。经流式细胞术法显示,GFAP、NT3、MAP2、Tau、N200阳性表达率超过70%,CXCR4、NESTIN、UBIQUITIN、TUBULIN Ⅲ细胞阳性表达率低于70%,见图4。
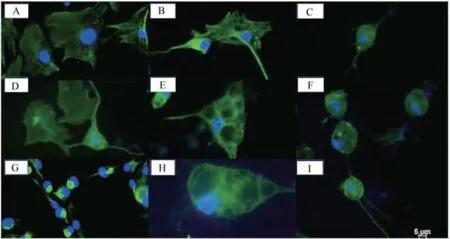
图3 免疫荧光染色法检测β-巯基乙醇定向诱导分化7 d 后BM-MSCs 神经分化标志物(10 000×)
2.4 四组术后2、4、8、12 周SFI 比较

图4 流式细胞术检测β-巯基乙醇定向诱导分化7 d 后BM-MSCs 神经分化标志物
整体比较:各组大鼠SFI 组间、时间及交互作用比较,差异均有统计学意义(均P<0.05)。组内比较:假手术组各时间点SFI 比较,差异无统计学意义(P>0.05);模型组、普通细胞组、定向诱导组各时间点SFI比较,差异均有统计学意义(均P<0.05)。组间比较:模型组术后2、4、8、12 周SFI 低于假手术组,差异均有统计学意义(均P<0.05)。定向诱导组术后2、4、8、12 周SFI 高于模型组、普通细胞组;普通细胞组术后2、4、8、12 周SFI 高于模型组,差异均有统计学意义(均P<0.05)。见表2~3。
表2 假手术组和模型组术后2、4、8、12 周SFI 比较(%,,n=20)
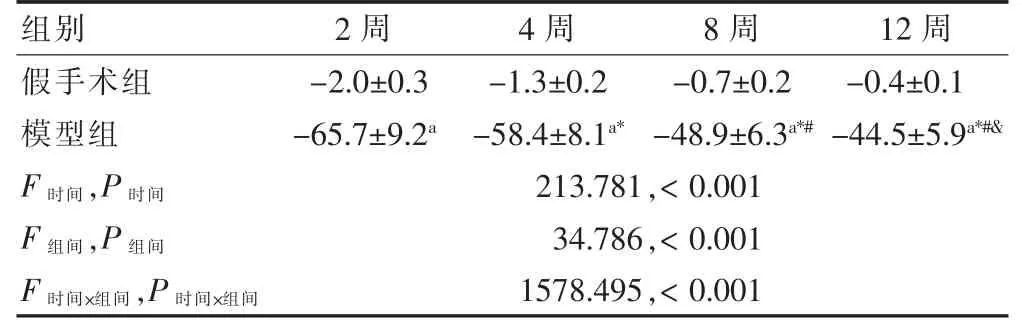
表2 假手术组和模型组术后2、4、8、12 周SFI 比较(%,,n=20)
注:与同组2 周比较,*P <0.05;与同组4 周,#P <0.05;与同组8 周,&P <0.05;与假手术组同期比较,aP <0.05。SFI:坐骨神经功能指数
表3 模型组、普通细胞组、定向诱导组大鼠在术后2、4、8、12 周SFI 结果(%,,n=20)
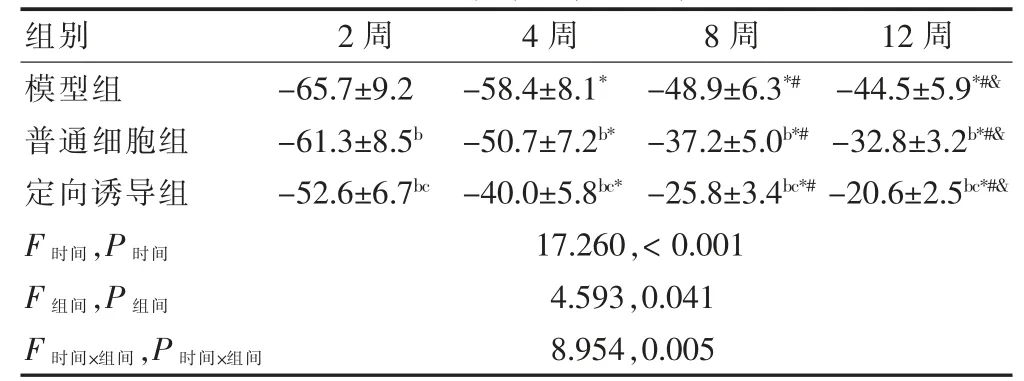
表3 模型组、普通细胞组、定向诱导组大鼠在术后2、4、8、12 周SFI 结果(%,,n=20)
注:与同组2 周比较,*P <0.05;与同组4 周,#P <0.05;与同组8 周,&P <0.05;与模型组同期比较,bP <0.05;与普通细胞组同期比较,cP <0.05。SFI:坐骨神经功能指数
2.5 四组术后2、4、8、12 周BBB 评分比较
整体比较:各组大鼠BBB 评分组间、时间及交互作用比较,差异均有统计学意义(均P<0.05)。组内比较:四组术后8 周、12 周BBB 评分高于术后2 周和4 周,差异均有统计学意义(均P<0.05);四组术后2 周和4 周BBB 评分比较,差异无统计学意义(P>0.05)。组间比较:模型组术后2、4、8、12 周BBB 评分低于假手术组,差异均有统计学意义(均P<0.05)。定向诱导组术后8、12 周BBB 评分高于模型组和普通细胞组;普通细胞组术后8、12 周BBB 评分高于模型组,差异均有统计学意义(均P<0.05)。见表4~5。
2.6 四组肌湿重恢复率比较
实验结束后,模型组大鼠肌湿重恢复率为(42.50±2.17)%,低于假手术组的(92.58±4.57)%,差异有统计学意义(P<0.05)。定向诱导组肌湿重恢复率为(65.78±3.36)%,高于普通细胞组的(52.45±3.34)%及模型组;普通细胞组肌湿重恢复率高于模型组,差异均有统计学意义(均P<0.05)。
表4 假手术组和模型大鼠术后2、4、8、12 周BBB 评分结果(分,,n=20)

表4 假手术组和模型大鼠术后2、4、8、12 周BBB 评分结果(分,,n=20)
注:与同组2 周比较,*P <0.05;与同组4 周,#P <0.05;与同组8 周,&P<0.05;与假手术组同期比较,aP<0.05。BBB:Bsso Beattie Bresnahan
表5 模型组、普通细胞组、定向诱导组大鼠术后BBB 评分结果(分,,n=20)

表5 模型组、普通细胞组、定向诱导组大鼠术后BBB 评分结果(分,,n=20)
注:与同组2 周比较,*P <0.05;与同组4 周,#P <0.05;与同组8 周,&P <0.05;与模型组同期比较,bP <0.05;与普通细胞组同期比较,cP <0.05。BBB:Bsso Beattie Bresnahan
2.7 四组BDNF、MBP 和GAP-43 蛋白表达比较
模型组BDNF、MBP 与和GAP-43 蛋白表达量低于假手术组,差异均有统计学意义(均P<0.05)。定向诱导组BDNF、MBP 和GAP-43 蛋白表达量高于模型组和普通细胞组;普通细胞组BDNF、MBP 和GAP-43 蛋白表达量高于模型组,差异均有统计学意义(均P<0.05)。见图5、表6。

图5 Western blot 法检测各组BDNF、MBP和GAP-43 蛋白表达差异
表6 Western blot 法检测各组BDNF、MBP和GAP-43 蛋白表达量(,n=20)
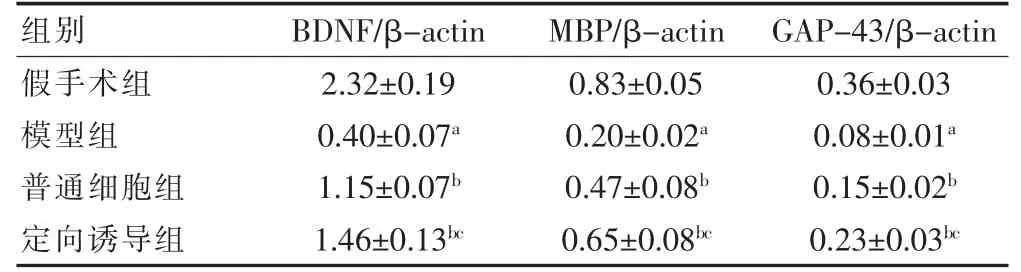
表6 Western blot 法检测各组BDNF、MBP和GAP-43 蛋白表达量(,n=20)
注:与假手术组,aP <0.05;与模型组,bP <0.05;与普通细胞组,cP <0.05。BDNF:脑源性神经营养因子;MBP:髓磷脂碱性蛋白;GAP-43:生长关联蛋白43
3 讨论
BM-MSCs 因其来源方便,能实现体外增殖和培养,同时又具有多向分化潜能,并且避免了伦理冲突[14],在临床上具有很大的疾病治疗潜力。其主要作用机制在于通过诱导神经营养因子的分泌,直接促进轴突生长,与靶细胞重新建立联系;或间接诱导星形胶质细胞活化,进而促进神经再生和修复[15];此外BM-MSCs也具备横向分化潜能,在神经营养因子诱导作用下,少部分BM-MSCs 在体内可分化为神经外胚层样细胞,但是仍有大部分BM-MSCs 分化为星形胶质细胞[16]。因此在应用BM-MSCs 时,体外成功将其定向分化的技术至关重要,这在很大程度上影响疾病的治疗效果。目前,国内外学者主要采用化学诱导法(β-巯基乙醇、全反式视黄酸)和Transwell 小室共培养法将BMMSCs在体外定向诱导分化成神经元样细胞[17]。本研究利用β-巯基乙醇,全反式视黄酸和Transwell 小室共培养3 种诱导方式诱导7 d 后,各组BM-MSCs逐渐向典型神经元的形态特征发生变化,提示3 种诱导方式都可以成功诱导BM-MSCs 向神经元样细胞表型转化,形成轴突和树突。但是通过免疫组化法检测不同诱导条件下神经元特异性烯醇化酶阳性表达率发现,β-巯基乙醇诱导分化组神经元特异性烯醇化酶阳性表达率高于其他三组(P<0.05),故而选择β-巯基乙醇定向诱导分化7 d 后的BM-MSCs 用于后续动物实验。
全反式视黄酸是维生素A 的主要活性代谢产物[18]。本研究结果显示,在3 种诱导方法下,全反式视黄酸诱导分化的神经元所占比例最低,与其在大鼠骨髓基质细胞的成骨分化作用中类似[19-20]。全反式视黄酸诱导分化骨髓间充质干细胞的作用原理可能与激活BMP 信号通路有关。其通过上调负责成脂分化的BMP 受体IA 的表达,从而促进骨髓间充质干细胞的成脂化,所以降低了向神经元样细胞的分化[21]。Transwell 小室共培养法是通过细胞与神经细胞之间的相互接触、相互支持的特异空间结构促进骨髓间充质干细胞分化为神经细胞。本研究中,Transwell 小室共培养法诱导分化的神经元比例较高,这可能是因为共培养中神经细胞分泌的各种细胞因子[22]、神经递质[23]等促进了BM-MSCs 向神经元样细胞的分化。共培养法的机制使骨髓间充质干细胞置于一种更接近人体的微环境中,诱导其向神经细胞分化。β-巯基乙醇是研究较早且较为成熟的一种分化诱导剂,通过提高胞质内抗氧化成分-谷胱甘肽的水平降低氧自由基的生成量以达到诱导细胞分化的目的[24]。关宁等[25]研究显示,β-巯基乙醇组神经元特异性烯醇化酶阳性率和微管相关蛋白分化率更高,说明相较于神经生长因子,β-巯基乙醇能够更好地促进BM-MSCs 向神经元样细胞分化。本研究结果显示,β-巯基乙醇通过提高神经分化标志物GFAP、NT3、MAP2、Tau、CXCR4、N200、NESTIN、UBIQUITIN、TUBULIN Ⅲ等特异性蛋白的表达量,刺激胞体和树突发育,提高神经元存活数量,与邻近的细胞间形成突触连接,进而形成稳定的神经元细胞。
此外本研究进一步通过大鼠实验证实,普通细胞组和定向诱导组大鼠运动功能较模型组大鼠明显改善,无论是注射BM-MSCs 还是注射神经元样向诱导分化的BM-MSCs,都具有恢复大鼠坐骨神经电生理学特性和拉伸力学性能的作用。而且坐骨神经损伤处神经生长相关因子(BDNF、MBP、GAP-43 蛋白)的表达水平明显升高。定向诱导组大鼠SFI 指数、BBB 评分、肌湿重恢复率高于普通细胞组(均P<0.05),提示BM-MSCs 可以向神经损伤点传递有助于功能恢复的关键信号,进而改变细胞行为或转移某些细胞因子以减轻损伤。而且神经元样定向诱导分化的BM-MSCs更有利于坐骨神经损伤的恢复。
综上,β-巯基乙醇可定向诱导BM-MSCs 向神经元样细胞分化,能够获得稳定的神经元细胞。在坐骨神经损伤处注射定向诱导为神经元样细胞的BMMSCs 具有明显的神经损伤修复作用,可促进神经元再生。从而证实利用成体干细胞(大鼠BM-MSCs)诱导神经元样定向分化作为一种简便的治疗方法用于周围神经系统疾病的可能性。
