三阴性乳腺癌组织亲嗜性病毒整合位点1和核转运蛋白基因2的表达及与临床病理特征和预后的关系
2021-03-26牛悦石磊张霆孙新增白建平
牛悦,石磊,张霆,孙新增,白建平
(中国人民解放军联勤保障部队第983医院 普外科,天津300142)
三阴性乳腺癌(three negative breast cancer,TNBC)是指雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受 体2(human epidermal growth factor receptor 2,HER2)表达均阴性的乳腺癌,占所有乳腺癌类型的12%~17%[1]。TNBC 是高侵袭性、异质性恶性肿瘤,恶性程度高,临床缺乏内分泌和靶向治疗药物,治疗后易复发,耐药患者预后差,是病死率最高的乳腺癌亚型[2]。因此,探讨与TNBC 的发生、发展、侵袭、转移等恶性行为相关的分子机制对改善患者的预后具有重要意义。亲嗜性病毒整合位点1(ecotropic virus integration site-1, EVI1)是一种原癌基因,具有双结构域的锌指转录因子,参与白血病细胞的分化、凋亡和增殖,在髓系白血病中高度表达[3]。核转运蛋白基因2(karyopherin-α2, KPNA2)是核转运蛋白家族的一员,参与多种肿瘤相关蛋白的核转运途径,在结直肠癌、乳腺癌、胃癌、肝癌等恶性肿瘤中过表达,与不良预后有关[4-5]。有关EVI1、KPNA2 在TNBC 的表达的报道较为少见,其是否与TNBC 高度侵袭性和不良预后有关尚不明确,鉴于此,本研究拟通过检测TNBC 患者癌组织、癌旁组织中EVI1、KPNA2 的表达,分析其与临床病理特征的关系,以探讨EVI1、KPNA2 在TNBC 恶性进展中的作用机制,为TNBC 的临床治疗和预后预测提供理论依据。
1 资料与方法
1.1 临床资料
选取2012年1月—2015年1月中国人民解放军联勤保障部队第983 医院收集的73 例TNBC 患者手术切除的癌组织、癌旁组织(距离癌组织>5 cm)及70 例正常乳腺组织(对照组)的石蜡标本。乳腺癌患者年龄46~63 岁,平均(55.23±7.31)岁;乳腺肿块直径0.62~3.56 cm,平均(2.13±0.34)cm;组织学分级:Ⅰ级20 例,Ⅱ级16 例,Ⅲ级37 例;淋巴结:N033 例,N1、N240 例;脉管内癌栓44 例;Ki-67低表达33 例,Ki-67 高表达40 例。对照组年龄42~60 岁,平均(54.35±3.15)岁,均为女性。纳入标准:①ER、PR、HER2表达阴性和/或荧光原位杂交HER2/Neu基因无扩增,经病理组织学诊断为TNBC;②病理类型均为浸润性导管癌;③病理资料完整,接受随访;④标本均来自女性患者,年龄≥18 岁。排除标准:①术前未进行化疗、放疗、免疫治疗;②男性患者;③Luminal 型、Her-2 型、Basal-like 型等其他类型乳腺癌;④有远处转移者。乳腺癌患者和对照组的年龄和性别比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,审批号[伦(审)S20121127]。
1.2 免疫组织化学方法检测EVI1、KPNA2的表达
标本在37℃避光下经3.7%中性甲醛溶液固定,石蜡包埋,制作4 μm厚切片,二甲苯中脱蜡,乙醇梯度水化,蒸馏水洗涤。108℃高压2 min,3%过氧化氢/甲醇溶液室温下阻断内源性过氧化物酶活性15 min,1%稀释正常马血清(购自北京太阳红科技有限公司)37℃下孵育30 min,阻断非特异性抗体结合,磷酸盐缓冲液(PBS)冲洗后加入EVI1 多克隆抗体、KPNA2 兔抗人多克隆抗体(均购自英国Abcam 公司),37℃孵育60 min,4℃冰箱孵育过夜。PBS 冲洗3 次加二抗,37℃孵育17 min,PBS冲洗3 次,链霉抗生物素蛋白-过氧化物酶(SP)(购自福建迈新生物技术开发公司)显色3~5 min,37℃孵育30 min,二氨基联苯胺(DAB)(购自福建迈新生物技术开发公司)显色3~5 min。再经苏木精复染、脱水、透明封固,光学显微镜随机选取5个高倍视野进行观察,放大倍数为400 倍。以PBS代替一抗为阴性对照。
1.3 结果评定
在双盲条件下,该院病理科2 位具有副主任职称的病理医师分别采用半定量法进行等级评定[6],胞浆和/或细胞核中的淡黄色至棕色颗粒被定义为阳性。随机从各组选择3 个切片,每个切片随机选取5 个高倍视野观察,先进行染色密度评分,阴性为0 分,弱阳性为1 分,中度阳性为2 分,强阳性为3 分。再进行阳性细胞百分比评分,阴性为0 分,<25%为1分,25%~<50%为2分,50%~<75%为3分,≥75%为4 分。染色密度评分与阳性细胞百分比评分的乘积为免疫反应评分(IRS),0 分为阴性(-),1~4 分为弱阳性(+),5~8 分为阳性(++),9~12 分为强阳性(+++)。
1.4 随访
患者均定期门诊复查,采用电话或微信随访,记录随访期间无进展生存时间(PFS)及总生存时间(OS)的生存率,PFS 指手术日起到肿瘤复发或转移或随访截止时间,OS 指手术日起到患者死亡或随访截止时间。复发、转移指经影像及病理证实的原发肿瘤局部或远处器官转移。
1.5 统计学方法
数据分析采用SPSS 25.0 统计软件,计数资料以构成比或率(%)表示,比较采用χ2检验,两两比较采用χ2分割法(检验水准α=0.013),Kaplan-Meier法绘制生存曲线,比较用Log-Rank χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 TNBC癌组织中EVI1、KPNA2的阳性表达
TNBC 癌组织中EVI1、KPNA2 表达位于细胞核或细胞质,阳性为淡黄色至棕色颗粒,见图1。

图1 EVI1、KPNA2在TNBC癌组织中的表达 (×400)
2.2 3组EVI1、KPNA2表达的比较
癌组织、癌旁组织和对照组EVI1、KPNA2 总的阳性表达率比较,差异有统计学意义(χ2=30.717和40.855,均P=0.000);进一步两两比较,癌组织中EVI1、KPNA2 阳性表达率高于癌旁组织和对照组(P<0.013),癌旁组织和对照组EVI1、KPNA2 阳性表达率比较,差异无统计学意义(P>0.013)。见表1。
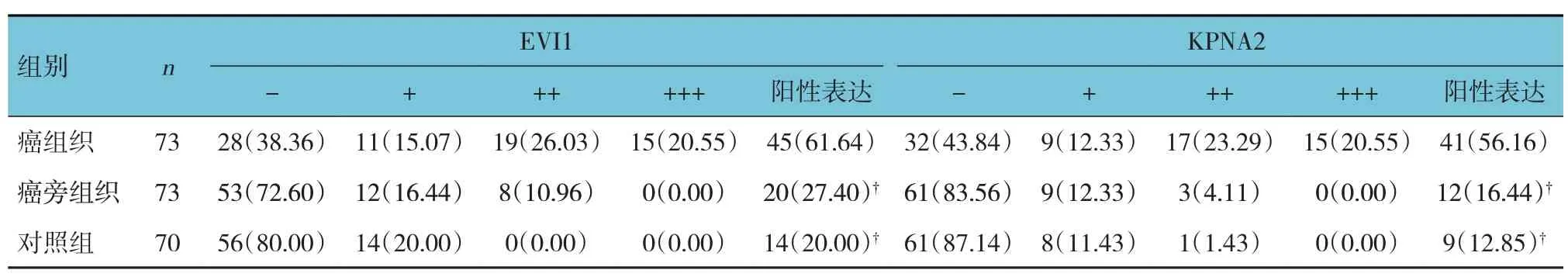
表1 TNBC癌组织、癌旁组织和对照组EVI1、KPNA2阳性表达率的比较 例(%)
2.3 不同临床病理特征的TNBC 患者的EVI1、KPNA2表达比较
如表2所示,不同年龄、乳腺肿块直径、分化程度的TNBC 患者的EVI1 阳性率比较,差异无统计学意义(P>0.05);不同组织学分级、淋巴结、Ki-67 表达、脉管内癌栓TNBC 患者的EVI1 阳性率比较,差异有统计学意义(P<0.05),其中,组织学分级Ⅲ级的TNBC 患者EVI1 阳性率高于Ⅰ+Ⅱ级的患者,淋巴结为N1、N2的TNBC 患者EVI1 阳性率高于无淋巴结转移患者,Ki-67 高表达的TNBC 患者EVI1 阳性率高于低表达者,有脉管内癌栓的TNBC 患者EVI1阳性率高于无脉管内癌栓患者。不同年龄、乳腺肿块直径、分化程度、组织学分级、Ki-67 表达、脉管内癌栓的TNBC 患者的KPNA2 阳性表达率比较,差异无统计学意义(P>0.05);淋巴结是否转移的TNBC 患者的KPNA2 阳性表达率比较,差异有统计学意义(P<0.05),淋巴结N1、N2患者的KPNA2 阳性表达率高于无淋巴结转移患者。

表2 不同临床病理特征的TNBC患者的EVI1、KPNA2阳性率的比较
2.4 不同EVI1、KPNA2 表达TNBC 患者的生存率比较
所有患者均完成随访,随访时间最短60 个月,最长96 个月,中位随访时间82 个月。Kaplan-Meier生存曲线分析显示,EVI1 阳性表达者PFS 生存率为35.56%(16/45),低于EVI1阴性表达者67.86%(19/28)(χ2=6.843,P=0.009),EVI1阳性表达者OS生存率为77.78%(35/45),低于EVI1阴性表达者96.43%(27/28)(χ2=4.688,P=0.031)。KPNA2 阳性表达者PFS 生存率为36.59%(15/41),低于KPNA2阴性表达者62.50%(20/32)(χ2=4.836,P=0.028),KPNA2阳性表达者OS生存率为75.61%(31/41),低于KPNA2阴性表达者的96.88%(31/32)(χ2=5.387,P=0.021)。见图2、3。

图2 不同EVI1、KPNA2表达TNBC患者的PFS生存曲线

图3 不同EVI1、KPNA2表达TNBC患者的OS生存曲线
3 讨论
乳腺癌是严重威胁女性健康和生命安全的恶性肿瘤,是全世界发病率最高的女性恶性肿瘤[7]。不同类型乳腺癌临床和分子生物学特征不同,治疗反应性、预后也不尽相同。TNBC 因异质性和缺乏治疗靶点,临床治疗效果差,是所有乳腺癌类型中预后最差的分子分型之一[8-9],明确分子亚型和靶向抑制是阻止TNBC 恶性进展,提高患者生存率的关键和必要条件。探讨与TNBC 恶性进展相关的分子机制有助于完善临床治疗方法,为预后评估提供可靠信息。
EVI1 是癌基因转录因子,位于染色体3q26 上,包含2 个DNA 结合锌指结构域,一个结合GATA 样基序,另一个结合v-ets 红细胞增多症病毒E26 癌基因同源性样基序(E26 transformation-specific sequence,ETs)。EVI1 通过与C 末端结合域、cAMP 反应元件结合蛋白和p300/CBP 相关因子等转录调控因子相互作用调控靶基因表达[10]。EVI1 可抑制转化生长因子β 信号并激活Notch 信号促使造血干细胞向主动脉内皮细胞转化[11]。EVI1 在髓系白血病、多形性胶质母细胞瘤、幕下室管膜瘤等实体肿瘤中异常表达,EVI1 高度表达与较短生存期、肿瘤药物耐药有关,下调EVI1 表达能抑制肿瘤细胞生长[12-13]。本研究发现,EVI1 在TNBC 癌组织中阳性表达率高于癌旁组织和正常乳腺组织,提示EVI1 可能参与TNBC 发病机制。文献[14]指出EVI1 通过调控乳腺癌干细胞增殖过程参与乳腺癌细胞迁移、侵袭和上皮间质转化等过程,促进乳腺癌发生和恶性进展。本研究进一步分析不同临床病理特征的TNBC 患者的EVI1 表达发现,不同组织学分级、淋巴结、Ki-67表达、脉管内癌栓TNBC患者的EVI1阳性表达率比较,差异有统计学意义,即EVI1 表达越高,TNBC 组织学分级越高,Ki-67表达越高,发生淋巴结转移和脉管内癌栓的可能性越大,说明EVI1表达与TNBC恶性程度、侵袭转移有关,可能与EVI1诱导TNBC癌症干细胞过度活化有关,提示EVI1在TNBC发病机制中发挥致癌基因作用。Kaplan-Meier 生存曲线分析EVI1 阳性表达患者PFS生存率、OS生存率均低于EVI1阴性表达患者,说明EVI1阳性表达与TNBC不良预后有关。一项荟萃分析显示高EVI1表达与急性髓系白血病患者较短OS[H^R=1.73,95% CI:(1.43,2.11)]和无事件生存率[H^R=1.17,95% CI:(1.05,1.31)]相关[15]。本研究结果提示EVI1可作为TNBC恶性进展和不良预后的辅助诊断指标,抑制EVI1表达可能阻止TNBC恶性进展。
KPNA2 位于染色体17q23-q24,由N 端亲水性结构域、短C 端和中心区域组成,中心区域有2 个核定位信号结合位点,能够与具有特异性核定位信号的入核蛋白结合,对细胞功能相关mRNA 和转录因子进出细胞核提供空间定位作用,在细胞增殖、分化等生理过程中发挥重要作用[5]。KPNA2 还通过参与细胞分化、增殖、凋亡、免疫应答和病毒感染等促进肿瘤的形成和发展,在肝癌、胰腺癌、大肠癌等肿瘤中高度表达,与癌细胞增殖、迁移和不良预后有关[4,16-17]。KPNA2 作为miR-26a/b新靶点,通过雌激素/c-Myc/miR-26b 轴介导的雌激素刺激细胞生长而控制雌激素水平,促进乳腺癌细胞增殖[18]。KPNA2 在TNBC 的表达和作用机制尚不十分清楚,本研究发现KPNA2 在TNBC 癌组织中呈高度表达,阳性表达率达56.16%,高于癌旁组织和正常乳腺组织;淋巴结是否转移的TNBC 患者的KPNA2 阳性表达率比较,差异有统计学意义,可能与KPNA2 对关键核蛋白的异常定位导致癌细胞侵袭、增殖和转移有关。ALSHAREEDA[19]检测1 494例乳腺癌患者KPNA2 表达情况,发现KPNA2 在ER阴性和三阴性表型乳腺癌患者中表达明显升高,认为高KPNA2 表达与细胞质定位功能、核蛋白低表达有关。近期报道显示KPNA2 过度表达提高乳腺癌MCF-7 细胞侵袭和迁移能力,KpNa2 缺失可下调LoxL2、BMP6、ITGA6 等肿瘤转移相关基因表达,抑制肿瘤进展,KPNA2 在乳腺癌转移中具有重要作用[20]。本研究通过Kaplan-Meier 生存曲线分析发现KPNA2 阳性表达与TNBC 患者低PFS 生存率、低OS 生存率有关,ALSHAREEDA[19]在对乳腺癌患者长期随访中发现,KPNA2 高表达乳腺癌患者无病生存率偏低,AL-KAABI 等[21]指出KPNA2 高表达与接受环磷酰胺、甲氨蝶呤和氟尿嘧啶化疗的ER 阴性和TNBC 患者较短生存期有关。
综上所述,TNBC 患者EVI1、KPNA2 均呈高表达,其阳性表达与TNBC 患者恶性侵袭行为和不良预后有关,可以作为TNBC 患者病情评估和预后预测的辅助指标。鉴于EVI1、KPNA2 在TNBC 疾病进展中的作用,抑制EVI1、KPNA2 表达可能成为临床治疗TNBC 新的靶点和方向。
