极低、超低体重早产儿医院感染变化及其危险因素分析*
2021-03-26黄碧茵谭宝莹许小慧郭青云关浩锋司徒娉婷王方方左雪梅刘郴州
黄碧茵,谭宝莹,许小慧,郭青云,关浩锋,司徒娉婷,王方方,左雪梅,刘郴州
[江门市中心医院(中山大学附属江门医院)新生儿重症监护室,广东 江门529070]
早产儿医院感染可致早产儿病死率、近远期并发症和住院时间、住院费用显著升高[1]。控制及减少早产儿医院感染是早产儿救治成功的关键。为探讨近极低、超低体重早产儿医院感染变化趋势及危险因素,更有效降低早产儿医院感染的发生率,本研究对5年间极低、超低出生体重早产儿的临床资料进行回顾性分析,现报道如下。
1 资料与方法
1.1 研究对象
选取2014年1月—2018年12月入住广东省中山大学附属江门医院新生儿重症监护病房的极低体重早产儿(出生体重1 000 g~<1 500 g)和超低体重早产儿(出生体重<1 000 g)共354 例,排除生后7 d 内发病即早发型败血症者(宫内感染/母亲垂直传播)并剔除住院时间不满7 d 者51 例后,共303例极低、超低体重早产儿纳入研究。其中,男性168例,女性135 例,男∶女为1.24∶1.00,入院时胎龄26+1~33+2周,出生体重740~1 495 g。
1.2 方法
所有患儿均符合新生儿医院感染的诊断依据[2]。呼吸机相关性肺炎(ventilator associated pneumonia,VAP)是机械通气48 h 后至拔管48 h 内出现的肺部感染或新的肺部感染。导管相关性血流感染(catheter related blood stream infection,CRBSI)是带有血管内导管或拔除血管内导管48 h内的患者出现菌血症或真菌血症,至少一项外周静脉血培养细菌或真菌阳性,并有相应的感染表现,除血管内导管外没有其他明确的感染源。VAP发生率=使用呼吸机患儿中肺部感染人数/患儿使用呼吸机总时间×100%。CRBSI发生率=中心静脉置管患儿中血流感染人数/中心静脉置管总时间×1000‰。败血症诊断标准:出现感染中毒症状及血培养阳性或血培养阴性但非特异性检查包括白细胞计数、白细胞分类、C反应蛋白、血清降钙素原、血小板计数中≥2项出现异常。
研究对象按年份分为2014年组、2015年组、2016年组、2017年组和2018年组,且以每年12月31日前出院划分归入当年度组。每年组又分为感染组和非感染组。比较5年组间早产儿医院感染例数率、例次率及感染疾病发病率、感染组与非感染组临床特征、病原菌和耐药菌的变化并分析其危险因素。
1.3 统计学方法
数据分析采用SPSS 16.0 统计软件,计量资料以均数±标准差(±s)或中位数(下四分位数,上四分位数)[M(P25,P75)]表示,比较采用方差分析或秩和检验;计数资料以例(%)或率表示,比较采用χ2检验;P<0.05 为差异有统计学意义。影响因素的分析采用多因素Logistic回归模型。
2 结果
2.1 5年组早产儿医院感染发生率及感染疾病发生率
5年组早产儿医院感染例数、医院感染例次及感染疾病[败血症、细菌性脑膜炎、CRBSI、血培养阳性、VAP、泌尿道感染、新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)、急性结膜炎、脐炎]发病率比较,差异均无统计学意义(P>0.05)。见表1。

表1 5年组早产儿医院感染例数、感染例次及感染疾病发病率
2.2 5年各感染组早产儿的临床特征比较
5年各感染组早产儿的肠外营养(PN)时间、外周中心静脉导管(PICC)置管时间和出生后3 代头孢菌素应用率比较,差异有统计学意义(P<0.05),而性别、胎龄、出生体重、住院时间、气管插管时间和有创呼吸机应用率、窒息率、脐静脉置管(UVC)率、死亡/自动出院率比较,差异均无统计学意义(P>0.05)。进一步两两比较,PN 时间和PICC 置管时间2017年感染组、2018年感染组均比2014年感染组、2015年感染组、2016年感染组延长(P<0.05);出生后3 代头孢菌素应用率2017年感染组比2014年感染组增多(P<0.05),2018年感染组比2014年感染组、2015年感 染 组和2016年感 染 组增多(P<0.05)。见表2。
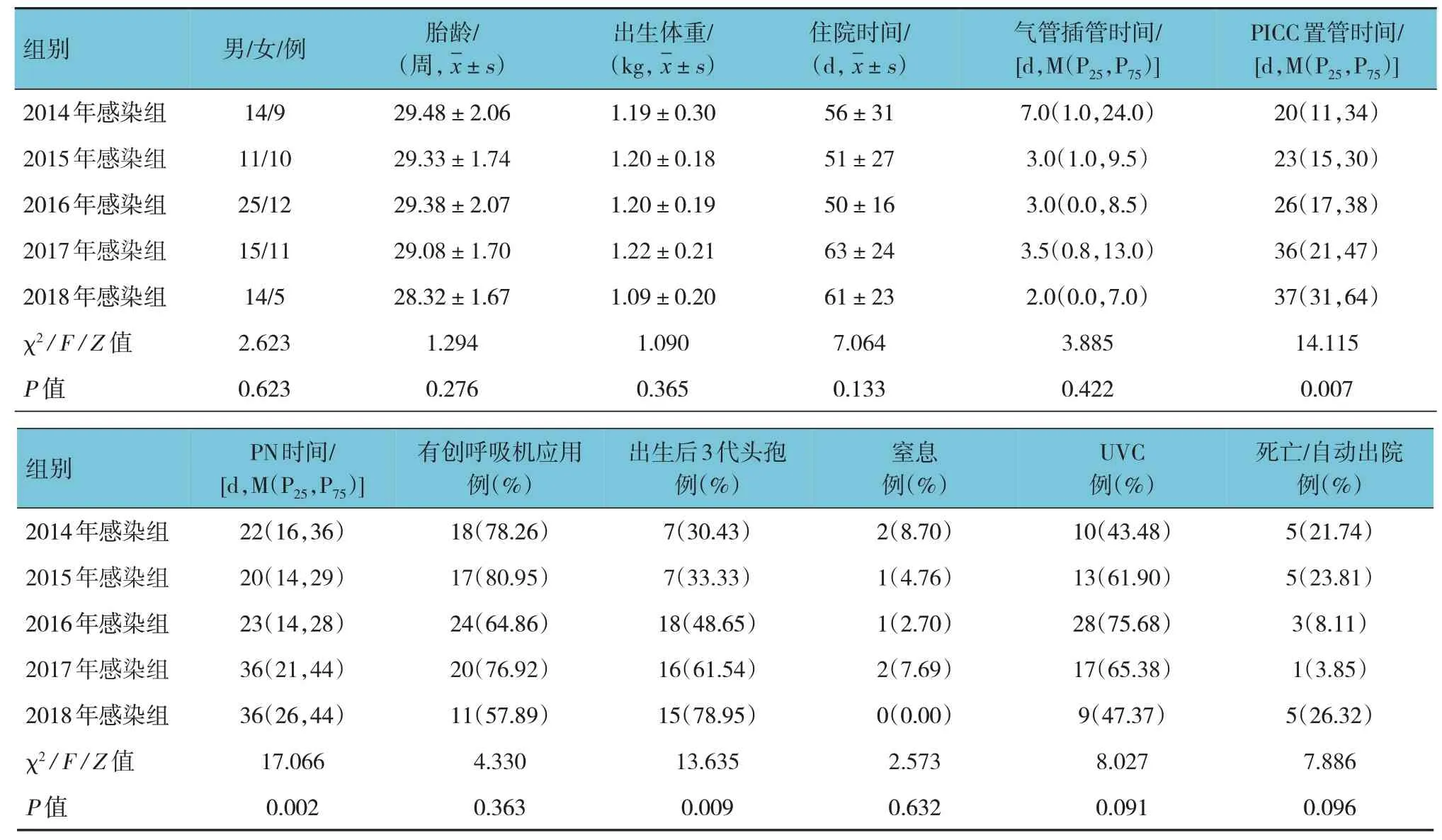
表2 5年各感染组早产儿的临床特征比较
2.3 5年各非感染组早产儿的临床特征比较
5年各非感染组早产儿的胎龄、气管插管时间和有创呼吸机应用、出生后3代头孢菌素应用和UVC比较,差异有统计学意义(P<0.05),而性别、出生体重、住院时间、PICC置管时间、PN时间、窒息和死亡/自动出院比较,差异无统计学意义(P>0.05)。进一步两两比较,2016年非感染组胎龄小于2015年和2017年非感染组(P<0.05),2018年非感染组胎龄小于2017年非感染组(P<0.05);气管插管时间2016年非感染组长于其他4年非感染组(P<0.05);有创呼吸机应用2016年非感染组高于2014年、2015年、2018年非感染组(P<0.05);出生后3 代头孢菌素应用2016年、2017年、2018年非感染组多于2014年和2015年非感染组(P<0.05);UVC率2016年非感染组多于2014年、2017年、2018年非感染组(P<0.05)。见表3。

表3 5年各非感染组早产儿的临床特征比较
2.4 5年各感染组早产儿常见病原菌及耐药菌种类及其构成比的比较
5年各感染组早产儿常见病原菌以肺炎克雷伯杆菌(22.58%~37.93%)及大肠埃希氏菌(6.90%~25.00%)居多,其余常见病原菌的种类及其构成比的比较见表4。其中,5年各感染组的人葡萄球菌构成比比较,差异有统计学意义(P<0.05),2018年比前4年增多。耐药菌的种类及其构成比的比较见表5。肺炎克雷伯菌、大肠埃希氏菌、鲍曼不动杆菌、铜绿假单胞菌、嗜麦芽假单胞菌、阴沟肠杆菌和沙雷菌均以革兰阴性杆菌计算。其中超广谱β 内酰胺酶(ESBL)构成比为每年细菌培养ESBL 例数/每年革兰阴性杆菌总数,耐碳青霉烯类杆菌(CR)构成比为每年细菌培养CR 例数/每年革兰阴性杆菌总数。无乳链球菌、头状葡萄球菌、表皮葡萄球菌、溶血葡萄球菌、粪肠球菌、人葡萄球菌、沃氏葡萄球菌、金黄色葡萄球菌均以革兰阳性球菌计算。其中耐甲氧西林金黄色葡萄球菌(MRSA)构成比为每年细菌培养MRSA 例数/每年革兰阳性球菌总数。5年各感染组的ESBL、MRSA、CR 构成比的比较,差异均无统计学意义(P>0.05)。

表4 5年各感染组常见病原菌种类及其构成比的比较 例次(%)

表5 5年各感染组耐药菌种类及其构成比的比较例次(%)
2.5 感染组与非感染组的临床特征比较
感染组和非感染组性别、出生体重、胎龄、气管插管、PICC 置管时间、住院时间、白蛋白水平、出生后3 代头孢菌素应用、有创呼吸机、UVC、PICC 比较,差异有统计学意义(P<0.05),感染组气管插管时间、PICC置管时间、PN时间和住院时间均高于非感染组,白蛋白水平低于非感染组。两组窒息和球蛋白水平比较,差异无统计学意义(P>0.05)。见表6。
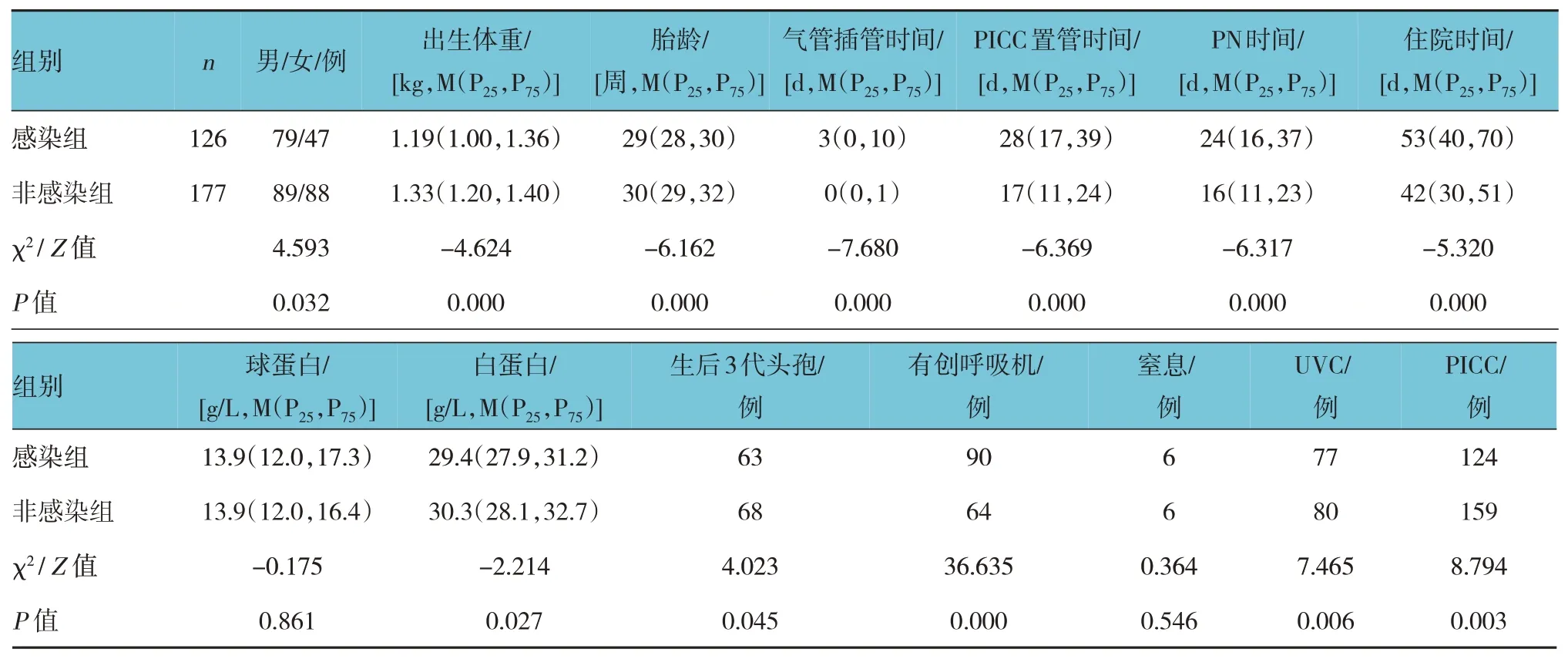
表6 感染组与非感染组的临床特征比较
2.6 极低、超低体重早产儿发生医院感染危险因素的Logistic回归分析
采用Logistics逐步回归法(向前选择法),以医院感染为因变量,以感染组与非感染组临床特征比较有统计学意义的因素为自变量(性别:男=1,女=0;出生体重:<1 000 g=1,1 000~1 500 g=0;有创呼吸机:是=1,否=0;UVC:是=1,否=0;PICC:是=1,否=0;应用3代头孢:是=1,否=0;胎龄、气管插管时间、住院时间、PN时间、PICC置管时间、白蛋白水平均采用原始数值),进行回归分析,α入=0.05,α出=0.10,结果:出生体重<1 000 g [=2.539(95% CI:1.101,5.856)]、有创呼吸机[=1.952(95% CI:1.056,3.610)]、气管插管时间[=1.089(95% CI:1.019,1.164)]和PICC 置管时间[=1.034(95%CI:1.011,1.057)]均是极低、超低体重早产儿发生医院感染的独立危险因素(P<0.05)。见表7。
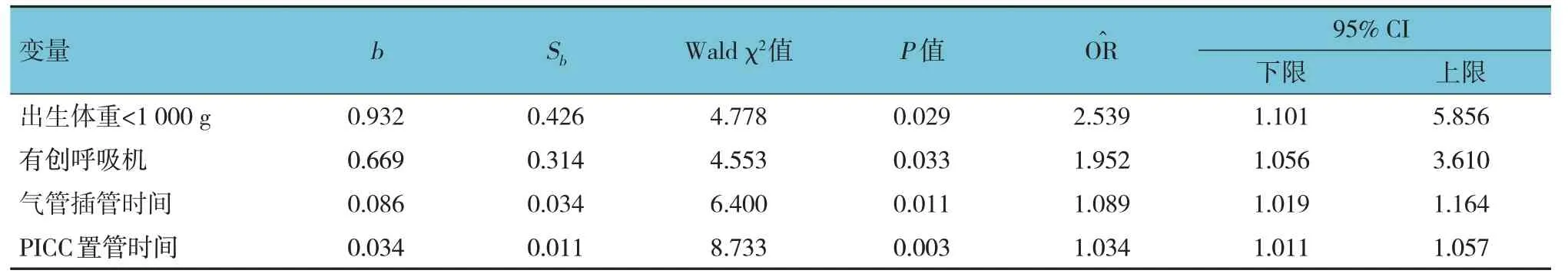
表7 早产儿医院感染危险因素的Logistics回归分析参数
3 讨论
3.1 一般数据分析
本研究5年间早产儿医院感染率为33.3%~48.1%,败血症发生率47.2%~54.5%,血培养阳性率为29.4%~85.7%,VAP和CRBSI分别是1.97%~5.59%和0.0‰~3.4‰,与国内报道[3]相仿。相关综述指出[4]可疑的脓毒血症与阳性血培养结果关系并不密切。有研究表明[5]12年间<32 周的1 402 个早产儿中662 例发生感染途径未知,最终通过尿液分析诊断泌尿道感染高达11.3%,提示晚发型败血症应常规行尿液检查。本研究2017年感染组和2018年感染组早产儿PN 时间、PICC 置管时间较2014年感染组、2015年感染组、2016年感染组延长,提示该院NICU 对医院感染的防控可见成效,而不单一从感染率等指标体现。国外统计2007~2012年CRBSI 从4.9‰降至1.5‰[6],部分中心降至零[7]。该院NICU 统计数据约3‰,且近年来有下降趋势,2018年降为零。
3.2 抗生素应用率变化
本研究显示早产儿2017年和2018年3 代头孢菌素应用率上升。抗生素扰乱早产儿肠道的微生物体系和耐药基因组[8],早期经验性延长应用抗生素使早产儿晚发型败血症、NEC 和死亡率风险增加[9]。但有关NICU 25年的研究[10]显示,头孢菌素的耐药率并没有因严格控制抗生素而减少,提示抗生素的耐药性相关因素较复杂。
3.3 有创通气和插管时间变化
气管插管-表面活性物质-拔管(INSURE)、微创表面活性物质治疗(MIST)和微创表面活性物质注入(LISA)及无创通气的应用,大大减少医院感染的潜在风险。本研究发现,2018年无感染早产儿胎龄更小、有创呼吸机支持减少、气管插管时间减少,均受益于无创通气技术的广泛开展。
3.4 病原菌变化,细菌定植
本研究5年肺炎克雷伯杆菌和大肠埃希菌为早产儿医院感染的主要病原菌,且ESBL 和MRSA 的感染率均超过50%,2018年更分别高达80%和82%。可能因近年来应用3 代头孢菌素增多。国外报道肺炎克雷伯杆菌、葡萄球菌、沙雷氏菌和肠杆菌属是医院感染爆发的主要菌群,尤其是产ESBL 的肠杆菌跟NICU 显著病死率相关[11]。常见病原菌[12]如肠球菌、肠杆菌、金黄色葡萄球菌、肺炎克雷伯杆菌引起暴发血源性感染的风险类似,而铜绿假单胞菌或沙雷氏菌虽致早产儿血源性感染十分少见,但引起暴发血源性感染的风险升高。本研究发现2017年沙雷菌3 例均同期发生,故应高度重视NICU 的监管和控制措施。国内研究报道<1 500 g 早产儿中阴性杆菌占其医院感染的54%[1],对β 内酰胺酶和碳青霉烯类耐药仅对喹诺酮类敏感,铜绿假单胞菌为最常见的一种。超早早产儿中医院感染88.22%是阴性杆菌,肺炎克雷伯杆菌最为常见,ESBL 占90.91%[3]。定植菌可能导致医院感染的发生。研究发现[13],34%母亲定植葡萄球菌,其分娩的婴儿72 h 后葡萄球菌定植率为42.6%,1 个月后上升为69.7%。该研究中胃液培养阳性考虑定植而发展为侵入性感染的病例并不少见。早产儿肠道定植细菌是新生儿室和患儿微生物交换的循环部分,如表皮葡萄球菌、粪肠球菌、铜绿假单胞菌等。基因证据显示,新生儿室成为住院早产儿微生物早期移植的储藏所,这可以解释为何相隔数年在同一新生儿室住院的早产儿仍可能感染同一菌株[14]。而从皮肤、直肠、呼吸道、泌尿道拭子检查流行性真菌定植率达68%[15],证明早产儿定植菌在院内传播起作用。
3.5 危险因素分析
本研究显示出生体重<1 000 g、有创呼吸机、气管插管时间和PICC 置管时间是极低、超低体重早产儿医院感染的独立危险因素。有文献报道超早早产儿[3]、早发型感染、PICC置管时间、激素应用和PN时间[1]是早产儿医院感染的高危因素,缩短上机时间、PICC 置管时间和住院时间可减少医院感染率[3]。PICC 通过破坏皮肤屏障和多种微生物形成生物膜,提高院内感染的风险[16]。多管腔的注射通路被测试是否有效[17]。正确的管端位置、密闭的注射通路、皮肤及管道换药和及早拔管可降低CRBSI的发生率[18]。文献报道早产儿、低出生体重儿、长期住院、侵入性操作和并发症是新生儿院内肠源性感染的独立危险因素[19]。早产儿中UVC 作为载体,通过生物膜的形成使皮肤微生物菌群传播至血流,且与抗生素的应用和置管时间并无相关[20]。本研究显示感染组较非感染组早产儿UVC更高,白蛋白水平更低。
3.6 国内外相关最新预防措施
雷尼替丁在新生儿的应用会提高感染风险和死亡率,但对NEC发生无影响[21]。乳酸菌属、嗜酸乳杆菌、双歧杆菌和鼠李糖乳杆菌可降低27~32 周早产儿NEC(大于二期)、晚发型败血症和死亡率风险[22]。益生菌可降低低收入及发展中国家早产儿NEC 和迟发型败血症的发病率及死亡率[23]。但当肠道屏障受损时培菲康会使肠道损伤恶化[241]。公认的措施包括[25]:手卫生、基于酒精成分的手部消毒杀菌剂和母乳喂养,而外源性添加球蛋白并不能有效降低医院感染。本研究中球蛋白的水平在感染组与非感染组比较差异无统计学意义。而球蛋白作为已确诊败血症的极低体重早产儿辅助疗法是安全有效[26]。口咽初乳尝试对营养和免疫方面的益处未得到证实[27]。该院NICU 从留置PICC 开始至拔管采用氟康唑的预防疗法[28],每周2 次,3 mg/(kg·次),5年仅2例真菌感染。NICU内真菌的监督培养有利于监控真菌流行性和有效降低真菌定植发展为侵入性感染的风险[15]。预防疗法有效降低新·生儿室念珠菌属的定植及系统性感染而不会引起耐药真菌菌株的发生[29]。呼吸道合胞病毒、流感和副流感病毒及鼻病毒、肠道病毒已成为重要的早产儿医院感染病原体[30]。
综上所述,广东省地级市医院新生儿室近5年早产儿医院感染率未见减少。胎龄更小、无创通气支持成为新趋势。提高出生体重、减少有创呼吸机使用、缩短气管插管时间和PICC 置管时间,可降低早产儿医院感染发生率。
