常规超声、超微血管成像和超声造影诊断颈动脉狭窄的对比研究*
2021-03-26王华李天天
王华,李天天
(1.郑州大学附属洛阳中心医院 超声科,河南 洛阳471000;2.新乡医学院,河南 新乡453303)
近年来,脑血管疾病的发病率随着全球老龄化程度的增加不断上升,对医疗保健造成极大负担[1]。有研究认为,缺血性脑血管病的发生风险与血管狭窄或闭塞存在一定的相关性[2]。颈动脉狭窄是诱发心脑血管疾病的主要因素之一,约占7%缺血性脑卒中[3]。对无症状患者实施临床干预措施能够有效减少脑卒中的风险,具有重要的临床意义。在颈动脉狭窄率为50%~99%的患者中,8%~15%患者会在标志性症状出现的72 h 内出现脑梗死[4]。尽早评估无症状患者管腔狭窄程度,可筛查识别有心血管疾病和中风风险的患者,从而进行早期干预治疗。
快速发展的现代医学影像学在颈动脉狭窄的诊断中获得突破性进展。包括二维超声、计算机体层摄影血管造影(computed tomography angiography, CTA) 和磁共振血管成像(magnetic resonance angiography, MRA)在内的无创诊疗技术不仅为血管病变诊断提供可靠的依据,而且能够指导临床用药及疗效评估[5]。传统的数字减影血管造影(digital subtraction angiography, DSA)是诊断颈动脉狭窄的金标准[6],然而这种有创的诊断方法存在0.1%~0.5%的脑卒中风险。二维超声由于其低辐射、无创等特点得到了广泛应用,但该方法对颈动脉狭窄的敏感性和特异性并不高,往往需要第2 次检测来证实。CTA 能够提供颈动脉病变的详细信息,但也存在辐射暴露和使用碘化对比剂的风险。MRA 对重度颈动脉狭窄的治疗效果优于二维超声技术,但是MRA 增强对狭窄程度评估的特异性不足[7]。因此,临床上需要寻求一种无创、经济、安全可靠、操作简便、准确率高的检测方法,为脑血管疾病风险的评估提供参考依据。
随着医学影像学的发展,超微血管成像(superb microvascular imaging, SMI)和超声造影(contrast-enhanced ultrasound, CEUS)技术广泛用于颈动脉斑块筛查及评估颈动脉斑块的稳定性[8]。SMI 是基于彩色多普勒原理基础上发展起来的一种超声血流显像技术,采用自适应计算方法,能够有效去除组织运动伪像,较传统彩色血流显像技术有更高敏感性及分辨率,能更敏感地捕捉真实低速血流[9]。CEUS 技术广泛用于动脉粥样硬化斑块新生血管的诊疗,通过造影剂来检测患者斑块内新生血管的分布及走行,能够定量评估诊断效果,具有很高的敏感性,对脑血管病变评估具有较好的临床诊断价值[10]。
目前,国内外尚未见SMI 和CEUS 诊断颈动脉狭窄程度的对比研究。本研究通过对比分析常规超声、SMI 和CEUS 对颈动脉狭窄程度的诊断价值,旨在寻求一种更具有临床推广意义的脑血管相关疾病的诊断方法。
1 资料与方法
1.1 研究对象
选取2018年1月—2018年12月因颈动脉、锁骨下动脉、椎动脉重度狭窄或闭塞在郑州大学附属洛阳中心医院住院的患者100 例。所有患者行颈动脉DSA 检测,再进行常规超声、SMI 及CEUS 检查。其中,男性56 例,女性44 例;年龄39~77 岁,平均(56.2±10.6)岁。研究经医院的医学伦理委员会批准(审批号:2020-07-13),家属均签署知情同意书。
1.2 纳入和排除标准
1.2.1 纳入标准①常规超声诊断颈动脉、锁骨下动脉、椎动脉重度狭窄或闭塞患者。②年龄>18岁。③签署颈动脉超声造影检查知情同意书。
1.2.2 排除标准①严重心、肝及肾功能不全者。②意识不清不能配合检查者。③有超声造影剂使用禁忌证患者,包括已知对六氟化硫或造影剂其他组份有过敏史;近期急性冠脉综合征或临床不稳定性缺血性心脏病;正渐变或进行性心肌梗死;过去7 d 内心脏症状出现明显恶化;刚接受冠状动脉介入手术或其他提示临床不稳定的因素;急性心力衰竭,心功能Ⅲ级、Ⅳ级及严重心律紊乱;伴有右向左分流的心脏病、重度肺动脉高压(肺动脉压>90 mmHg)、未控制的系统高血压及成人呼吸窘迫综合征;孕妇及哺乳期妇女。
1.3 仪器设备
采用日本东芝Aplio500 彩色超声诊断仪,线阵探头,频率4~11 MHz;SMI 检查的参数设置:1.50,深度3~5 cm;超声造影机械指数为0.07,动态范围为65 dB,帧频为10 fps。
1.4 方法
常规超声检查筛选颈动脉、锁骨下动脉、椎动脉重度狭窄或闭塞患者,并同时行SMI 检查及CEUS 检查。以DSA 为金标准,将常规超声检查、SMI 及CEUS 检查结果与DSA 结果进行对比分析。所有检测图像均由2 位神经科主任医师在不知任何临床信息的前提下,独立完成阅片,有不同意见时相互讨论并得出结论,计算研究对象的颈动脉狭窄程度。
1.4.1 DSA 检测采用德国西门子公司Artist.zee数字血管造影机,通过Sedinger 穿刺技术行右侧股动脉穿刺,插5 F 造影导管,在影像示踪图及超滑导丝引导下,导入双侧锁骨下动脉,行常规双侧颈总动脉、颈内动脉及双侧椎动脉血管造影。多角度显示狭窄处颈动脉血管,采集并重建图像。
1.4.2 常规超声检测选用日本东芝Aplio 500 超声诊断仪,探头频率为4~9 MHz,具备SMI 及CEUS 功能。患者取低仰卧位,先采用常规超声长轴和短轴扫查双侧颈总动脉及颈内动脉,双侧锁骨下动脉、双侧椎动脉的起始段,记录超声图像上血管狭窄部分的形态、内径及远端正常血管直径,计算狭窄率。
1.4.3 SMI 检测进行常规超声检查后,启动对狭窄部位内新生血管形成更为敏感的mSMI 模式。将探头固定在动脉斑块最厚处,在此切面检测斑块内的增强情况即低速血流显像,设置参数,持续观察并记录血管狭窄部位的低速血流信号。记录狭窄血管的位置、形态、内径及远端正常血管直径,并计算狭窄率。
1.4.4 CEUS 检测在各血管狭窄处固定探头,启动CEUS模式,设置参数:MI 0.15,深度3~5 cm,频率2~3.7 MHz。采用六氟化硫微泡作为造影剂,按比例配制Sono Vue 混悬液,混匀后,通过管针将2~3 ml 造影剂经肘正中静脉推注,随后注入3 ml生理盐水冲洗,观察并记录察颈动脉腔内造影剂显影效果。采用定量分析软件分析斑块内造影感兴趣区域,准确测量狭窄血管内径及远端正常血管直径,并计算狭窄程度。
1.5 血管狭窄程度的评价标准
根据北美症状性颈动脉内膜切除术试验协作组的NASCET 法来计算狭窄率[11],狭窄率(%)=(1-最狭窄处管腔直径/狭窄远端正常血管直径)×100%。依据狭窄率将颈动脉狭窄分为轻度狭窄(<30%)、中度狭窄(30%~<70%)、重度狭窄(70%~<100%)和闭塞(100%)。
1.6 统计学方法
数据分析采用SPSS 17.0 统计软件。以DSA 为金标准,用Cohen's Kappa 系数进行检查方法的一致性检验;狭窄程度的一致性采用Kappa 检验:κ ≥0.75 表明一致性好;κ 0.40~<0.75 表明一致性良好;κ <0.40 表明一致性差;3 种检查方法的敏感性、特异性及准确性比较,用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 二维超声与DSA诊断颈动脉狭窄程度
常规超声与DSA 诊断颈动脉狭窄情况见表1,经Kappa 检验,2 种检查方法诊断颈动脉不同程度狭窄的一致性较好(κ=0.862,P=0.042)。常规超声诊断颈动脉重度狭窄及闭塞(以>70%为切点)的敏感性为90.0% (95% CI:0.86,0.94),特异性为94.0%(95%CI:0.91,0.97),准确性为90.0%。
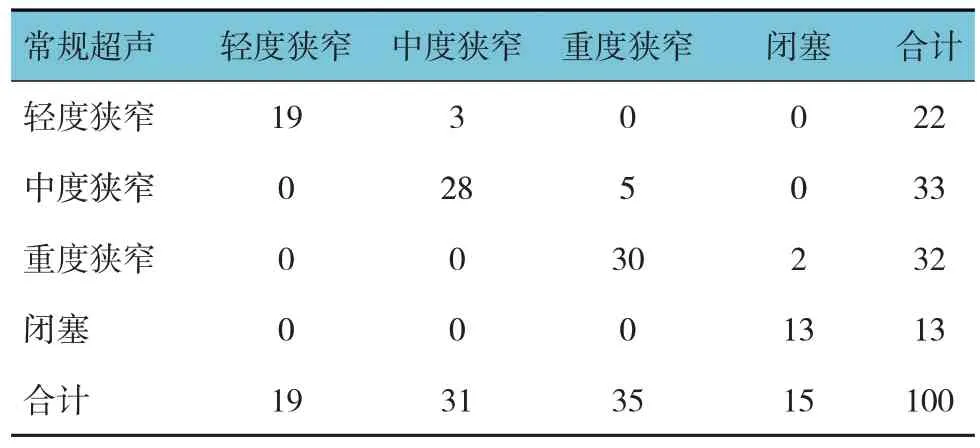
表1 常规超声与DSA诊断颈动脉狭窄的一致性比较 例
2.2 SMI与DSA诊断颈动脉狭窄程度
以DSA 诊断为金标准,对颈动脉狭窄程度的诊断进行组间比较,2 种检查方法诊断颈动脉不同程度狭窄的一致性较好(κ =0.958,P=0.024)。以重度狭窄率为70%作为切分点,颈动脉狭窄SMI 诊断的敏感性为96.0%(95% CI:0.93,0.99),特异性为97.0%(95%CI:0.95,1.00),准确性97.0%。见表2。

表2 SMI与DSA诊断颈动脉狭窄的一致性比较 例
2.3 CEUS与DSA诊断颈动脉狭窄程度
CEUS 与DSA 诊断颈动脉狭窄情况见表3,经Kappa 检验,两种检查方法诊断颈动脉不同程度狭窄的一致性较好(κ=0.903,P=0.035)。CEUS 诊断斑块内新生血管的敏感性为96.0%(95% CI:0.93,0.98),特异性为94.0%(95%CI:0.90,0.98),准确性为94.0%。

表3 CEUS与DSA诊断颈动脉狭窄的一致性比较 例
2.4 3 种检查方法诊断颈动脉重度狭窄及闭塞的一致性比较
3 种影像学检查方法诊断颈动脉重度狭窄及闭塞的敏感性、特异性及准确性比较,经χ2检验,差异均无统计学意义(χ2=1.183、1.238 和1.824,P=0.071、0.083 和0.093)。见表4。
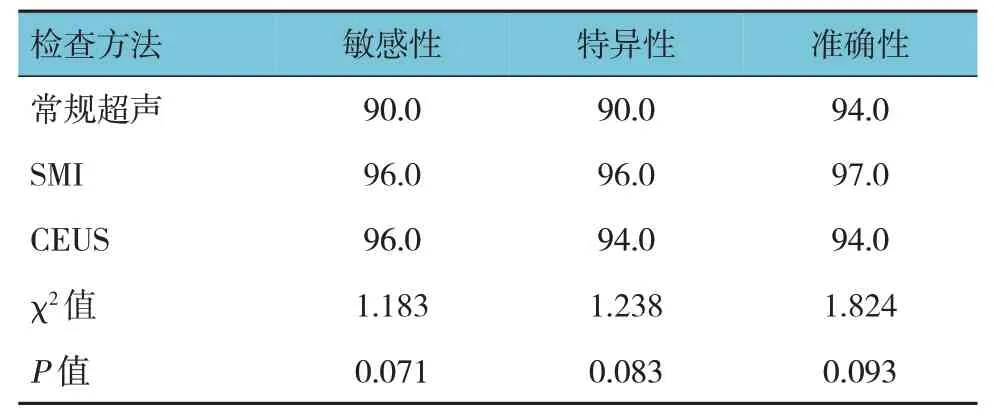
表4 3种检查方法对颈动脉重度狭窄及闭塞的诊断价值比较 (%)
3 讨论
脑卒中是重大的全球健康问题,目前已成为世界人口的第2 大死因,仅次于缺血性心脏病。非致命性中风患者的恢复期较长,花费较高,且存在潜在的独立性丧失等风险,显著影响患者的生活质量。鉴于面临医疗预算的巨大压力,在出现临床症状之前进行低成本、高效益的预防已成为医疗实践的重要组成部分。颈动脉狭窄是动脉粥样硬化早期阶段的表现之一,对脑血管疾病的预测起到重要作用[12]。非对称性颈动脉狭窄会在非脑卒中或局灶性神经功能缺损的前6 个月出现颈动脉狭窄。研究表明,每年中度狭窄(狭窄率>50%)的中风风险<1%,而>80%狭窄率的中风风险高达5%[13]。
颈动脉成像和狭窄程度的测量具有重要的临床价值。影像学成像技术的筛查可早期判断颈动脉血管的狭窄率,便于尽早采取临床治疗措施,降低缺血性脑卒中的发病率[14]。动脉DSA 是一项昂贵且有潜在高风险的技术,因此不能作为颈动脉狭窄的筛查工具。目前针对颈动脉狭窄的影像学检测方法有很多,无创超声技术可用于判断影响颈动脉分叉的狭窄程度,是目前应用最广泛的成像技术。然而,无创超声技术不能准确地评估颅内血管的狭窄程度,尤其在血管严重钙化的情况下评估更为困难[15]。CTA 和MRA 能够观察颅内外血管情况,从而直接测量颈动脉狭窄率[16-17]。CTA是一种非常快速的动脉观察方法,可以识别颈动脉疾病的并发症,如夹层和假性动脉瘤。MRA 与CTA 具有相似的敏感性和特异性,且受周围骨骼或钙化的影响较小,可以显示斑块特征及稳定性。然而,这些筛查方法的适用性受其成本、静脉造影剂和电离辐射相关风险的限制。
近年来,SMI 和CEUS 可有效检测血管狭窄处的超微血管,显示斑块内新生血管形成,判断狭窄率,具有更高的敏感性和准确性,可更好地用于脑血管疾病的筛查[18-19]。其中SMI 无需使用造影剂,且与颈动脉超声造影在显示斑块内新生血管部位方面有良好的一致性,可以初步评估斑块内新生血管情况,进而评价斑块的稳定性。SMI 具有2 种检测模式,可以实现高帧率、高分辨率的可视化,但SMI 对颈动脉斑块内新生血管的敏感性和检出率并不高。尽管CEUS 可以清晰地显示颈动脉内的血流情况,提高斑块的检出率,但是不能对动脉粥样硬化性及血栓性疾病进行量化评估,并且少部分患者在使用造影剂后会出现头痛、恶心等不良反应,且费用相对较高。此外,CEUS 在操作上至少需要2 名放射科技术人员共同完成,临床应用价值有限。
血管狭窄程度可分为轻度、中度、重度及闭塞。本研究应用常规超声、SMI 和CEUS 对100 例颈动脉、锁骨下动脉、椎动脉重度狭窄及闭塞患者进行检查,并以DSA 技术为金标准对比评估常规超声、SMI 及CEUS 在诊断颈动脉、锁骨下动脉、椎动脉重度狭窄及闭塞中的价值,发现3 种检查方法与DSA 诊断颈动脉狭窄程度具有较高的一致性。进一步评估3 种检查方法诊断颈动脉重度狭窄及闭塞的准确性、敏感性及特异性,SMI 的准确性为97.0%,敏感性为96.0%,特异性为97.0%,有助于评估患者颈动脉狭窄的严重程度。因此,无创、经济、简便的SMI 评价斑块内新生血管的准确性较高,可为临床提供更可靠的影像学信息。
超声可动态反映动脉管壁的形态学变化,CEUS 量化分析可准确检测病变不同阶段血管新生情况。CEUS 能够通过显示动脉粥样斑块内新生血管的分布情况,用于评估斑块的稳定性[2],CEUS定量分析方法较半定量分级方法对造影后斑块增强程度的评估更客观、精确。虽然使用SMI 也可能无法检测超慢的血流,并且在没有SMI 检测到血流信号的情况下,还需要CEUS 辅助确认检查,但是而随着技术的进一步发展,SMI 的敏感性有望得到提高[20]。本研究结果表明,3 种检查方法诊断颈动脉狭窄程度具有较高的一致性,其中SMI 作为一种更简单、经济、无创的方法,有助于进一步可视化颈动脉狭窄部位,提高颈动脉斑块临床评价的稳定性。SMI 未来的发展包括结合三维成像能力和增加量化功能,这将有助于消除其当前诊断的局限性及提高整体临床诊断水平,有望最终取代CEUS 在动脉粥样硬化、血脂异常、高血压等疾病干预治疗中的应用。
