lncRNA FGD5-AS1调控miR-761影响骨肉瘤细胞增殖、迁移和凋亡的机制研究
2021-03-26李锋龚继承杜经柱陈奇
李锋,龚继承,杜经柱,陈奇
(中国人民解放军联勤保障部队第九二八医院骨科,海南 海口 570206)
骨肉瘤是一种常见的恶性骨肿瘤,主要表现为骨骼、关节疼痛和局部肿块,好发于青少年和青壮年[1]。目前,临床主要依靠手术切除联合放化疗来延长生存期,然而其高复发、高转移性导致骨肉瘤患者预后较差[2]。据统计,局限性骨肉瘤患者的5年生存率为80%,而转移性骨肉瘤患者的5年生存率仅为15%~30%[3]。因此,探讨骨肉瘤发生、转移的分子机制对提高骨肉瘤患者的整体生存率具有重要意义。近年研究显示,除抑癌基因和致癌基因外,长链非编码RNA(long non-coding RNA,lncRNA)在肿瘤生物学中发挥调控因子作用。含有5个PH结构域的反义RNA1(PH domain containing 5 antisense RNA 1,FGD5-AS1)是一种肿瘤相关lncRNA,FGD5-AS1高表达通过抑制其靶微小RNA(microRNA,miRNA)表达可增强结肠癌细胞的增殖、迁移和侵袭能力,抑制细胞凋亡,是结肠癌的潜在治疗靶点[4]。生物信息学预测显示,FGD5-AS1对miR-761具有潜在调控作用。miR-761低表达已被证实与骨肉瘤患者的临床分期和远处转移密切相关,恢复miR-761表达可抑制肿瘤生长和转移,促进肿瘤细胞凋亡[5]。然而,FGD5-AS1是否靶向miR-761在骨肉瘤中发挥作用尚未可知。本研究以miR-761为切入点,探讨FGD5-AS1对骨肉瘤细胞增殖、迁移和凋亡的影响,以期为骨肉瘤治疗提供新的思路。
1 资料与方法
1.1 组织材料 选取2016—2018年在本院进行手术治疗的30例骨肉瘤患者的骨肉瘤组织和与其对应的瘤旁组织(癌灶周围3 cm内正常组织),其中男18例,女12例;年龄7~69岁,平均年龄(20.2±1.29)岁。所有组织样本均经过病理学检验,且样本收集前所有患者未接受放化疗;所有患者未患有其他恶性肿瘤、免疫学疾病、或其他骨关节疾病。
1.2 实验材料 人骨肉瘤细胞U2OS购自武汉普诺赛生命科技公司;胎牛血清、青链霉素双抗溶液购于美国Gibco公司;Lipofectamine 3000、McCoy 5A培养基购自美国Thermo公司;FGD5-AS1小干扰RNA(si-FGD5-AS1)及其阴性对照(si-NC)、miR-761模拟物(miR-761 mimics)及其阴性对照(miR-NC)、聚合酶链式反应(polymerase chain reaction,PCR)引物由广州锐博生物技术公司提供;RNA提取试剂盒、cDNA合成试剂盒、SYBR Green Master mix购自大连Takara公司;miRNA分离试剂盒、All-in-One miRNA逆转录定量聚合酶链式反应(reverse transcription-quantitative polymerase chain reaction,RT-qPCR)检测试剂盒购于深圳欣启生物科技有限公司;噻唑蓝(methyl thiazolyltetrazolium,MTT)试剂盒、膜联蛋白-异硫氰酸荧光素(Annexin V fluorescein isothiocyanate,Annexin V-FITC)/碘化丙啶(propidium iodide,PI)双染法细胞凋亡检测试剂盒购自上海碧云天公司;Transwell小室购于美国BD公司;兔源Ki67(ab92742)、上皮型钙黏蛋白(epithelial cadherin,E-cadherin)(ab40772)、神经钙黏素(neural cadherin,N-cadherin)(ab76011)和磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)抗体以及羊抗兔IgG二抗(ab205718)购于上海艾博抗公司。
1.3 细胞培养和分组 采用McCoy 5A培养基(补充10%胎牛血清和1%青链霉素双抗)于二氧化碳体积分数为5%、湿度为70%、37℃恒温培养箱中培养U2OS细胞。当细胞密度达到80%~90%时,按照1︰2比例进行传代培养。将对数生长期U2OS细胞分为si-NC组(转染si-NC)、si-FGD5-AS1组(转染si-FGD5-AS1)、si-FGD5-AS1+miR-NC组(共转染si-FGD5-AS1和miR-NC)、si-FGD5-AS1+miR-761组(共转染si-FGD5-AS1和miR-761 mimics)、si-FGD5-AS1+anti-miR-NC组(共转染si-FGD5-AS1和anti-miR-NC)和si-FGD5-AS1+anti-miR-761组(共转染si-FGD5-AS1和anti-miR-761)。
1.4 RT-qPCR检测FGD5-AS1和miR-761表达 RNA提取试剂盒从骨肉瘤组织、瘤旁组织和各组U2OS细胞中提取总RNA。cDNA合成试剂盒进行逆转录反应,利用SYBR Green Master mix进行qPCR反应。以GAPDH作为内源性对照,2-ΔΔCt法检测FGD5-AS1表达水平。为检测miR-761表达水平,利用miRNA分离试剂盒提取miRNA,All-in-One miRNART-qPCR检测试剂盒测定miR-761的表达水平。引物序列如下:FGD5-AS1上游引物5′-CGTGGAGAAGAATTGGGC-3′,下游引物5′-CGTGGAGAAGAATTGGGC-3′;GAPDH上游引物5′-ACCTGACCTGCCGTCTAGAA-3′,下游引物5′-GTCAAAGGTGGAGGAGTGGG-3′;miR-761上游引物5′-ACAGCAGGCACAGAC-3′,下游引物5′-GAGCAGGCTGGAGAA-3′;U6上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。
1.5 MTT法检测细胞活力 将U2OS细胞按照1×104个/孔接种到96孔板,按Lipofectamine 3000使用说明进行细胞转染,培养48 h后每孔加入20 μL的MTT试剂,培养箱继续孵育4 h,每孔加入150 μL二甲基亚砜,振荡10 min至结晶完全溶解。以空白孔调零后,酶标仪检测490 nm波长处各孔吸光度值(A)。细胞存活率=(A实验组/A对照组)×100%。
1.6 集落形成实验检测细胞克隆能力 转染48 h后,收集U2OS细胞,吹打制备单细胞悬液。以50、100和200个细胞梯度接种至直径为6 cm的培养皿,置于细胞培养箱中培养14~21 d,当出现肉眼可见的菌落时,终止培养,弃去细胞悬液。进行多聚甲醛固定和结晶紫染色,流水缓慢洗去染液,空气干燥。显微镜观察各组细胞克隆情况,计数>50个细胞的克隆数。
1.7 Transwell实验检测细胞迁移能力 转染48 h后,收集U2OS细胞,采用McCoy 5A培养基制备单细胞悬液,调整细胞密度为3×104个/mL。取200 μL细胞悬液加入到Transwell上室(未涂有基质胶),24孔板下室加入500 μL含20%胎牛血清的MEM培养基。培养箱孵育24 h,取出下室,棉签擦去未过膜细胞,多聚甲醛固定下室膜并进行结晶紫染色,显微镜下观察细胞迁移情况。
1.8 流式细胞术检测细胞凋亡 转染48 h后,收集U2OS细胞,采用结合缓冲液调整细胞浓度为1×106个/mL。取100 μL细胞悬液,按照Annexin FITC/PI双染法细胞凋亡检测试剂盒分别加入Annexin FITC、PI,避光条件下孵育30 min后,流式细胞数检测细胞凋亡。
1.9 Western blot检测Ki67、E-cadherin和N-cadherin表达水平 使用RIPA溶液从各转染组U2OS细胞中提取总蛋白。蛋白样品煮沸变性后,按照每泳道30 μg进行聚丙烯酰胺凝胶电泳。将蛋白转移至聚偏二氟乙烯(polyvinylidenefluoride,PVDF)膜上后,置于含5%脱脂牛奶和0.1%吐温20的Tris盐酸缓冲液中封闭2 h。随后,将膜置于抗Ki67抗体(1︰5 000)、抗E-cadherin抗体(1︰10 000)、抗N-cadherin抗体(1︰5 000)溶液中4℃孵育过夜。然后,将膜置于山羊抗兔IgG二抗溶液(1︰2 000)中孵育2 h。暗室内进行化学发光显色,以目的蛋白灰度值与内参GAPDH灰度值比值表示目的蛋白表达水平。
1.10 双荧光素酶报告基因实验 含有miR-761结合位点序列的FGD5-AS1野生型荧光素酶报告基因载体(WT-FGD5-AS1)、含有miR-761结合位点突变序列的FGD5-AS1突变型荧光素酶报告基因载体(MUT-FGD5-AS1)由上海吉玛制药公司提供。利用Lipofectamine 3000将miR-NC、miR-761 mimics分别与WT-FGD5-AS1、MUT-FGD5-AS1共转染至U2OS细胞,48 h后双荧光素酶报告基因测定系统测定U2OS细胞荧光素酶活性。

2 结 果
2.1 FGD5-AS1在骨肉瘤中的表达 骨肉瘤组织中FGD5-AS1的表达水平较瘤旁组织显著升高(P<0.05,见图1)。
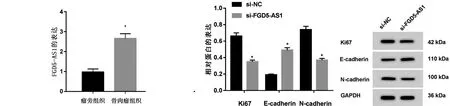
注:与对照组相比,*P<0.05
2.2 抑制FGD5-AS1对U2OS增殖、迁移的影响 与si-NC组相比,si-FGD5-AS1组的U2OS细胞存活率、克隆形成数、迁移细胞数、增殖相关蛋白Ki67、迁移侵袭相关蛋白N-cadherin表达水平显著降低,迁移侵袭相关蛋白E-cadherin蛋白表达水平显著升高(见图2和表1)。
2.3 抑制FGD5-AS1表达对U2OS凋亡的影响 与si-NC组相比,si-FGD5-AS1组的U2OS细胞FGD5-AS1表达水平显著降低,细胞凋亡率及Caspase-3蛋白表达水平显著升高(P<0.05;见图3~4,见表2)。
2.4 FGD5-AS1靶向miR-761 生物信息学分析显示,FGD5-AS1与miR-761之间存在部分连续互补的核苷酸序列(见图5)。双荧光素酶报告实验显示,miR-761 mimics和WT-FGD5-AS1共转染组U2OS细胞荧光素酶活性较miR-NC和WT-FGD5-AS1共转染组显著降低(P<0.05),而miR-761 mimics和WT-FGD5-AS1共转染组U2OS细胞荧光素酶活性与miR-NC和WT-FGD5-AS1共转染组比较无显著变化(见表3)。与si-NC组比较,si-FGD5-AS1组U2OS细胞miR-761的表达水平显著升高[si-FGD5-AS1组(2.24±0.14),si-NC组(0.97±0.07),t=24.341,P<0.05]。
2.5 miR-761能增加抑制FGD5-AS1对U2OS增殖、迁移、凋亡的影响 与si-FGD5-AS1+miR-NC组比较,si-FGD5-AS1+miR-761组的U2OS细胞miR-761表达水平显著升高,细胞存活率、克隆形成数、迁移细胞数、Ki67和N-cadherin蛋白表达水平显著降低,细胞凋亡率、E-cadherin和Caspase-3蛋白表达水平显著升高(P<0.05;见图6~7,见表4~5)。
2.6 抑制miR-761能逆转抑制FGD5-AS1对U2OS增殖、迁移、凋亡的影响 与si-FGD5-AS1+anti-miR-NC组比较,si-FGD5-AS1+anti-miR-761组的U2OS细胞存活率、克隆形成数、迁移细胞数、Ki67和N-cadherin蛋白表达水平显著升高,细胞凋亡率、E-cadherin和Caspase-3蛋白表达水平显著降低(P<0.05;见图8~9,见表6~7)。

表1 抑制FGD5-AS1对U2OS增殖、迁移及Ki67、E-cadherin、N-cadherin蛋白表达的影响

图3 抑制FGD5-AS1诱导U2OS凋亡

图4 抑制FGD5-AS1对U2OS中Caspase-3蛋白的影响

图5 FGD5-AS1靶向miR-761

表2 抑制FGD5-AS1对U2OS凋亡及Caspase-3蛋白表达的影响

表3 双荧光素酶报告实验

图6 miR-761能增强抑制FGD5-AS对U2OS凋亡的诱导作用 图7 miR-761对抑制FGD5-AS1处理的U2OS中蛋白表达的影响

表4 miR-761能增加抑制FGD5-AS1对U2OS增殖、迁移、凋亡的影响

表5 Ki67、E-cadherin、N-cadherin、Caspase-3蛋白的表达

表6 抑制miR-761能逆转抑制FGD5-AS1对U2OS增殖、迁移、凋亡的影响

表7 Ki67、E-cadherin、N-cadherin、Caspase-3蛋白的表达
3 讨 论
骨肉瘤细胞的增殖和向局部区域的迁移侵袭是肿瘤发生、发展的关键阶段,然而骨肉瘤细胞转移的分子机制尚不清楚。因此,探讨骨肉瘤增殖、迁移的分子机制对识别新的治疗靶点、开发新的治疗策略意义重大。
FGD5-AS1已被报道在口腔鳞状细胞癌、非小细胞肺癌、透明肾细胞癌等多种恶性肿瘤中发挥致癌基因作用[6-8]。Fan等[9]研究发现FGD5-AS1在肺癌中表达上调,其通过靶向miR-107上调FGFRL1表达可促进肺癌细胞的增殖。Liu等[6]研究证实FGD5-AS1高表达还可促进口腔鳞状细胞癌细胞的增殖、迁移和侵袭,抑制细胞凋亡。Zhu等[8]通过分析肿瘤基因表达谱发现FGD5-AS1是透明肾细胞癌预后生物标志物和潜在治疗靶点。本研究结果显示,骨肉瘤组织中FGD5-AS1表达较瘤旁组织显著升高,提示FGD5-AS1高表达可能与骨肉瘤进展有关。功能缺失实验显示,转染FGD5-AS1小干扰RNA进一步抑制FGD5-AS1表达后骨肉瘤U2OS细胞的存活率、克隆形成和迁移能力,细胞凋亡率显著升高。Ki67是一种增殖细胞相关的核抗原,其表达水平是评价肿瘤细胞增殖情况和恶性程度的重要指标[10-11]。E-cadherin和N-cadherin是钙依赖性细胞黏附分子,E-cadherin表达增加、N-cadherin表达缺失可维持上皮细胞形态和组织完整性,反之则促进肿瘤细胞的转移和扩散。研究显示敲减lncRNA TTTY15通过上调E-cadherin表达、下调N-cadherin表达可降低骨肉瘤细胞的侵袭能力[12-14]。本研究显示,抑制FGD5-AS1表达后U2OS细胞中Ki67、N-cadherin表达降低,E-cadherin和凋亡执行因子Caspase-3蛋白显著升高,与功能缺失实验结果吻合。以上结果表明,FGD5-AS1在骨肉瘤中发挥致癌基因作用。近年来,多项研究表明FGD5-AS1通过靶向miRNA阻碍其功能进而在肿瘤中发挥作用。如FGD5-AS1通过靶向miR-383调控食管鳞癌细胞的生长、迁移、侵袭和凋亡[15]。FGD5-AS1通过与miR-302e相互作用增加结直肠癌细胞恶性增殖、迁移和侵袭能力[4]。本研究通过生物信息学分析筛选发现miR-761可能与FGD5-AS1之间存在相互作用。miR-761位于染色体1p2区域,既往研究表明miR-761在包括骨肉瘤在内的多种恶性肿瘤中具有重要作用[16-17]。Wang等[16]研究发现miR-761通过靶向下调趋化因子受体1(chemokine receptor 1,CXCR1)抑制细胞增殖和侵袭,是骨肉瘤治疗潜在标志物。Ren等[18]指出结肠癌组织和细胞系中miR-761表达显著降低,过表达miR-761可降低结肠癌细胞的生长和迁移能力。然而,Zhang等[19]证实非小细胞肺癌中miR-761表达上调,lncRNA叉头蛋白F1(forkhead box-F1,FOXF1)相邻非编码发育调控RNA通过靶向miR-761则降低非小细胞肺癌细胞的生长和侵袭。本研究通过双荧光素酶实验证实FGD5-AS1对miR-761具有负调控作用,此外RT-qPCR检测显示抑制FGD5-AS1表达可升高miR-761表达水平。进一步功能分析显示,过表达miR-761可增强抑制FGD5-AS1对U2OS细胞的增殖、迁移、凋亡以及相关蛋白表达的影响,而抑制miR-761表达则逆转FGD5-AS1抑制对U2OS细胞的增殖、迁移、凋亡以及相关蛋白表达的影响。以上研究表明,FGD5-AS1/miR-761途径在骨肉瘤中发挥重要作用,探索miR-761下游靶基因及可能信号通路是下一步研究重点。

图8 抑制miR-761能逆转抑制FGD5-AS1对U2OS凋亡的诱导作用 图9 抑制miR-761能逆转抑制FGD5-AS1对U2OS中蛋白表达的影响
综上所述,本研究发现骨肉瘤中lncRNA FGD5-AS1呈高表达,抑制FGD5-AS1通过靶向上调miR-761可降低骨肉瘤细胞的增殖和迁移能力,并诱导细胞凋亡。因此,FGD5-AS1/miR-761途径可能是骨肉瘤治疗的潜在靶点。
