超声法提取猴头菇多糖工艺优化研究
2021-03-23张浩然魏晶晶王慧春
张浩然,魏晶晶,王慧春
(青海师范大学 生命科学学院,青海省青藏高原药用动植物资源重点实验室,西宁 810008)
猴头菇(Hericiumerinaceus(Bull.) Pers.)是一种珍贵的真菌,又名猴头菌、猴头蘑、刺猬菌,属于担子菌门,伞菌纲,多孔菌目,齿菌科,猴头菌属。猴头菇兼有药用与食用的价值,中医认为其性平、味甘,可治疗消化不良、胃胀、胃痛和神经衰弱等症状;现代医学认为猴头菇具有降血糖、降血脂、降血压、抗肿瘤、抗衰老、抗辐射等功效,有安全性高、毒副作用小的特点[1-2]。在食用方面,因其鲜嫩香醇的口感,历来便有“山珍猴头、海味燕窝”的说法[3],早在明清时便作为皇室贡品,是我国传统名贵食材[4]。由于猴头菇人工种植技术的推广,猴头菇进入了寻常百姓家。目前市场上的猴头菇多制成干品出售,近年以猴头菇为原料的保健食品也出现在公众视野中,譬如猴头菇饮料、猴头菇饼干、猴头菇素肉干等[5]。
猴头菇的主要活性成分是多糖,也是目前研究最多的活性物质之一[6-7]。传统的多糖提取主要采用热
水回流浸提法[8],该方法耗时长、浸提剂用量大且效率不高(提取率<4.5%)[9]。近年来,超声提取植物有效成分技术逐渐兴起[10-11]。该技术是应用超声波强烈的“空穴作用”与机械效应,通过提高细胞内容物的透过性来提取植物有效成分,是一种物理破碎过程,具有操作简单、提取快速、提取率高等特点[12]。本文在单因素实验的基础上,通过正交实验优化了超声法提取猴头菇多糖的主要工艺条件,为猴头菇多糖的开发利用和工业化生产提供了参考。
1 材料与方法
1.1 材料与仪器
猴头菇:青海粤海农牧集团温室,烘干后切片粉碎,过40目筛,于55 ℃真空干燥,待用。
1.2 实验方法
1.2.1 猴头菇多糖提取
猴头菇脱脂预处理:准确称取猴头菇样品若干置于索氏抽提装置中,用三氯甲烷∶甲醇为2∶1(体积比)混合溶液作为提取液,于80 ℃回流脱脂3次,105 ℃烘干备用。
超声提取多糖:脱脂预处理后,猴头菇粉按各因素(提取时间、提取温度、料液比)实验设计,以85%乙醇溶液作为提取剂,利用超声波清洗机提取猴头菇多糖,经过滤,取滤液测定多糖含量,并计算猴头菇多糖得率。
1.2.2 单因素优化实验
准确称取猴头菇样品若干置于索氏提取器中,先用乙醚回流脱脂2次,再用85%乙醇提取,设置提取时间(10,15,20,25,30 min)、提取温度(30,40,50,60,70 ℃)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30,g/mL),利用超声仪(超声频率为25 kHz)提取猴头菇多糖。以多糖提取率为衡量指标,初步确定适合猴头菇多糖超声提取的工艺参数。每次改变一个因素进行不同单因素实验,每实验设3次重复。
1.2.3 正交实验方法
《鹿鼎记》里,丽春院中到了嫖客,常常差韦小宝去买粽子。粽子整只用粽箬裹住,韦小宝要偷吃原亦甚难,但他总在粽角之中挤些米粒出来,尝上一尝。
在单因素实验的基础上,设计 L9(33)正交实验(见表1),确定超声提取猴头菇多糖的最佳工艺条件,并进行实验验证,证实该方法的可靠性。

表1 L9(33)正交实验因素水平表Table 1 The factors and levels of L9(33) orthogonal test
1.2.4 多糖含量测定
参照苯酚-硫酸法测定猴头菇多糖含量[13],具体操作过程如下:
葡萄糖标准曲线的绘制:准确称取105 ℃下干燥至恒重的分析纯葡萄糖10 mg,加适量蒸馏水使其溶解,定容至100 mL,得到0.1 mg/mL的葡萄糖标准溶液。用移液管精密移取1,2,3,4,5,6 mL的葡萄糖标准溶液分别定容至10 mL,精密吸取2 mL于10 mL比色试管中,各加1 mL 5%苯酚溶液、5 mL浓硫酸,摇匀后静置冷却10 min,置于30 ℃水浴中10 min,用空白矫正零点,在490 nm下测定其吸光度。以葡萄糖浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线。回归方程为Y=14.521X+0.0092,R2=0.9959,线性关系较好。
样品的测定:取1 mL猴头菇多糖提取液,用蒸馏水定容至10 mL,如上方法测定吸光度值。参照葡萄糖标准曲线计算样品多糖含量,进而计算猴头菇多糖提取率:
2.1 单因素实验
式中:c为根据吸光度值计算出的猴头菇多糖溶液质量浓度,D为猴头菇多糖溶液稀释倍数,V为猴头菇多糖溶液体积,m猴头菇为猴头菇原料干重。
2 结果与分析
2.1.1 不同提取时间对猴头菇多糖提取率的影响

图1 超声提取时间对多糖提取率的影响
由图1可知,在超声提取15~20 min内猴头菇多糖提取率有明显提升;当超声时间为20 min时,多糖提取率达到最高点4.96%;超声时间超过20 min后,多糖提取率随着超声时间的增加而降低,这是由于超声波产生的强烈空化效应、搅拌作用以及高的加速度,使有效成分快速进入溶剂,从而提高了多糖提取率[14]。因此,选取最佳的超声提取时间为20 min。
2.1.2 不同提取温度对猴头菇多糖提取率的影响
在料液比 1∶15、超声提取20 min的条件下,考察了超声提取温度对猴头菇多糖提取率的影响,见图2。

图2 超声提取温度对多糖提取率的影响
由图2可知,随着温度的升高,多糖提取率上升较快,当温度超过50 ℃以后,多糖提取率上升幅度较小,这可能是由于随着温度的升高,超声空穴作用加强,使细胞破碎程度过大,导致其他杂质被溶出,进而影响了多糖提取率。从节能角度考虑,选择最佳超声提取温度为50 ℃。
2.1.3 不同料液比对猴头菇多糖提取率的影响
在提取温度为50 ℃、提取时间为20 min的条件下,考察了料液比对猴头菇多糖提取率的影响,结果见图3。
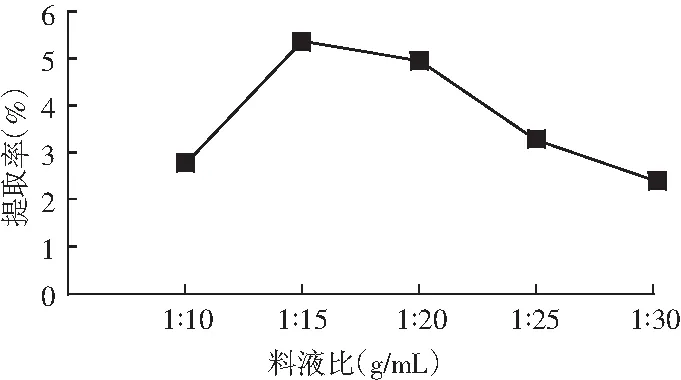
图3 料液比对多糖提取率的影响
由图3可知,随着提取剂乙醇的增加,多糖提取率呈现先快速增加又逐渐降低的趋势;当料液比为1∶15 (g/mL)时,多糖提取率达到最高值5.41%,这可能是因为料液比过小,多糖未被浸透导致其提取率偏低;料液比过高,溶出的蛋白质与多糖重新结合使其提取率降低,同时还增加了后续处理时间和提取液浓缩成本。因此,最佳提取料液比为1∶15 (g/mL)。
2.2 正交实验结果与分析
根据单因素实验结果设计3因素3水平的L9(33)正交实验,结果见表2,极差R值反映了3个因素对猴头菇多糖提取率的影响,依次为提取温度(B)>提取时间(A)>料液比(C);猴头菇多糖提取最优水平组合是A2B3C2,即超声时间20 min,提取温度60 ℃,料液比1∶15 (g/mL),这与单因素实验结果略有差异。

表2 L9(33)正交实验结果Table 2 L9(33) orthogonal experimental results
2.3 验证实验
对正交实验最优组合A2B3C2进行验证实验,在料液比1∶15 (g/mL)、提取温度为50 ℃的条件下,超声提取为15 min,猴头菇多糖提取率为6.16%,高于单因素实验结果。因此,确定超声提取猴头菇多糖的最优工艺条件为:提取时间20 min,提取温度60 ℃,料液比1∶15 (g/mL)。
3 讨论
多糖物质作为目前科研领域的研究热点,不仅有极高的营养、医药价值,还具有重要的经济价值。猴头菇作为大型药食两用菌,其多糖有特殊、天然和高效的活性作用,有较好的抗氧化性,对多种自由基均有显著的去除能力。现已有猴头菇多糖保健食品的研制,如猴头菇多糖口含片和猴头菇多糖饮料[15]。因此,研究能够最大程度保留营养价值和活性成分的猴头菇多糖提取方法具有重要的现实意义。
用超声法提取猴头菇多糖有简化提取步骤、减少对多糖的破坏、提取时间短、多糖得率高等优点,在中草药化学成分提取中具有明显优势[16]。但目前仪器设备耗能高,应用较少,推广存在一定的难度。因此需要优化超声法提取猴头菇多糖工艺,为后期推广及产品的生产打下基础。
4 结论
本研究采用单因素和正交试验法对猴头菇多糖的超声提取工艺进行了探讨,评价了提取时间、提取温度和料液比对多糖提取率的影响,并优化了提取工艺条件。对猴头菇多糖提取率影响的主次顺序为提取温度>提取时间>料液比,最优的提取条件为:超声温度60 ℃,超声时间20 min,料液比为1∶15 (g/mL)。在此条件下,猴头菇多糖提取率达6.16%。该方法简化了猴头菇多糖的提取步骤,避免了高温和长时间提取对多糖结构的破坏,节省了成本,且多糖提取率较高,是一种较理想的高效又经济的猴头菇多糖提取新工艺。
