传统自然发酵蔬菜的显微表征及其细菌群落多样性分析
2021-03-23金华吕嘉枥罗潇
金华,吕嘉枥,罗潇
(陕西科技大学 食品与生物工程学院,西安 710021)
传统发酵蔬菜通过原料中携带的微生物进行发酵[1-2]。目前国内自然发酵蔬菜代表性的产品有四川涪陵榨菜、四川泡菜、东北酸菜、贵州辣椒酱以及以甘肃兰州和陕西陕南为代表的浆水菜等[3-8]。传统自然发酵蔬菜中包括乳酸菌、酵母菌、芽孢杆菌以及少量的其他菌群[9-12]。目前的研究报道发酵过程中发挥作用的主要是乳酸菌,发酵后期蔬菜产生乳酸、乙酸等拥有独特风味的物质[13-15]。
目前对发酵蔬菜的研究主要集中在自然发酵过程中各个阶段微生物菌群结构、优势菌群以及产品的感官品质等方面[16-18],通过显微表征对传统发酵蔬菜的研究主要集中在单个样品或样品中分离出来的单个菌株等方面[19-20],其样本量少,不能全面反映传统发酵蔬菜的微生物群落结构,而且结合泡菜与浆水菜两者相互对照的研究未见报道。对传统发酵蔬菜中微生物的菌群多样性研究,多是选用分离、纯化、鉴定这些传统的方法,然而环境中能够用来培养的微生物只能占到微生物总数的0.1%~10%[21],传统的分离纯化培养方法不能真实全面地反映传统发酵蔬菜中微生物的菌群多样性。魏本良等[22]通过高通量测序分析陕西地区浆水中细菌多样性。张安等[23]采用构建16S rRNA基因文库的方法对四川泡菜的微生物多样性进行了分析,但对陕西地区的传统发酵蔬菜中微生物的多样性缺乏全面分析。
因此,本研究为揭示不同的陕西地区市售发酵蔬菜制品中菌群群落结构的差异性,以具有代表性的19种陕西省西安市市售传统发酵蔬菜为试验样品,采用扫描电子显微镜与Illumina MiSeq高通量测序技术相结合,对样品的细菌群落结构多样性进行研究,研究结果能够应用到发酵蔬菜新产品的研制,并且为产品的质量控制与品质提高提供了依据。
1 试验材料与方法
1.1 供试样品
在陕西西安的不同地区采集了19种市售传统发酵蔬菜制品为供试样品,其中15个样品为泡菜(HBZ1、HBZ2、HBZ3、XYL1、LHL1、LHL2、LHL3、LHL4、LHL5、SXC1、SXC2、SXC3、SXC4、LHL6、YTQ2),4个样品为浆水菜(YTQ1、YTQ3、GLQ1、GLQ2)。
1.2 主要仪器与试剂
主要仪器与试剂见表1。

表1 主要仪器与试剂Table 1 The main instruments and reagent
1.3 试验方法
1.3.1 传统自然发酵蔬菜样品的显微表征分析
选取19份发酵蔬菜样品,通过扫描电镜观察其发酵液中细菌的群落结构和附着在菜体上细菌的形态数量。
1.3.1.1 发酵液的显微表征分析
显微表征采用扫描电子显微镜观察,方法如下[24]:
首先,对发酵蔬菜样品进行前处理:将发酵液用离心机离心10 min,离心机转速调至6000 r/min,只取沉淀物,然后继续倒入发酵液离心(条件与上述相同),经过数次离心使得离心管底剩余更多的细菌沉淀物。

续 表
随后进行固定:将上一步操作的管底沉淀用已经配制好的戊二醛溶液(2.5%)固定至少2 h,固定操作后再继续离心10 min(6000 r/min),只取沉淀物。
然后清洗:用现配的磷酸缓冲液(pH 7.2,0.1 mol/L)间隔20 min洗涤3次。每次洗涤完成后对其离心(离心条件同上),只保留管内沉淀物。
后续对其脱水:选取的方法为乙醇梯度脱水,对离心物按照浓度由小到大(30%、70%、100%)进行脱水,将其在每种浓度中间隔20 min脱水3次,每次脱水操作后都要进行离心,离心条件不变。
干燥:将管内沉淀物置于干燥箱,50 ℃烘干。
喷金:通过真空镀膜设备对干燥后的样品镀金以便于后续在扫描电镜下观察。
最后进行观察分析:将经过一系列处理后的样品置于扫描电镜下观察。
1.3.1.2 发酵菜体的显微表征分析
发酵蔬菜样品前处理:使用消毒钳取少量待测样品。后续步骤同上述发酵液的显微表征分析步骤。
1.3.2 传统自然发酵蔬菜样品的细菌群落结构多样性分析
上述对19个样品进行显微表征的观察分析,得出观察分析结果,从中选5个细菌群落多样的发酵蔬菜制品,并对其进行群落多样性分析。对5个样品的总基因组进行提取,并针对16S rRNA V3+V4 区基因片段进行PCR扩增,通过Illumina MiSeq高通量测序分析研究各个样品中细菌的群落结构。
2 结果与分析
2.1 19种传统自然发酵蔬菜的显微表征
2.1.1 发酵液的显微表征
对19个发酵蔬菜的发酵液进行显微表征观察,蔬菜中的营养成分与其中的微生物菌群相互作用,从而使得发酵蔬菜产生各种功能性成分并且还会产生各种风味物质。各样品发酵液中的菌体形态见图1。




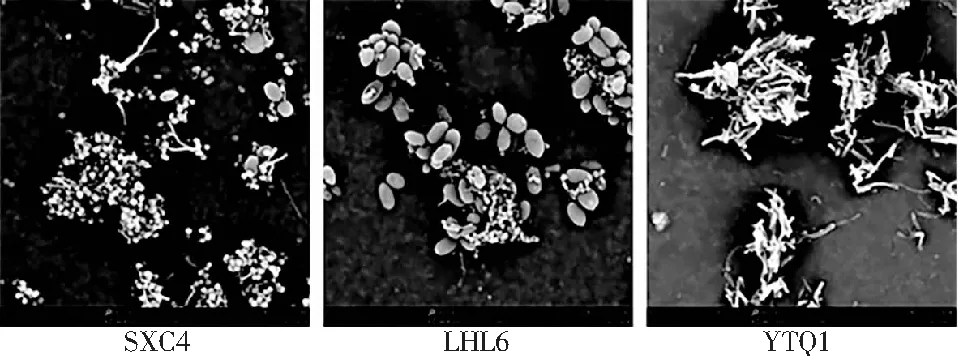


图1 19个传统发酵蔬菜发酵液中菌群的显微表征
19个传统自然发酵蔬菜样品中有15个泡菜样品和4个浆水菜样品,泡菜样品中样本号HBZ1发酵液中的优势菌群为球菌,根据形态初步判断是双球菌,而发酵液中也存在少量形态不同的杆菌,总体而言,菌群不复杂。样本号HBZ2、HBZ3发酵液中优势菌群为杆菌,其中样本号HBZ2发酵液中优势菌群为杆菌,而样本号HBZ3发酵液中菌群相对复杂,有杆菌且有球菌,但杆菌所占比例要高于球菌。样本号XYL1、YTQ2发酵液中不仅有杆菌还观察到了酵母菌,因此菌群相对较复杂。样本号LHL1、LHL2发酵液中比较前几个样品更为复杂,菌群包括了球菌、杆菌以及酵母菌,球菌在数量上要多于杆菌和酵母菌。样本号 LHL3、SXC4发酵液中包括球菌和酵母菌,球菌多于酵母菌,根据查阅相关图片资料以及对这两个样品中酵母菌的形态描述进行分析,其与酿酒酵母的形态比较符合,其中样本号SXC4发酵液中只观察到了球菌,由菌体形态判断其为双球菌。样本号LHL4发酵液中菌群以球菌为主,由菌体形态判断其为四联球菌。样本号SXC1发酵液中优势菌群为球菌,除了球菌还观察到了数量较多的酵母菌,样本号SXC2发酵液中包括球菌、杆菌和酵母菌,球菌所占比例大于杆菌和酵母菌。样本号SXC3发酵液中优势菌群为球菌,但是菌群较为复杂,通过观察形态,发现其中包括单球菌、双球菌以及四联球菌,还观察到数量较少的杆菌。样本号LHL5、LHL6发酵液中优势菌群为酵母菌,其中球菌所占比例相对较高。浆水菜样品中样本号YTQ1、YTQ3发酵液中优势菌群为杆菌,样本号GLQ1、GLQ2发酵液中优势菌群则为酵母菌。19个传统自然发酵蔬菜样品中浆水菜发酵液中的菌群较泡菜样品复杂。主要以球菌和杆菌数量居多,但大多数样品发酵液中都存在酵母菌。总的来说,不同样品中的菌体种类、形态各不相同。
2.1.2 菜体表面显微表征
环境中的一些微生物具有一定的粘附力,而发酵蔬菜的菌群包括发酵液中存在的和附着在菜体表面的菌群。显微表征19个样品菌群在菜体表面的存在情况见图2。







图2 19个市售传统发酵蔬菜在菜体表面的显微表征
由图2可知,发酵蔬菜样品中的泡菜样品样本号HBZ1、LHL3、LHL4的菜体上能明显看到附着一些球菌。其中观察样本号HBZ1菜体上的球菌镶嵌在菜体表面,通过形态分析其应为单球菌。而样本号LHL3在菜体表面上可看到许多球菌,通过形态学分析其包括单球菌和双球菌,其中在样本号LHL4的菜体表面观察到许多堆积在一起的球菌,通过形态学分析其应为四联球菌。样本号SXC3、YTQ2菜体表面看到一些杆菌,样本号SXC4菜体表面能够观察到球菌,包括单球菌与四联球菌。样本号LHL6菜体表面则附着了大量的酵母菌,剩余的样品(样本号XYL1、HBZ2、HBZ3、SXC1、SXC2、LHL1、LHL2、LHL5)菜体表面很少观察到附着的菌体。而浆水菜样品中样本号GLQ1、GLQ2菜体表面也可以观察到附着的一些酵母菌,样本号YTQ1、YTQ3菜体表面则很少能看到附着的菌体。总体而言,19个传统自然发酵蔬菜样品中发酵液中的菌群相对较菜体表面的丰富,而浆水菜中的菌群较泡菜中的菌群丰富,通过查阅相关文献,传统发酵蔬菜中存在一些球菌和酵母菌具有一定的粘附力,因此可以附着在菜体表面[25]。
2.2 细菌群落多样性
以上述19个样品进行显微表征的观察分析结果中选择5个细菌群落多样的发酵蔬菜制品,分别为样本号HBZ1、HBZ2、LHL2、LHL5、LHL6,通过Illumina MiSeq高通量测序分析研究各个样品中细菌的群落结构。
2.2.1 PCR扩增产物
分别提取5个细菌群落多样的发酵蔬菜制品的总基因组,然后利用PCR扩增其16 S rRNA V3+V4 区基因片段,其中琼脂糖凝胶电泳检测结果见图3。

图3 5个传统发酵蔬菜样品细菌基因组PCR产物电泳图
由图3可知,PCR扩增的目的是为了保证合适的浓度,使得后续的试验结果准确。在250~500 bp之间所对应的位置可以看到5个发酵蔬菜制品都有明显的条带,说明PCR产物目的条带大小正确,浓度合适,可以继续试验。
2.2.2 细菌群落α-群落结构多样性分析
5个菌群丰富的样品细菌α-群落结构多样性分析见表2。

表2 5个传统发酵蔬菜样品中细菌群落结构多样性指数Table 2 The diversity indexes of bacterial community structure of 5 traditional fermented vegetable samples
由表2可知,所选择测试的5个菌群丰富的样品,其中样本号HBZ2菌群丰度指数在所有测试的5个样品中最高,菌群丰度指数由高到低依次为样本号HBZ2、HBZ1、LHL2、LHL6和LHL5。为反映每个样品中细菌群落的真实情况,本次测序深度均不低于0.997。测试结果反映出细菌群落丰富,多项指数对比表现出明显的差异。

图4 5个传统发酵蔬菜样品在属的水平上的细菌组成
5个传统发酵蔬菜样品在属水平上的细菌组成有65个属,此外,还存在4株无法培养的菌株。在这65个属中主要为乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)菌群丰度指数比较高。乳杆菌属在样本号HBZ1中的丰度为35.70%,在样本号HBZ2中的丰度为83.36%,在样本号LHL2中的丰度为89.24%,在样本号LHL5中的丰度为95.03%,在样本号LHL6中的丰度为94.83%,片球菌属在样本号HBZ1中的丰度远远高于其余4个样品,丰度为59.59%,其余样品的丰度:样本号HBZ2中的丰度为1.60%,样本号LHL2中的丰度为2.19%,样本号LHL6中的丰度为2.94%,其中样本号LHL5中的丰度最低,为1.04%。此外,还在样本号HBZ2中检测出了丰度相对较高的假单胞菌属(Pseudomonas,丰度为2.04%)、拟杆菌属(Bacteroides,丰度为1.54%)和泛生菌属(Pantoea,丰度为1.44%)。在样本号LHL5中检测出丰度相对较高的海细菌属(Marinobacterium),丰度为2.67%。在样本号LHL6中检测出丰度相对较高的水螺菌属(Aquaspirillum),丰度为1.05%。此外,还检测到丰度较低的弓形菌属、硫杆菌属、食碱菌属、棒状杆菌属、类芽孢杆菌属、双歧杆菌属、希瓦氏菌属、硝化螺旋菌属、盐单胞菌属、魏斯氏菌属、罗氏菌属等。
由图5可知,5个样品细菌各属的丰度存在明显差异,图中右侧是属名,表示不同的属,随着丰度指数不断增加,其颜色由蓝色逐渐过渡到红色,颜色不同表示丰度不同。不同属在不同的样品中所占的比例各不相同。其中乳杆菌属在5个样品中所占的比例都较高,而样本HBZ1中片球菌属的颜色要略深于乳杆菌属,在其余4个样本中乳杆菌属的颜色最深,为优势菌属。而且通过颜色块分析乳杆菌属在样本LHL5中占绝对优势。

图5 5个传统发酵蔬菜样品细菌核心属及其分类水平热图Fig.5 The heat map of bacterial core genera and their classification level in 5 traditional fermented vegetable samples
由图6可知,在属水平,样本的聚类树由两个分枝组成,其中一枝由样本HBZ1与LHL6组成,而另一枝由样本HBZ2、LHL2、LHL5组成,处于同一枝的样本,说明其菌群构成在属分类水平上相似,所以样本HBZ1和LHL6的菌群构成相似,而样本HBZ2、LHL2、LHL5的菌群构成相似。
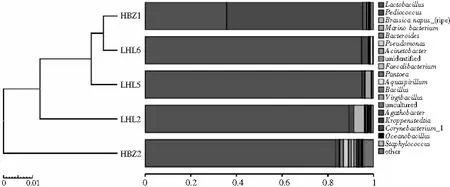
图6 属水平下样本聚类树与柱状图组合分析图

图7 5个传统发酵蔬菜样品在种的水平上的细菌组成Fig.7 The bacterial composition of 5 traditional fermented vegetable samples at the species level
样本在种水平上的细菌组成分为40个种,整体而言,5个样本中除了样本HBZ1的优势菌不同于其他4个样本,其余样本的优势菌比较统一。不可培养的乳杆菌(unculturedLactobacillussp.)在样本HBZ2、LHL2、LHL5中的丰度要远远高于样本HBZ1、LHL6中的丰度,在样本HBZ1中菌群丰度指数为3.57%,在样本HBZ2中菌群丰度指数为50.74%,在样本LHL2中菌群丰度指数为40.69%,在样本LHL5中菌群丰度指数为52.66%,在样本LHL6中菌群丰度指数为9.72%。片球菌属未知种(Pediococcusethanolidurans)在样本HBZ1中的丰度要明显高于其余样本,在样本HBZ1中菌群丰度指数为59.59%,在样本HBZ2中菌群丰度指数为1.60%,在样本LHL2中菌群丰度指数为2.19%,在样本LHL5中菌群丰度指数为1.04%,在样本LHL6中菌群丰度指数为2.94%。一株未鉴定菌(unidentified)在5个样本中丰度所占比例都较高,在样本HBZ1中菌群丰度指数为30.01%,在样本HBZ2中菌群丰度指数为37.03%,在样本LHL2中菌群丰度指数为49.00%,在样本LHL5中菌群丰度指数为42.85%,在样本LHL6中菌群丰度指数为84.64%。除此之外,检测到的一些希瓦氏菌、红串红球菌、奥斯陆莫拉菌、粪产碱菌、Aeromonascaviae、芽孢杆菌、短黄杆菌、短乳杆菌等丰度比较低的菌种。
2.2.3 核心OTU在NCBI数据库中的比对结果
5个传统自然发酵蔬菜样品一共分出了113个OTU,选择其中丰度较高的4个OTU ,根据其在5个样本中的丰度占比与NCBI数据库中进行Nucleotide blast 比对及相似性搜索,比对结果见表3。
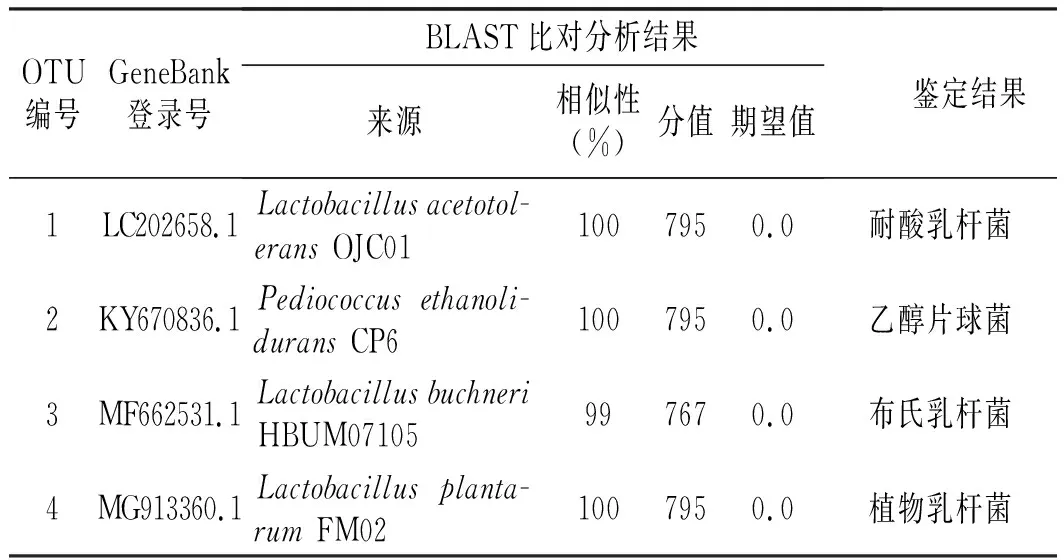
表3 OTU1~OTU4 16S V3+V4区序列比对结果Table 3 OTU1~OTU4 16S V3+V4 sequence alignment results
由表3可知,最后的比对结果显示4个OUT分别为耐酸乳杆菌、乙醇片球菌、布氏乳杆菌和植物乳杆菌,其中耐酸乳杆菌、乙醇片球菌和植物乳杆菌具有100%的相似性,而布氏乳杆菌的相似性也达到了99%。结果与显微表征的分析相符合,鉴定出丰度较高的4个优势菌种,其中只有植物乳杆菌在发酵蔬菜中比较常见,而这种耐酸杆菌通常出现在酸度较高的发酵后期。
3 结论
通过对19个传统自然发酵蔬菜样品的显微表征和细菌群落结构的多样性进行分析研究,结果表明:19个样本的显微表征形态各异,具有显著差异,菌群结构各不相同,泡菜样品中菌群结构相对单一,而浆水菜样品中菌群结构比较复杂。发酵液中细菌菌群的种类和数量都较菜体上丰富。利用高通量测序技术对其中5个菌群丰富的发酵蔬菜样本进行测序,每个样本中细菌的属所占的丰度各不相同,乳杆菌属的丰度值在除样本HBZ1之外的4个样本中远远大于丰度值低的菌属,而在样本HBZ1中主要为乳杆菌属和片球菌属,其中片球菌属为优势菌属。与数据库比对鉴定出的4个优势菌中只有植物乳杆菌常见于研究资料中,而且4个优势菌种在5个样本中的丰度要远高于丰度低的菌种。
