多囊卵巢综合征中高雄激素诱导的颗粒细胞自噬激活作用
2021-03-20孙东梅柴蔚然匡延平王锋
孙东梅,柴蔚然,匡延平,王锋
1.山西医科大学基础医学院,山西 太原030000;2.上海交通大学医学院附属第九人民医院辅助生殖科,上海200011
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄妇女常见多方面紊乱的内分泌代谢异常疾病,具体病理过程尚未完全了解。PCOS 的病因主要包括遗传参数、表观遗传缺陷及环境因素。依据“PCOS鹿特丹诊断标准”,PCOS 已影响6% ~15%的育龄女性[1],该类不孕患者占排卵障碍性不孕患者的50% ~70%[2]。PCOS 患者除有高雄激素、慢性不排卵及多囊卵巢的主要症状外,还常伴有胰岛素抵抗、脂质代谢紊乱、能量代谢紊乱、肥胖、慢性低度炎症、内皮功能障碍及心血管疾病等[3-5],严重影响患者的生活质量。
有文章报道,自噬在PCOS 卵巢组织中被激活[6]。且自噬在PCOS 相关代谢紊乱中的作用日益被重视[7-8]。小泛素样修饰物(small ubiquitin-like modifier,SUMO)化修饰是多种细胞类型中重要的翻译后蛋白修饰,与自噬激活有关[9]。SUMO 特异肽酶3(SUMO specific peptidase 3,SENP3)是Sentrin / sumo特异性蛋白酶(SENPs)家族成员之一,能从蛋白中去除SUMO2 / 3,其表达与氧化应激密切相关,而PCOS 患者中的高雄激素血症也可引起卵巢氧化应激状态[10]。
本研究通过检测PCOS 患者与正常卵巢功能的不孕患者原代卵巢颗粒细胞自噬激活程度,探讨PCOS 患者中高雄激素血症与颗粒细胞自噬的关系。
1 对象与方法
1.1 研究对象 卵巢功能正常的不孕患者(对照组)和PCOS 不孕患者(PCOS 组)各30 例,于2018 年3—10 月在上海交通大学医学院附属第九人民医院辅助生殖科行控制性超排卵研究。纳入标准:年龄20 ~38 岁;身体质量指数(body mass index,BMI)18 ~24 kg / m2;卵巢功能正常,即月经周期在25 ~35 d,基础水平的促卵泡生成素(basal follicle stimulating hormone,bFSH)正常,窦状卵泡数(antral follicle count,AFC)大于5,抗苗勒氏管激素(anti-Mullerian hormone,AMH)正常;PCOS 患者的睾酮(testosterone)水平均高于0.7 nmol / L。排除标准:子宫内膜病变如子宫内膜息肉、子宫内膜炎、宫腔黏连、子宫肌瘤、子宫腺肌病、子宫内膜异位症等;近3 个月服用激素类药物及减肥药等;反复流产、染色体异常等;PCOS 患者的诊断标准按2003 年“PCOS 鹿特丹诊断标准”执行[11],排除其他原因引起的排卵障碍性疾病,如卵巢早衰、高泌乳素血症及甲状腺功能异常等。两组患者均选择孕激素下促排卵方案(progestinprimed ovarian stimulation,PPOS)进行控制性超排卵。所有入选患者均已签知情同意书,本研究方案获得上海交通大学医学院附属第九人民医院伦理委员会批准。
1.2 细胞及质粒 人卵巢颗粒细胞株KGN 由上海交通大学医学院附属第九人民医院内分泌科惠赠;SENP3 质粒由上海交通大学医学院生物化学分子实验室惠赠。
1.3 主要试剂及仪器 睾酮购自美国Sigma 公司;反转录试剂盒及SYBR Green 荧光染料购自宝生物工程(大连)有限公司;RT-PCR 引物购自生工生物工程(上海)股份有限公司;LipofectamineTM2000、Trizol裂解液、澳洲胎牛血清及双抗(青链霉素)购自美国Invitrogen 公司;PVDF 膜购自美国Milipore 公司;DMEM / F12 及Opti-MEM 培养基购自美国Hyclone公司;人淋巴细胞分离液、RIPA 裂解液及红细胞裂解液购自北京索莱宝科技有限公司;LC3Ⅱ/Ⅰ多克隆抗体(2775)、SENP3 抗体(5591S)购自美国CST 公司;β-actin 抗体(60008-1-lg)及羊抗小鼠IgG1(00011)购自美国Proteintech 公司;P62 抗体(ab-56416)购自英国Abcam 公司;BCA 蛋白定量试剂盒购自美国Thermo 公司;si-SENP3 基因序列由广州锐博生物有限公司提供(上游:5′-GGGCUGGAAAGGUUACUUCAADTDT-3′,下游:5′-UUGAAGUAACCUUUCCAGCCCDTDT-3′);实时荧光定量PCR 仪购自美国Applied biosystems 公司;Imagequant LAS-4000mini 电泳图像扫描仪购自美国GE 公司;羊抗兔IgG1(31460)及Nanodrop 紫外分光光度计购自美国赛默飞公司。
1.4 卵巢颗粒细胞的分离 分别收集PCOS 及对照组患者卵泡液,室温800 ×g离心5 min,弃上清;用3 ~5 mL PBS 重悬沉淀,于新15 mL 离心管中加入等体积的人淋巴细胞分离液,在上层缓缓加入PBS,保证液平面的完整性;室温800 ×g离心20 min,至两液体平面之间出现1 层白色的絮状物(即卵巢颗粒细胞);吸取全部白色絮状物,加入5 mL PBS 混匀,室温800 ×g离心5 min,弃上清,重复2 次;加入约1 mL 红细胞裂解液重悬沉淀,冰上裂解5 min,4 ℃,800 ×g离心5 min,弃上清(如红细胞裂解不完全可重复裂解);PBS 重悬沉淀,4 ℃,800 ×g离心5 min,弃上清,重复1 次;将1 ~3 份患者的细胞沉淀混合,-80 ℃保存备用。
1.5 卵巢颗粒细胞的培养及分组处理 用2 mL DMEM /F12 培养基(含10%胎牛血清及1%双抗)重悬细胞,接种6 孔板,于37 ℃,5% CO2条件下常规培养。将培养24 h 的PCOS 及对照组卵巢颗粒细胞吸弃培养基,PBS 轻轻洗涤细胞3 次,加入含10 μmol / L 睾酮的DMEM / F12 培养基(含10%胎牛血清及1%双抗),继续培养24 h 后进行后续检测。以未处理的PCOS 及对照组卵巢颗粒细胞为对照。
1.6 卵巢颗粒细胞自噬水平的检测 Western blot法检测经睾酮处理前后PCOS 及对照组卵巢颗粒细胞中LC3Ⅱ/Ⅰ及P62 蛋白表达水平。用RIPA 裂解液提取细胞总蛋白,BCA 试剂盒检测蛋白含量,上样量均为20 μg,经10% SDS-PAGE 分离,转PVDF膜,5%脱脂牛奶室温下封闭1 h;分别加入LC3Ⅱ/Ⅰ多克隆抗体(1 ∶1 000 稀释)及P62 抗体(1 ∶2 000稀释),4 ℃过夜;加入羊抗小鼠IgG1(1 ∶10 000 稀释),室温孵育1 h;暗室曝光。
1.7 卵巢颗粒细胞中SEN P3 基因m R N A 转录及蛋白表达水平的检测
1.7.1 基因mRNA 转录水平的检测 采用RTPCR。常规提取PCOS 及对照组卵巢颗粒细胞总RNA,按反转录试剂盒说明书反转录为cDNA,以其为模板进行PCR 扩增。SENP3引物序列见表1,引物由上海铂尚生物技术有限公司合成。PCR 反应按SYBR Green说明书进行。以GAPDH作为内参照,采用2-△△Ct对目的基因定量分析。
1.7.2 蛋白表达水平的检测 采用Western blot法,按1.6 项检测,一抗为SENP3 抗体(1 ∶1 000 稀释),二抗为羊抗兔IgG1(1 ∶10 000 稀释)。

表1 引物序列Tab.1 Sequences of primers
1.8 SEN P3 在自噬激活过程中作用的检测
1.8.1 KGN 细胞培养 将KGN 细胞置10 cm 培养皿中,加入15 mL DMEM / F12 培养基(含10%胎牛血清及1%双抗),置37 ℃,5% CO2培养箱培养,2 d换1 次液。转染前24 h,于2 mL DMEM / F12 培养基(含10%胎牛血清)中接种3 × 105个细胞,转染时,细胞融合度约为50%。
1.8.2 小干扰RNA(small interfering RNA,siRNA)转染 用250 μL Opti-MEM 培养基稀释siRNA 至终浓度为50 nmol / L;将5 μL LipofectamineTM2000 转染试剂加入250 μL Opti-MEM 培养基,轻轻吹打3 ~5 次混匀,室温静置5 min;将两种稀释液等体积混匀,室温静置30 min;转染混合物接种至6 孔板中,80 μL/孔,轻轻摇细胞板混匀,37 ℃,5%CO2培养箱中转染,4 ~6 h 后换新鲜培养基,继续培养48 h。
1.8.3 质粒SENP3 转染 用250 μL Opti-MEM 培养基稀释5 μL 质粒;将siRNA 替换为SENP3 质粒,其余操作同1.8.2 项。
1.8.4 KGN 细胞中LC3Ⅱ/Ⅰ及P62 蛋白表达水平的检测 采用Western blot 法,具体操作步骤同1.6 项。
1.9 睾酮对PC O S 患者颗粒细胞中SEN P3 蛋白表达影响的检测 Western blot 法检测PCOS 患者颗粒细胞经睾酮处理前后SENP3 蛋白表达水平,方法同1.7.2 项。
1.10 统计学分析 采用SPSS 20.0 软件进行统计学分析。所有试验重复3 次,数据以均数± 标准差(±s)表示,正态分布数据比较用t检验,非正态分布数据比较用Kruskal-Wallis H检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 PC O S 患者卵巢颗粒细胞自噬水平 结果显示,与对照组比较,PCOS 组卵巢颗粒细胞中LC3Ⅱ/Ⅰ蛋白表达水平显著升高(t= 7.31,P<0.01),P62 蛋白表达水平显著降低(t= 5.36,P<0.01),提示PCOS 患者卵巢颗粒细胞自噬激活。PCOS 组及对照组卵巢颗粒细胞经睾酮处理后,LC3Ⅱ/Ⅰ蛋白表达水平显著升高(t分别为10.23 和10.65,P分别<0.05 和<0.01),P62 蛋白表达水平显著降低(t分别为4.90 和3.85,P分别<0.01 和<0.05)。见图1 和图2。提示卵巢颗粒细胞在体外经睾酮处理后,颗粒细胞的自噬水平显著升高。
2.2 SEN P3 在患者卵巢颗粒细胞中的表达 结果显示,与对照组比较,PCOS 组卵巢颗粒细胞中SENP3基因mRNA 转录及蛋白表达水平均显著降低(t分别为30.26 和12.56,P均<0.05),见图3 和图4。
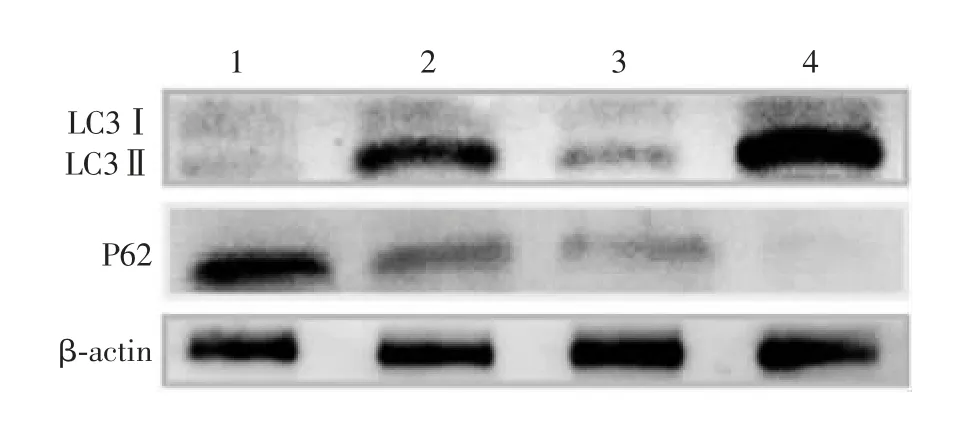
图1 Western blot 分析患者卵巢颗粒细胞经睾酮处理前后LC3Ⅱ/Ⅰ及P62 蛋白表达水平Fig.1 Western blotting of expression levels of LC3Ⅱ/Ⅰand P62 in ovarian granulose cells before and after treatment with testosterone

图2 患者卵巢颗粒细胞经睾酮处理前后P62(A)及LC3Ⅱ/Ⅰ(B)蛋白表达水平Fig.2 Expression levels of P62(A)and LC3Ⅱ/Ⅰ(B)in ovarian granulose cells before and after treatment with testosterone

图3 患者卵巢颗粒细胞中SENP3 蛋白表达水平的Western blot 检测Fig.3 Western blotting of expression of SENP3 in ovarian granulose cells

图4 患者卵巢颗粒细胞中SENP3 蛋白表达(A)及基因mRNA 转录(B)水平Fig.4 Expression levels of SENP3 protein(A)and mRNA(B)in ovarian gra-lnuose cells
2.3 K G N 细胞中SEN P3 对自噬的作用 KGN 细胞经siRNA 干扰后,SENP3 蛋白表达水平显著降低(t=7.91,P<0.01),LC3Ⅱ/Ⅰ蛋白表达水平显著上调(t= 10.13,P<0.01),P62 蛋白表达水平显著下降(t= 2.90,P= 0.04);KGN 细胞经SENP3 质粒转染后,SENP3 及P62 蛋白表达水平显著升高(t分别为4.28 和4.59,P均<0.01);LC3Ⅱ/Ⅰ蛋白表达水平无明显变化(t= 0.58,P= 0.59)。见图5 和图6。提示抑制SENP3 的表达可促进KGN 细胞的自噬水平,过表达SENP3 可部分抑制KGN 细胞的自噬水平,表明SENP3 蛋白表达的变化可影响KGN 细胞的自噬水平变化。
2.4 睾酮对PC O S 患者卵巢颗粒细胞中SEN P3 蛋白表达水平的影响 PCOS 组卵巢颗粒细胞经睾酮处理后SENP3 蛋白表达水平显著下降(t= 3.09,P<0.05),见图7 和图8。表明PCOS 患者体内高雄激素可通过抑制SENP3 蛋白表达激活卵巢颗粒细胞的自噬。

图5 KGN 细胞中SENP3、LC3Ⅱ/Ⅰ及P62 蛋白表达水平的Western blot 检测Fig.5 Western blotting of expressions of SENP3,LC3Ⅱ/Ⅰand P62 in ovarian granulose cells
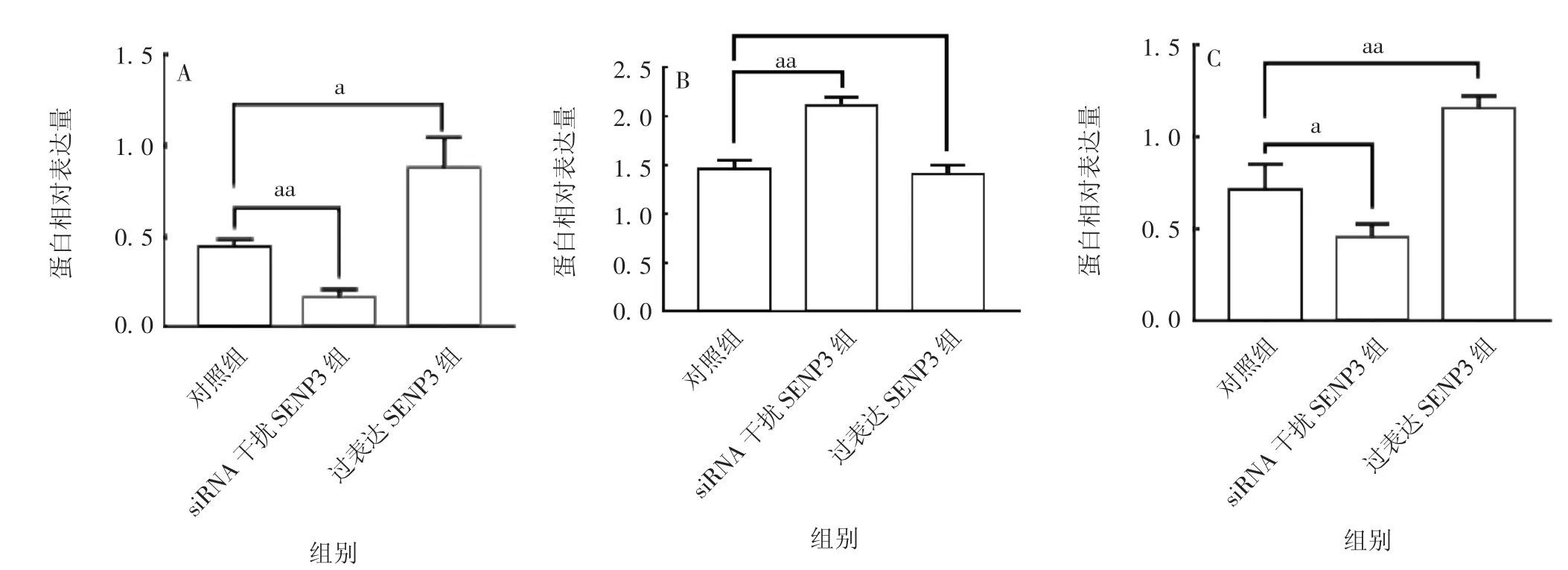
图6 KGN 细胞中SENP3(A)、LC3Ⅱ/Ⅰ(B)及P62(C)蛋白的表达水平Fig.6 Expression levels of SENP3(A),LC3Ⅱ/Ⅰ(B)and P62(C)in KGN cells
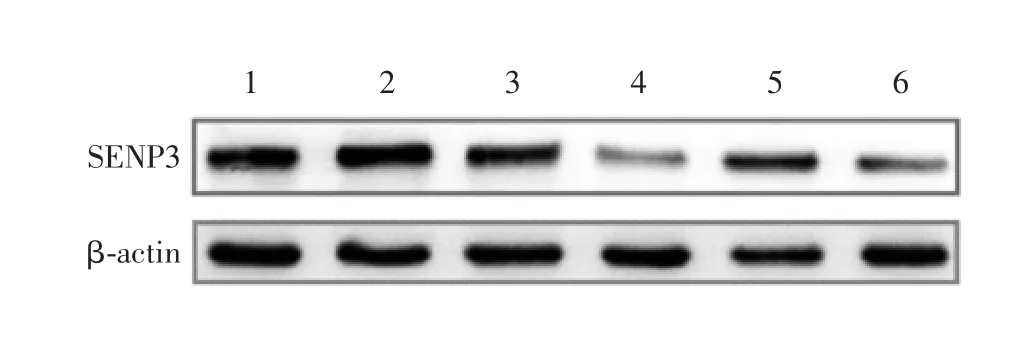
图7 PCOS 患者颗粒细胞中SENP3 蛋白表达水平的Western blot 检测Fig.7 Western blotting of expression of SENP3 in ovarian granulose cells of patients with PCOS
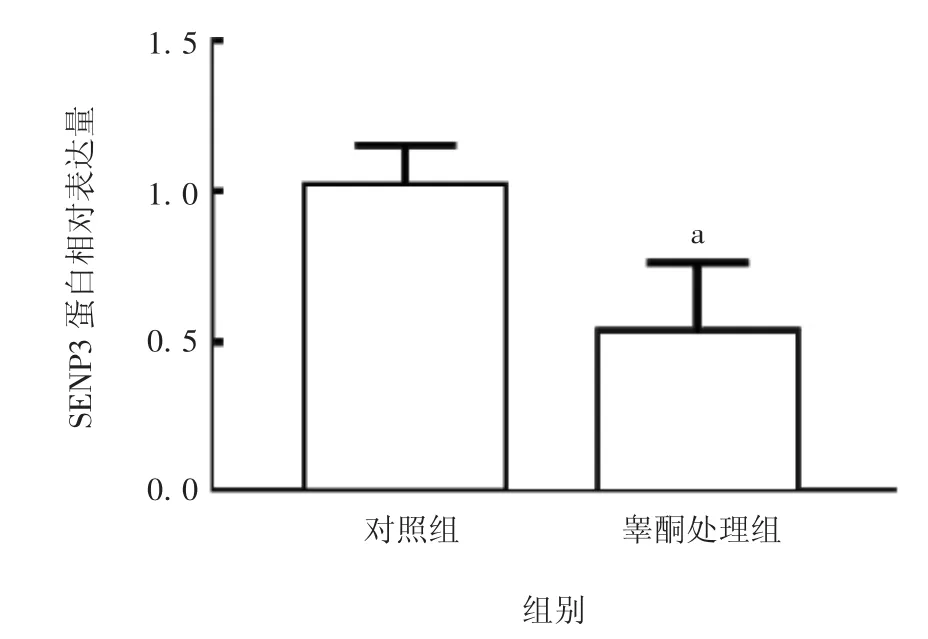
图8 PCOS 患者颗粒细胞中SENP3 的蛋白表达水平Fig.8 Expression level of SENP3 in ovarian granulose cells of patients with PCOS
3 讨 论
PCOS 患者雄激素分泌失调可导致功能性卵巢高雄激素血症(functional ovarian hyperandrogene mia,FOH)。FOH 能引起内分泌异常等系列代谢综合征,月经周期紊乱及稀发排卵或不排卵,直接导致女性不孕。有实验表明,雄激素可诱导小鼠卵巢颗粒细胞凋亡,在高雄激素诱导的PCOS 大鼠的模型中也发现了大鼠卵巢颗粒细胞凋亡明显增加[6]。
自噬在PCOS 相关代谢紊乱中的重要性越来越被重视。如自噬在控制炎症小体对代谢应激反应的激活方面具有重要作用[8]。肥胖中自噬基因在人类脂肪组织中上调,自噬被抑制并与脂肪功能障碍相关[7]。另外,巨噬细胞自噬在调节肥胖患者的全身胰岛素敏感性方面具有重要作用[12]。2 型糖尿病严重胰岛素抵抗患者骨骼肌中有几种自噬标志物受到抑制,长期高剂量胰岛素可能通过抑制自噬而产生胰岛素抵抗的恶性循环[13]。此外,自噬失调常与肥胖和糖尿病期间的心肌病及心功能障碍相关[14]。
近年来,有研究表明,PCOS 患者卵巢组织及颗粒细胞的自噬有明显的激活,在PCOS 的大鼠模型中,卵巢组织的自噬激活明显高于对照组[9]。本研究结果表明,与对照组比较,PCOS 患者体内卵巢颗粒细胞自噬被明显激活,且在高雄激素作用下卵巢颗粒细胞的自噬激活程度明显增加,表明PCOS 的FOH 对卵巢颗粒细胞的激活有一定的作用。
蛋白质与SUMO 的共价结合而影响蛋白质功能的过程定义为SUMOylation[15],这些SUMO 蛋白参与DNA 修复、自噬及信号转导等多种生物学过程。有研究表明,细胞SUMOylation 状态的平衡在自噬的调控中起重要作用,其对细胞生理及生存的影响有正负两方面,具体取决于组织类型[16]。SENP3 是SUMO 的特异性蛋白酶,通过对底物去SEMO 化发挥功能,SENP3 可对p300、p53、PML 等实行去SUMO化[17],从而影响细胞的凋亡、增殖及自噬等。本研究中,PCOS 患者卵巢颗粒细胞SENP3 显著低表达(P<0.05),且经siRNA 干扰后,KGN 细胞中LC3Ⅱ/Ⅰ蛋白表达水平上调(P<0.01),而P62 蛋白表达水平降低(P<0.05),过表达SENP3 后,KGN 细胞中LC3Ⅱ/Ⅰ蛋白表达水平无明显变化,而P62 蛋白表达水平上升(P<0.01),表明抑制SENP3 在KGN自噬激活过程中有重要作用,且过表达SENP3 可能对自噬的下游通路有更明显抑制作用。为探究雄激素对卵巢颗粒细胞自噬激活是否可通过影响SENP3的表达而发挥作用,用高雄激素睾酮处理PCOS 组及对照组卵巢颗粒细胞,SENP3 蛋白表达水平下降,且差异有统计学意义(P<0.05),提示PCOS 患者体内睾酮可通过抑制SENP3 的表达激活卵巢颗粒细胞的自噬。因此,在PCOS 患者卵巢颗粒细胞上,SENP3 参与了睾酮对细胞的自噬激活作用。
本实验存在收集的PCOS 患者颗卵巢粒细胞样本量较小,且高雄激素的特征不典型等不足之处,后期还需大量样本验证实验的结果;SENP3 在高雄激素激活颗粒细胞的自噬过程中的具体机制尚不清楚,需进一步探究高雄激素血症对卵巢颗粒细胞的激活是否会直接影响卵母细胞的发育成熟尚需进一步实验探究。
综上所述,PCOS 患者卵巢颗粒细胞有明显自噬激活,且FOH 可通过抑制SENP3 对卵巢颗粒细胞的自噬产生激活作用,表明在PCOS 患者的病理生理机制中,FOH 可能会通过对卵巢组织及颗粒细胞的自噬激活参与PCOS 患者发病机制。本文对研究PCOS 患者发病机制提供了一定的参考。
