蜂粮中Lactobacillus kunkeei 的益生特性研究
2021-03-18章璐婷李瑾萌王一丁邵欢欢赵金星马沁沁
章璐婷, 李瑾萌, 王一丁, 雍 彬, 谢 洁, 邵欢欢, 赵金星, 马沁沁
(四川师范大学 生命科学学院,四川 成都 610101)
据世界卫生组织统计,全球50%以上的死亡是缺血性心脏病等疾病引起的[1]。 研究表明,动脉粥样硬化(atherosclerosis,AS)是缺血性心脏病的主要原因,而高胆固醇血症是动脉粥样硬化的致病因素[2]。据报道,血脂和胆固醇水平仅降低1%,患缺血性心脏病的风险就可降低2%~3%[3]。 目前,主要的降血脂药物有阿托伐他汀、辛伐他汀、瑞舒伐他汀等。 这些药物几乎都有副作用,如便秘、腹痛、胃肠胀气、过敏反应综合征等,且用药成本较高[4-5]。 早在1970年,Mann 和Spoerry 就发现摄入用野生乳酸杆菌发酵的乳制品后,人体血清胆固醇水平降低[6]。 乳酸杆菌可以调节人体的胃肠道菌群,具有降低血脂和降低心血管疾病发病率的作用,且没有副作用。
乳酸杆菌是一种通常被认为安全(generally recognized as safe,GRAS)的菌株[10]。 因此,寻找乳酸杆菌菌源并筛选出合适的菌种显得尤为重要。 蜂粮是植物花粉、蜂蜜和蜜蜂唾液的发酵混合物,可食用。 蜜蜂采集的花粉与少量蜂蜜和唾液混合,在蜂巢中发生化学变化,形成具有营养价值的蜂粮产品[7]。 也有研究表明,乳酸杆菌广泛分布于蜜蜂肠道,对蜂粮发酵起重要作用[8]。 蜂粮部分发酵,易被生物体吸收,因此具有更好的消化率和更丰富的化学成分,能补充人体缺乏的维生素,并有助于消除体内各种毒素[9]。 因此,作者拟从蜂粮中分离筛选出具有优良益生特性的降胆固醇乳酸杆菌菌株,为益生菌开发提供新的菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 蜂粮蜂粮取自四川省成都市龙泉驿区同安镇。
1.1.2 主要试剂邻苯二甲醛、红霉素、卡那霉素、万古霉素、 诺氟沙星:Sigma-Aldrich 西格玛奥德里奇(上海)贸易有限公司产品;胆固醇:成都市科隆化学品有限公司产品;牛胆盐:北京奥博星生物技术有限责任公司产品;冰醋酸、浓硫酸、无水乙醇、正己烷均为分析纯:国药集团化学试剂有限公司产品;D3350-01 Bacterial DNA Kit:Omega Bio-Tek 公司产品;2×Taq Master mix:天根生化科技(北京)有限公司产品。
1.1.3 培养基MRS 肉汤、MRS 琼脂、TSB 肉汤:广东环凯微生物科技有限公司产品;Iso-Sensitest 肉汤:赛默飞世尔科技公司产品;MRS-CHOL 培养基:0.1 g/L 胆固醇,0.24 g/L 牛胆盐,0.12 g/L 蔗糖酯,1.2 mL/L 吐温80,充分混匀后,用玻璃棒碾碎后加入5 mL/L 冰醋酸, 混合液40 ℃超声处理20 min,0.45 μm 滤膜过滤处理后迅速加入1 L MRS 肉汤,同时迅速搅拌,形成均匀稳定的胶体溶液[11];MRSCaCO3固体培养基:MRS 琼脂,2 g/dL CaCO3。
1.1.4 仪器与设备PowerCycler SL 96 Gradient PCR 自动系列分析仪:安捷伦科技(中国)有限公司产品;YZB/GER 1841-2014 台式高速离心机: 赛默飞世尔(中国)有限公司产品;AR224CN 电子天平:奥豪斯仪器(上海)有限公司产品;HZQ-211C 落地恒温培养箱: 上海一恒科学仪器有限公司产品;Anoxomat MarkⅡ 厌氧培养装置: 荷兰MART 微生物公司产品;WD-12 氮吹仪:杭州奥盛仪器有限公司产品;WFJ7200 可见分光光度计:尤尼柯(上海)仪器有限公司产品。
1.1.5 菌株大肠埃希氏菌(Escherichia coli ATCC 25922)、 金黄色葡萄球菌 (Staphylococcus aureus ATCC 29213): 四川大学生命科学学院生物资源与生态环境教育部重点实验室馈赠。
1.2 方法
1.2.1 乳酸杆菌的分离与鉴定取蜂粮样品25 g溶于200 mL 无菌生理盐水,充分混匀,用无菌生理盐水进行 10 倍梯度稀释, 吸取 10-3、10-4稀释液倾注于MRS-CaCO3固体培养基中,充分混匀,37 ℃培养48 h。 挑取具有溶钙圈的单菌落划线于MRS 琼脂上纯化。 将3 次纯化后的单菌落进行革兰氏染色,观察细胞特征,挑选革兰氏阳性,杆状菌株进行后续研究。 挑取单菌落接种于MRS 肉汤,加体积分数50%甘油保存于-20 ℃。
将筛选得到的纯菌株37 ℃培养48 h, 离心收集菌体细胞, 用D3350-01 E.Z.N.A.Bacterial DNA Kit 提取细菌总 DNA。 用细菌通用引物 27F (5′-AGAGTTTGATCCTGGCTCAG-3′) 和 1492R (5′-TACGGTTACCTTGTTACGACTT-3′) 扩增细菌 16S rRNA 基因, 扩增产物送成都擎科梓熙生物技术有限公司测序,测序结果在NCBI(http://blast.ncbi.nlm.nih.gov/) 进行 Blastn 比对。 基于 61 株菌株 16S rRNA 基因序列,用MEGA 6.06 构建系统发育树[12],分别采用邻接法 (neighbour-joining,NJ) 及最大似然 法 (maximum likelihood,ML)。 将 Lactobacillus plantarum(AP018405)[13],Lactobacillus delbrueckii(CP 013610)[14],Lactobacillus acidophilus (CP010432)[15],Lactobacillus kunkeei (KX926549),Lactobacillus kunkeei(MG496059),Lactobacillus kunkeei(KY4968 52)作为参考菌株,将 Enterococcus faecalis (CP030 044)作为外类群。
1.2.2 邻苯二甲醛法测定体外降胆固醇能力
1) 绘制标准曲线 用无水乙醇配制质量浓度为 0.1 g/L 的胆固醇标准液。 准确吸取 0、0.2、0.4、0.6、0.8、1.0 mL 标准液于 25 mL 带塞试管中, 加无水乙醇定容至1 mL。 加入4 mL 邻苯二甲醛溶液,涡旋混匀,室温静置10 min 后加入2 mL 浓H2SO4,涡旋混匀, 室温静置10 min 待其显色完全, 测定A550nm, 相同条件下不加胆固醇标准液的样品作为对照。
2)样品处理和检测 以体积分数5%接种量接种0.5 麦氏比浊度菌悬液于30 mL MRS-CHOL 培养基中,37 ℃、120 r/min 震荡, 培养 24 h 后, 取 1 mL 培养液,8 000 r/min 离心 5 min,取 0.5 mL 上清液于25 mL 带塞试管中, 加质量分数50% KOH 溶液2 mL 及体积分数95%无水乙醇3 mL, 涡旋混匀,60 ℃水浴 10 min 后立即冰水浴处理 5 min,同时加入5 mL 正己烷,涡旋混匀30 s,加入3 mL 蒸馏水,盖上塞子,充分涡旋混匀。 取3 mL 正己烷于干净的试管中,60 ℃ 氮气吹干溶剂后, 加入4 mL邻苯二甲醛溶液彻底混匀, 再加入2 mL 浓H2SO4溶液,立即涡旋混匀,室温放置10 min 待反应充分,再加入少量浓 H2SO4于 10~90 min 内测定 A550nm。对照组接种同样体积分数的MRS 肉汤并做相同处理,每组 3 个平行[16]。

式中:C对照为未接种菌株的MRS-CHOL 培养基中胆固醇的质量浓度,(μg/mL);C样品为发酵液上清液中胆固醇的质量浓度,(μg/mL)。
筛选出具有胆固醇降解活性的菌株进行后续益生特性研究。
1.2.3 耐酸实验将筛选的菌株传代培养3 次,取37 ℃培养 48 h 后 1 mL 的发酵液 10 000 r/min 离心7 min,收集菌体,用pH 6.4 的无菌PBS 溶液洗涤两次, 分别用 1 mL pH 为 2.0、3.0、6.4 的 PBS 进行重悬, 转移至 9 mL 对应酸度的 PBS 溶液中,37 ℃厌氧培养,分别在 0、1、2、3 h 取样,采用平板计数法检测活菌数,每组3 个平行[17]。
治疗前、后4周空腹8 h以上检测空腹血糖及餐后2 h血糖水平。临床疗效评价标准:显效:通过相应的治疗,患者临床症状得到显著地改善,肺功能明显提升;有效:经过治疗,患者临床症状有一定程度的缓解,肺功能有所提升;无效:治疗之后,患者临床症状并未改善或者加重,肺功能无变化或者降低。总有效率=显效率+有效率。
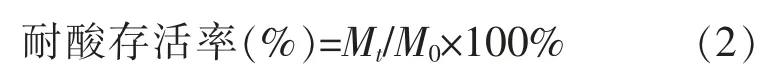
式中:Mt为所筛菌株经过 pH 为 2.0 或 3.0 的 MRS肉汤分别处理 0、1、2、3 h 后的活菌数;M0为所筛菌株经过 pH=6.4 的 MRS 肉汤分别处理 0、1、2、3 h 后的活菌数。
1.2.4 胆盐耐受实验以体积分数10%接种量接种0.5 麦氏比浊度菌悬液于质量分数0.3%胆盐,pH 3.0 的 MRS 肉汤培养基中,37 ℃厌氧培养[3]。 分别在0、3、5 h 取样,采用平板计数法检测活菌数,每组3个平行[18,9]。

式中:Nt为所筛菌株经过pH 3、 胆盐质量分数为0.3%的 MRS 肉汤处理 3、5 h 后的活菌数;N0为所筛菌株经过pH 3、胆盐质量分数为0.3%的MRS 肉汤处理0 h 后的活菌数[20]。
1.2.5 微量肉汤法测定L.kunkeei 菌株最低抑菌浓度先在无菌96 孔板第1—11 列孔中加入100 μL无菌Iso-Sensitest 肉汤培养基, 然后在第1 列孔中加入质量浓度为16 μg/mL 的抗生素溶液100 μL,逐次倍比稀释至第11 列 (终质量浓度分别为8、4、2、1、0.5、0.25、0.125 μg/mL), 每孔抗生素终体积为100 μL。 每孔依次加入 0.5 麦氏比浊度菌悬液100 μL, 使终体积为 200 μL。 以 200 μL/孔的无菌ISO 肉汤作为阴性对照,200 μL/孔菌液作为阳性对照,37 ℃静置培养18 h,用酶标仪检测A600nm(每组3个平行)[21]。测量结果根据美国临床和实验室标准协会 (clinical and laboratory standards institute,CLSI)颁布的 《乳酸菌种类-微量肉汤稀释法敏感性试验信息及解释标准》[22]判定和分析。
1.2.6 琼脂扩散法测定乳酸杆菌抑菌特性挑取菌斑,接种于 5 mL MRS 肉汤,37 ℃、120 r/min 摇床培养48 h。 取乳酸杆菌发酵液10 000 r/min 离心10 min 得上清液,将上清液立即过滤(0.22 μm)除菌体细胞,4 ℃冷藏待用。 以体积分数0.1%接种量分 别 将 大 肠 埈 希 氏 菌 (Escherichia coli)ATCC 25922、 金黄色葡萄球菌 (Staphylococcus aureus)ATCC 29213 与LB 琼脂混匀后倾倒于平皿中待凝,平皿中事先放好已灭菌的牛津杯, 待琼脂凝固后,轻轻取出牛津杯在形成的琼脂孔中分别加入100 μL 除菌后的发酵上清液,37 ℃厌氧培养24 h后测量抑菌圈的直径(mm),每组 3 个平行[18,23]。
2 结果与分析
2.1 16S rRNA 基因同源性鉴定
将测序结果进行Blastn 比对,61 株菌株的部分16S rRNA 基因序列与Lactobacillus kunkeei 的 16S rRNA 序列的同源性达到99%以上。 通过NJ 及ML算法构建的菌株系统进化树拓扑结构基本一致。 如图1 所示,ML 树显示所有菌株均属同一类群,均为Lactobacillus kunkeei。作为蜜蜂常见的有机共生体,L.kunkeei 是最主要的乳酸杆菌菌种, 也是蜂房花粉的优势菌种[27],能够特异性附着于上皮细胞表面[28-29]。 本研究中蜂粮样品采自夏季,可能是分离菌种单一的主要原因。
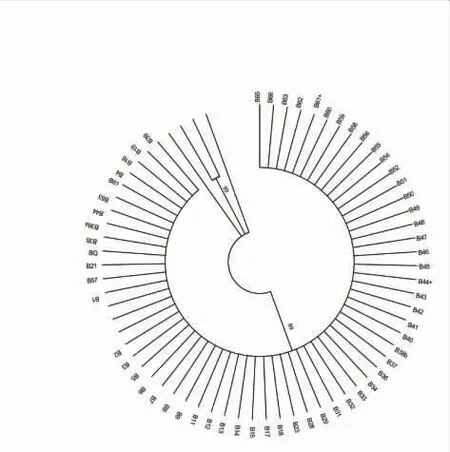
图1 61 株L.kunkeei 的系统发育树Fig.1 Phylogenetic tree of 61 L.kunkeei strains
2.2 体外降胆固醇活性分析
高胆固醇血症是目前威胁人类健康的重大问题, 乳酸杆菌具有去除胆固醇和降低血脂的作用。通过邻苯二甲醛法检测61 株L.kunkeei 的胆固醇去除能力, 发现其中 5 株菌(B6,B23,B28,B35,B45)胆固醇去除率为 15.87%~29.07%(图2),B6 和B35、B45 对降胆固醇的去除率均高于25%, 其中B35 去除胆固醇的能力最强,达到(29.07±1.30)%,该结果优于Ley 和Bosch 等在相同条件下检测的L.bulagaricus 和 L.plantarum 的降解率[30-31]。 该结果表明,B35 菌株具有较高的胆固醇降解作用,但目前降解机制尚不明确,有待进一步研究。
2.3 耐酸特性研究分析
筛选作为益生菌的乳酸杆菌前提条件是能在一定时间内耐受胃液的酸度,人体胃液的酸度主要随饮食结构的变化而变化, 空腹状态下胃液pH 值为0.8~0.9,进食过程中,pH 值范围变化较大,达到1.8~5.0,通常情况维持在3.0,食物在胃中停留时间一般为 1~3 h[32]。 当用 pH 3.0 的 PBS 处理 3 h 后,5株L.kunkeei 均表现为生长,存活率分别为(72.55±0.11)%、(77.70±0.15)%、(81.39±0.33)%、(84.59±0.12)%、(88.43±0.15)%(图3)。 说明 5 株 L.kunkeei都能很好地耐受胃液的酸性条件。 该结果优于Tulumoglu 等从Tulum 奶酪中分离的植物乳酸杆菌对酸性条件的耐受[17]。 当用pH=2 的PBS 缓冲液处理 3 h 后, 除B35 外, 其余菌株存活率显著降低(P<0.05)。 B35 在 3 h 后的存活率达到 (35.71±0.11)%。 实验结果表明,5 株 L.kunkeei 能耐受餐后胃环境的酸度,顺利进入肠道,发挥益生功能,其中B35 的耐酸能力最强。

图2 5 株 L.kunkeei 胆固醇去除率(n=3)Fig.2 Cholesterol assimilation rate of 5 strains of L.kunkeei(n=3)

图3 在酸性条件下5 株L.kunkeei 的存活率Fig.3 Survival rate of 5 L.kunkeei strains under acidic condition
2.4 胆盐耐受性分析
在生物体内,胆盐作为一种生物清洁剂,通过其乳化和水解脂质的能力使其在脂肪的消化中起着十分重要的作用[33],是否能在一定时间内耐受高胆盐浓度是作为益生菌的乳酸杆菌在肠道中生存和增殖的前提条件[31]。 以在酸性(pH 3.0)厌氧条件,在质量分数0.3%的胆盐条件下菌株存活率评价菌株胆盐耐活性。 如图4 所示,所筛选的5 株菌都具有一定胆盐耐受能力。 在此高胆盐质量分数下处理5 h 后,5 株菌的存活率菌均超过50%,其中B35 存活率达到(57.27±2.30)%,这与 Anandharaj 的结果相近[3]。说明所筛选的5 株L.kunkeei 能够在小肠内存活并发挥益生性能。
2.5 抗生素耐受性分析
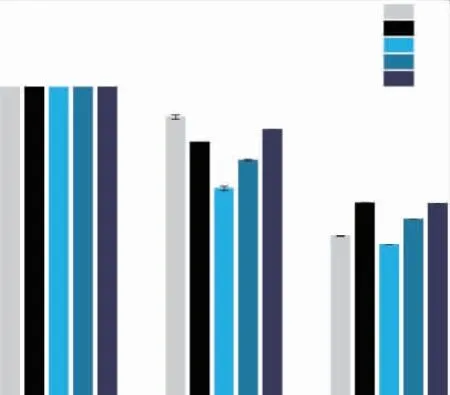
图4 5 株 L.kunkeei 的胆盐耐受性(n=3)Fig.4 Bile salt tolerance of 5 strains of L.kunkeei(n=3)
备选益生菌的菌株首要要求是对人体绝对安全,不能具有潜在可转移的抗生素耐药基因[34]。根据CLSI 《乳酸菌种类-微量肉汤稀释法敏感性试验信息及解释标准》[22],5 株菌对4 种临床常用抗生素都高度敏感(表1)。 乳酸杆菌通常被认为对万古霉素有耐药性[35],而本研究中所有菌株均对万古霉素敏感。所有菌株分离于四川地区的蜂粮,Fei-li Xu 等[36]及Qinqin Ma[37]等分别在我国市售乳制品和四川地区泡菜中发现对万古霉素敏感的乳酸杆菌。 这可能是由于地区特异性造成的,其原因尚不明确。 上述结果表明,5 株L.kunkeei 对受试抗生素敏感,携带相应耐药基因风险很低,可作为益生菌菌种使用。

表1 5 株L.kunkeei 对抗生素的最低抑菌质量浓度Table 1 Minimum inhibitory concentration of antibiotics for 5 L.kunkeei strains
2.6 抑菌活性分析
以抑菌圈直径评价L.kunkeei 抑菌活性, 结果见表2。 5 株L.kunkeei 发酵液对常见革兰氏阴性(E.coli,ATCC 25922) 和 革 兰 氏 阳 性 病原 菌 (S.aureus,ATCC 29213) 的生长均有不同程度的抑制。B6、B23、B28 及 B35 对 E.coli 及 S.aureus 抑菌作用效果无显著性差异(P>0.05),而B45 的抑菌能力偏弱(P<0.05)。 B6、B23、B28 及 B35 发酵液有广谱抑菌性,这与陈秀金等人的研究结果一致[38]。这4 株L.kunkeei 具有良好的抑菌活性, 可以在肠道内抑制致病菌的生长,具备构建健康的肠道菌群,调节肠道微环境的潜力。

表2 5 株L.kunkeei 对常见致病菌抑菌活性(n=3)Table 2 Bacteriostatic activities of 5 L.kunkeei strains to E.coli and S.aureus (n=3)
2.7 Caco-2 细胞黏附特性
选择胆固醇降解能力及对酸与胆盐耐受性都最强的B35 进行体外黏附Caco-2 细胞能力的测定。 B35 的初始浓度 1.616×108CFU/mL。 与 Caco-2细胞作用后,B35 的浓度分别为5.36×106CFU/mL。B35 的黏附率为3.32%,与占萌等[24]对乳酸杆菌的黏附性测定结果相比较,B35 的黏附性低于商用嗜酸乳杆菌NCFM 的黏附性,但明显高于鼠李糖乳杆菌。 表明B35 可在肠道定殖,且不会由于长期定植而造成肠道微生物系统的紊乱。
3 结 语
作者自蜂粮种分离到61 株菌株,从中筛选到5株具有较强降解胆固醇能力的菌株,其中B35 菌株降胆固醇能力最强。 乳酸杆菌进入肠道需经过胃的低pH 环境和肠道的高胆盐环境,通过对酸耐受、胆盐耐受、抗生素耐受、抑菌活性等益生特性的检测,发现B35 菌株性能最佳,可作为良好的益生菌菌种资源。 下一步将对B35 进行体内实验,探索其在体内的降解胆固醇效果,并对其降解胆固醇的机制进行进一步研究。
