黄花菜八氢番茄红素脱氢酶基因HcPDS 的克隆及VIGS 转化表达验证
2021-03-18程宵婧侯非凡公菲菲亢秀萍邢国明
李 森,程宵婧,侯非凡,公菲菲,刘 娟,杜 崴,亢秀萍,邢国明
(1.山西农业大学 园艺学院 / 山西省设施园艺工程技术中心,山西 太谷 030801 ;2.大同黄花产业发展研究院,山西 大同 037004)
黄花菜(Hemerocallis citrina Baroni)是百合科(Liliaceae)萱草属(Hemerocallis L.)宿根草本植物,是一种兼具食用、观赏与药用价值的多功能特色蔬菜,因具有重要经济价值而受到广泛关注。目前在山西、湖南、甘肃等主产区,黄花菜已成为发展特色农业的代表性作物。黄花菜遗传背景复杂,基因组庞大(约3.2 Gb),目前遗传转化体系不完善,获得转基因植株难度较高,导致基因功能研究相对滞后。
八氢番茄红素脱氢酶(Phytoene desaturase,PDS)是植物类胡萝卜素合成途径中的关键酶[1],位于类胡萝卜素合成途径的上游,它能催化无色的八氢番茄红素脱氢,生成ζ-胡萝卜素,继而生成番茄红素,转变为有色的类胡萝卜素[2]。以烟草脆裂病毒(Tobacco rattle virus,TRV)作为载体诱导的基因沉默(Virus induced gene silencing,VIGS)是一种新型的反向遗传学研究工具,已在多种植物中成功鉴定了上百种基因,广泛应用于植物抗病、逆境胁迫及信号转导等相关基因的研究[3-5]。当PDS 基因被沉默时,植物类胡萝卜素合成途径受阻,植株会表现出较为明显光漂白现象[6],因此其常作为参照基因来评价VIGS 体系是否构建成功[7]。Zhong 等人利用烟草脆裂病毒(Tobacco rattle virus,TRV)作为病毒载体,插入PDS 基因后构建重组病毒载体TRV-PDS,真空侵染唐菖蒲球茎和幼嫩植株,使叶片出现了不同程度的光漂白现象[8]。WEGE等人在花菱草的茎尖、叶背、叶柄注射含有TRVPDS 的农杆菌菌液,2 周后92% 的植株花瓣、果实、嫩枝及叶片开始出现不同程度的光漂白现 象[9]。徐华利用TRV-PDS 菌液侵染百合幼苗后,叶片出光漂白现象[10]。
本课题组前期对黄花菜地方品种‘大同黄花’的不同组织器官进行了转录组测序,测序结果中得到功能注释为Phytoene desaturase 的Unigene 序列。本研究通过PCR 技术克隆得到此Unigene 全长作为黄花菜PDS 基因序列(HcPDS),利用生物信息学分析手段对HcPDS 基因翻译所得的蛋白质结构、性质和功能进行了分析,构建了携带HcPDS 基因片段的VIGS 重组病毒载体,并通过农杆菌侵染黄花菜实生苗验证其效果,建立了黄花菜VIGS 转化体系,为黄花菜功能基因的分析研究提供了技术支持。
1 材料与方法
1.1 试验药品
基因克隆载体pMD™19-T 购于TaKaRa 公司,目录号为6013。用于建立VIGS 体系的TRV 病毒载体(pTRV1、pTRV2)由山西农业大学徐进课题组惠赠。大肠杆菌(DH5α 感受态细胞)购于天根生化科技(北京)有限公司,目录号为CB101。农杆菌(GV3101 感受态细胞)购于北京庄盟国际生物基因科技有限公司,目录号为ZC141。
1.2 黄花菜幼苗培育
供试植物材料为‘大同黄花’(Hemerocallis citrina cv. ‘Datonghuanghua’)。秋季收集‘大同黄花’自然授粉后所形成的种子。参考侯非凡[10]的方法进行种子催芽,具体步骤如下:用自来水冲洗干净种子表面的杂质,用75%乙醇浸泡种子约1 min,然后用灭菌蒸馏水将种子冲洗2 次,之后将种子放置在铺有吸水纸和纱布的培养皿中,种子上面再覆盖1 层浸湿纱布,将培养皿放于28 ℃光照培养箱中进行催芽。种子约10 d 后开始露白,露白的种子播种于基质配比为草炭∶珍珠岩∶蛭石=3∶1∶1 的穴盘中,取28 d 龄的幼苗用于后续试验。
1.3 HcPDS 基因片段的克隆
课题组前期对‘大同黄花’根、花、叶进行了转录组测序。通过筛查测序所得数据库,找到功能注释为PDS 的Unigene 序列c50463.graph_c0,在UTR(Untranslated region)区设计特异性扩增引物cPDS-F。提取‘大同黄花’的总RNA,反转录为cDNA,并以cDNA 为模板进行PCR 扩增。RNA 提取和反转录、PCR 扩增和产物回收、T 载体的连接方法同公菲菲[11],连接T 载体后转化大肠杆菌,挑取单菌落进行菌液PCR,选取与目的条带一致的菌液送北京华大基因进行Sanger 测序。
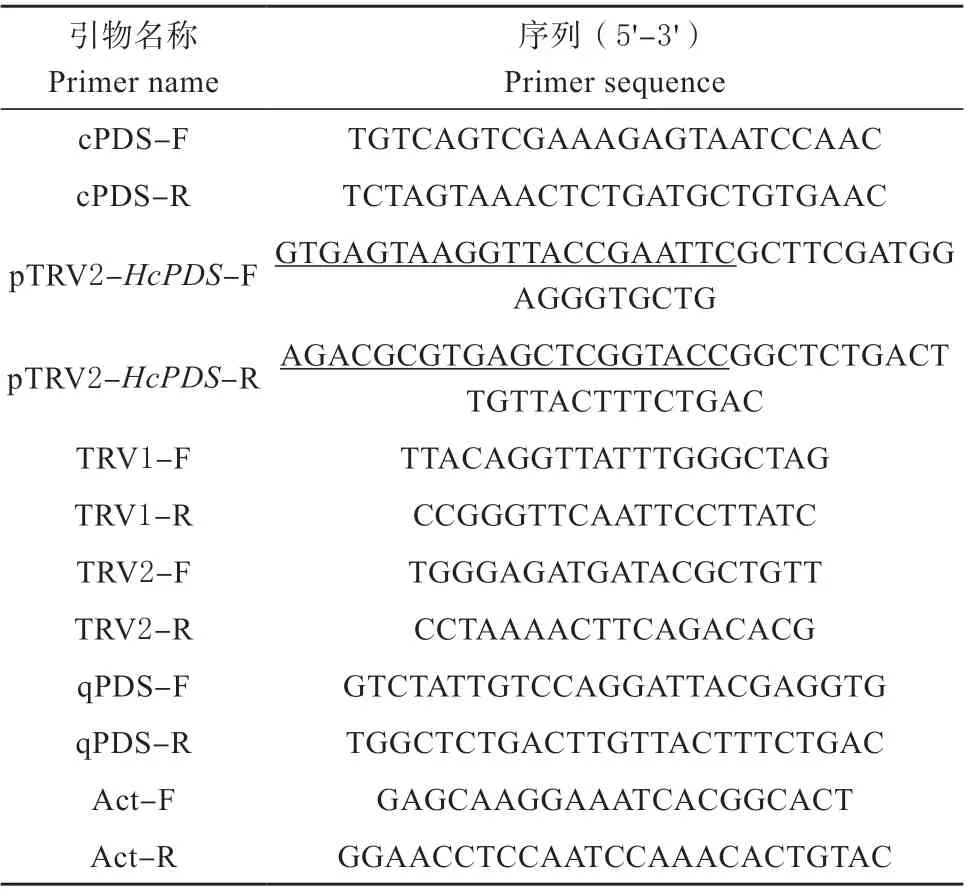
表1 黄花菜HcPDS 基因VIGS 沉默体系构建所涉及引物Table 1 Primers for VIGS transformation system of HcPDS gene in Hemerocallis citrina
使用DNAMAN7.0 对测序得到的序列与转录本c50463.graph_c0 参考序列进行比对和校准;通过NCBI-blastX 进行物种间序列比对,定义克隆序列;使用ExPASy -Translate tool 软件(https://web.expasy.org/translate/)翻译得到氨基酸序列,并使用NCBI-CD Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi))进行蛋白保守结构域分析。
1.4 蛋白序列分析
使用P r o t P a r a m(h t t p://w e b.e x p a s y.o rg/protparam/)、Protscale(https://web.expasy.org/protscale/)对HcPDS 蛋白的基本理化性质、亲疏水性进行预测分析。在 NCBI-blastp 进行同源性比对,下载相关基因的蛋白序列,使用MAFFT 进行多重序列比对,然后使用MEGA5.0 构建蛋白进化树,采用NJ 法(Neighbor joining method)构建系统进化树,Bootstrap 值由1000 次重复得到[12]。
1.5 重组病毒载体pTRV2-HcPDS 构建
针对HcPDS 中322 bp(CDS 区段+3’UTR 区段)特异性片段,使用Snapgene 设计引物。设计引物时,在HcPDS 特异性片段两端分别选18 ~ 25 个碱基,再加上TRV2 空载的EcoR I 酶切位点左侧和Kpn I 酶切位点右侧的20 个左右碱基合成扩增引物pTRV2-HcPDS-F/R。用含有HcPDS 正确测序结果的质粒作为模板进行普通PCR 扩增反应,扩增体系和反应程序同公菲菲(退火温度为56 ℃)[11]。PCR 产物经琼脂糖凝胶电泳检测后,切胶回收 目的片段。
使用EcoR I、Kpn I 对pTRV2 载体进行37 ℃过夜酶切,然后回收pTRV2 载体。切胶回收产物与经过双酶切后的pTRV2 载体进行重组连接,将连接产物转入大肠杆菌DH5α 感受态细胞后,在含有卡那霉素Kan(50 μg/mL)的培养条件下筛选转化子,提取转化子质粒并交由北京华大测序公司测定序列信息,将测序正确的菌液扩增培养后抽提质粒,得到重组表达载体,命名为pTRV2-HcPDS。
1.6 VIGS 体系的构建
参考唐菖蒲和百合构建黄花菜VIGS 侵染的方法体系[8-9]。将1 μg pTRV2-HcPDS 质粒转入农杆菌(GV3101 感受态细胞)中,热激法进行转化。在含卡那霉素和利福平抗性的LB 固体培养基中28 ℃培养2 ~3 d 后筛选单菌落,挑取单菌落转入加有500 μL 抗性LB 液体培养基的1.5 mL 离心管中,28 ℃ 200 r/min 过夜培养,同时培养pTRV1 菌株和pTRV2 空载菌株。使用引物TRV1-F/R 和TRV2-F/R进行菌液PCR,选取阳性克隆扩大培养,扩增体系和反应程序同1.5 中的PCR 程序(退火温度为56 ℃)。将100 μL 菌液加入装有7 ~8 mL 抗性LB 液体培养基的50 mL 离心管中,28 ℃ 200 r/min 过夜培养。第2 天吸取3 mL 浑浊菌液加入到装有150 mL 抗性LB 液体培养基的500 mL 锥形瓶中,28 ℃ 200 r/min过夜培养。第3 天将锥形瓶中浑浊的菌液分装到50 mL离心管中,5 000 r/min 离心8 min 集菌。
向离心管中加入当天配制的侵染液(10 mmol/L MES + 200 mmol/L 乙酰丁香酮 + 10 mmol/L MgCl2)来悬浮菌液,使各菌液OD600=1.0,把菌液按照VTRV1∶VTRV2=1∶1 和VTRV1∶VTRV2-HcPDS=1∶1 混 合,混合后在暗处静置4 ~6 h。用纱布将28 d 龄的黄花菜幼苗包好浸没在侵染液中,真空抽至7 000 Pa 后保压5 min,再缓慢放气10 min,重复1 次。在自来水下冲洗幼苗数次,将幼苗根部浸入水中,10 ℃放置 2 d,再定植于基质(草炭:珍珠岩:蛭石=3∶1∶1)中,放置于气候培养箱中培养,每天观察沉默植株(接种pTRV1+pTRV2-HcPDS)、阴性对照植株(pTRV1+pTRV2-空载)、空白植株(未接种TRV 病毒)的表型性状,拍照记录。沉默植株、阴性对照植株及空白植株各处理30 株幼苗。
1.7 VIGS 沉默效果检测
为鉴定pTRV2-HcPDS 载体是否能够在黄花菜中发挥作用,能否使HcPDS 基因沉默,在30 d 时采集沉默植株、阴性对照植株及空白植株的新生叶片,使用RT-qPCR 检测HcPDS 基因的表达水平。RT-qPCR 方法参照TaKaRa 公司TB Green ™ Premix Ex Taq ™ II(Tli RNaseH Plus)试剂盒说明书进行;RT-qPCR 引物为qPDS-F/R,内参基因选用Act-F/R,反应体系和反应程序参考公菲菲[12]。进行RT-qPCR 反应时,每个样品设置3 次生物学重复和3 次技术重复,使用2-ΔΔCt法计算相对表达量[13]。使用SPSS 软件中的Duncan’s 法进行单因素方差分析[14]。基因表达量结果通过GraphPad Prism 7 软件绘制柱形图。
2 结果与分析
2.1 HcPDS 基因片段克隆与分析
在‘大同黄花’转录组测序数据库中查找功能注 释 为PDS 的Unigene 序 列c50463.graph_c0,以‘大同黄花’嫩叶的cDNA 为模板,在该Unigene的UTR 区设计特异性引物cPDS-F/R,经PCR 扩增后得到约2 100 bp 的序列(图1a)。将PCR 产物连接T 载体送测,将拼接后的送测结果经NCBI-ORF Finder 分析,Unigene 的ORF 区(Open Reading Frame)片段长1 710 bp(图1b),编码570 个氨基酸。通过NCBI-CD Search 预测其蛋白质保守结构域(图1c),在特定匹配中具有较高置信度(E-value=0)的保守结构域PLN02612,其长度为530 aa;在非特定匹配中具有较高置信度(E-value=0)的保守结构域phytoene desat(TIGR02731);且含有NADbinding domain(COG3349),此结构域为氨基酸脱氢酶的辅酶结合域。通过NCBI-blastX 进行不同物种间的序列比对,该Unigene 表达的蛋白质存在与其他物种相似的Phytoene desaturase 保守域结构 (见表2),因此将该Unigene 命名为HcPDS 基因。

图1 HcPDS 基因PCR 扩增产物、PCR 扩增产物测序正确的ORF 序列及对应的氨基酸序列、蛋白质结构Fig.1 The PCR product, sequencing correct ORF sequence, corresponding amino acid sequence, and protein structure of HcPDS gene
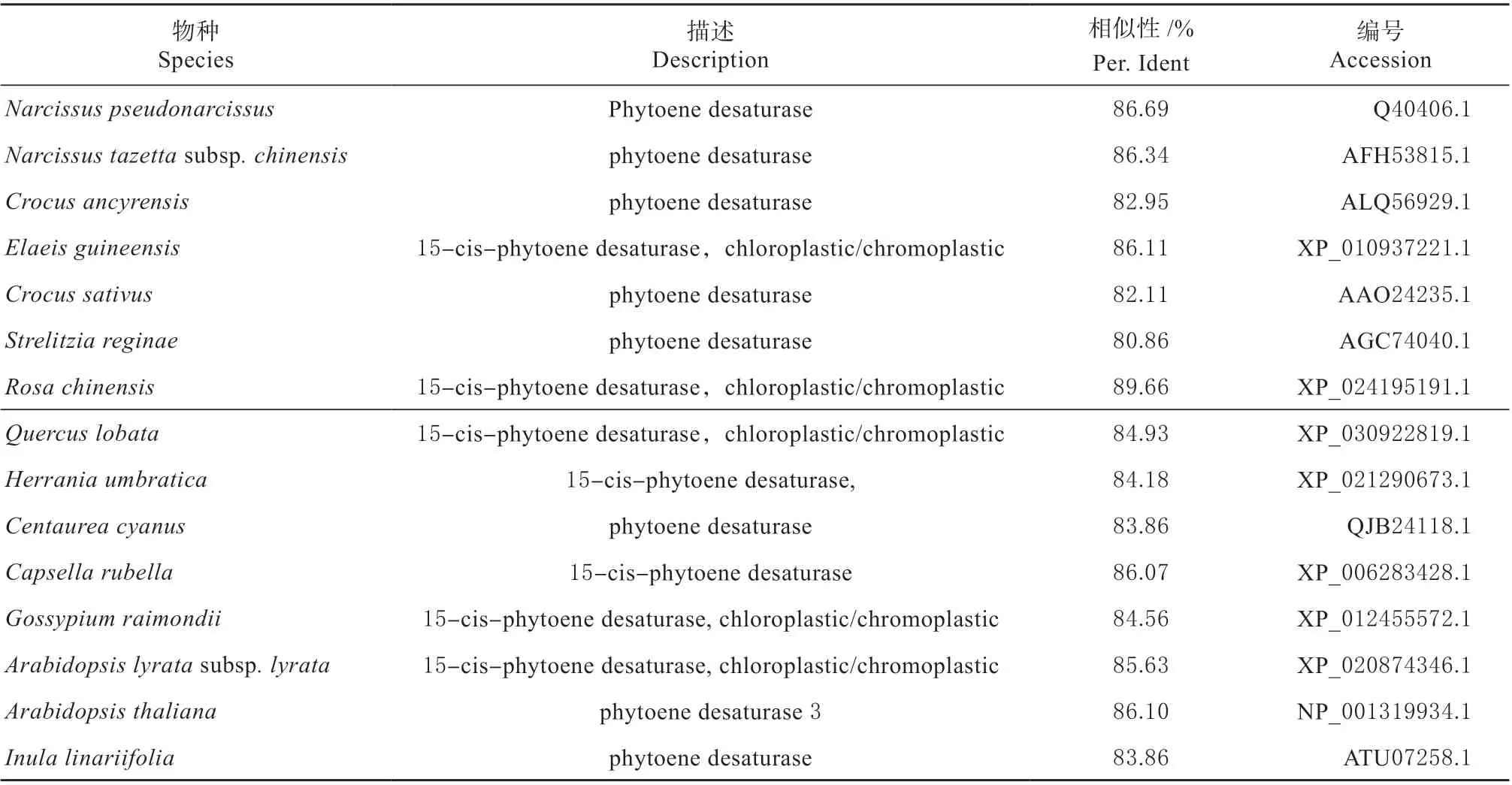
表2 HcPDS 核酸序列NCBI-blastX 部分结果Table 2 NCBI-blastX results of HcPDS nucleicacid sequence
2.2 HcPDS 蛋白分析
利用ProtParam 对HcPDS 基因编码的蛋白序列进行分析。结果表明,HcPDS 蛋白的分子量为63.719 72 kD,理论等电点(pI)为7.53,分子式为C2884H4522N758O819S25。HcPDS 蛋白由20 种氨基酸组成,其中亮氨酸(Leu)的含量最高,占总氨基酸含量的10.5%。蛋白不稳定系数为51.9(高于40),总平均亲水性(GRAVY)为 -0.136,说明HcPDS 蛋白为亲水不稳定性蛋白。通过Protscale 对HcPDS 蛋白进行亲、疏水性分析,结果表明第93位的天冬氨酸(Arg)亲水性最强,为-2.811;第231 位的异亮氨酸(Leu)疏水性最强,为2.489。
通过SWISS-MODEL 在线软件模拟HcPDS蛋白序列的可能结构(图2)。HcPDS 蛋白与已知模板蛋白5mog.1(Oryza sativa phytoene dehydrogenase)的氨基酸序列具有87.68%的一致性,可信度(GMQE)为0.77,与模板蛋白匹配度(QMEAN)为-0.34。HcPDS 蛋白三级结构中具有多种二级结构(螺旋、折叠、卷曲),具有明显的折叠层次。

图2 HcPDS 蛋白三维结构图Fig.2 Three-dimensional structure of HcPDS protein
2.3 HcPDS 蛋白同源性比对及进化树分析
将HcPDS 氨基酸序列在NCBI 数据库中进行Blastp 比对,分析HcPDS 蛋白同源性。结果表明,黄花菜中的HcPDS 蛋白与洋水仙Narcissus pseudonarcissus、芦笋Asparagus officinalis、油棕Elaeis guineensis 等百余种物种存在较高同源性,E-Value 均大于90%,一致性均大于80%。蛋白比对结果显示(图3),HcPDS 蛋白与洋水仙、芦笋、水稻、拟南芥等4 个物种中的PDS 蛋白相比,有402 个相同的氨基酸,65 个强保守氨基酸,32 个弱保守氨基酸,N 端序列差异比C 端大。
通 过MEGA5.0 的NJ(Neighbor-joining) 法分析HcPDS 氨基酸序列及与其相似性大于60%的同源蛋白氨基酸序列的进化关系,构建系统发育进化树。结果表明,单子叶植物和双子叶植物PDS 蛋白明显分为两大枝。在单子叶植物分支中,HcPDS蛋白与洋水仙Narcissus pseudonarcissus、中国水仙Narcissus tazetta subsp. Chinensis、 番 红 花Crocus ancyrensis、芦笋Asparagus officinalis 的PDS 蛋白亲缘关系最近。

图3 PDS 蛋白序列比对Fig.3 PDS protein sequence alignment

图4 HcPDS 蛋白与其他物种PDS 蛋白的系统进化树Fig.4 Phylogenetic tree of PDS protein from Hemerocallis citrina and other species
2.4 黄花菜重组病毒载体pTRV2-HcPDS 的构建
以含有HcPDS 全长且测序结果正确的质粒作为模板,使用重组引物pTRV2-HcPDS-F/R 进行PCR 扩增,琼脂糖凝胶电泳检测目的片段显示:在350 bp 附近出现目标条带,且条带清晰单一,与前期预期结果相符(图5a)。将所回收的PCR 产物与双酶切后的pTRV2 进行重组连接,转化大肠杆菌筛选单克隆后送北京华大测序公司测序。运用DNAMAN 分析测序结果显示:成功克隆到322 bp 黄花菜HcPDS 特异性基因片段,说明pTRV2-HcPDS 基因沉默载体构建成功。
通过热激法将阳性克隆载体pTRV2-HcPDS 进行农杆菌(GV3101)转化,将转化后的pTRV2-HcPDS菌液、pTRV1 菌液、pTRV2 菌液划线于含Kan+Rif抗性LB 固体培养基中28 ℃培养2 ~3 d 挑取单菌落,分别进行菌液PCR(图5b),挑取阳性单克隆进行扩大培养后用于黄花菜幼苗的侵染。

注:a 为重组引物回收目的基因,M 为DL2000 DNA Marker,1 为负对照,2 为目的基因;b 为单菌落PCR 结果,M 为DL2000 DNA Marker,1 为负对照,2 为pTRV1,3 为pTRV2,4 为pTRV2-HcPDS。
2.5 表型鉴定及HcPDS 基因表达水平检测
以黄花菜四周龄的幼苗为试验材料,通过真空渗透法将含有病毒载体的农杆菌渗透进入黄花菜叶片内。叶片真空侵染后呈现水渍状。在接种30 d 后,与阴性对照植株和空白对照植株相比,接种pTRV2-HcPDS 的植株新叶上出现了光漂白现象。为进一步探讨该现象是否是由TRV 载体沉默引起的,分别检测了沉默植株、阴性对照植株和空白植株的TRV 病毒感染情况,结果发现在沉默植株的新生叶片上分别检测到了pTRV1 和pTRV2。
为了验证HcPDS 的沉默,在30 d 时采集了沉默植株、阴性对照植株和空白植株的新叶进行了HcPDS 基因相对表达量分析。结果如图6 显示,相比于阴性对照植株和空白植株,沉默植株的HcPDS基因表达量显著下降,其表达量相较于阴性对照植株下降了73.33%,相较于空白对照植株下降了71.72%,而TRV2 空载的阴性对照与空白对照之间无显著差异。
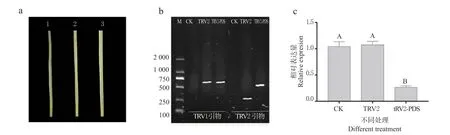
图6 黄花菜幼苗不同处理下HcPDS 基因的表型和相对表达量Fig.6 Phenotype and relative expression of HcPDS gene in different treatments of Hemerocallis citrine seedlings
3 讨论和结论
PDS 基因是类胡萝卜素合成途径的重要基因,类胡萝卜素是植物重要的呈色物质之一。本研究首次在萱草属植物中克隆得到八氢番茄红素脱氢酶基因HcPDS 的cDNA 全长,ORF 区片段长1710 bp,编码570 个氨基酸。分析表明,该序列与水仙、芦笋、油棕和番红花等已克隆并验证过功能的PDS基因具有较高的同源性,且含有与其它物种相似的Phytoene desaturase 蛋白结构,说明该基因在进化过程中较为保守,在植物生长发育过程中控制色素合成具有重要作用。
沉默PDS 基因会出现肉眼可见的光漂白现象,所以该基因通常被作为检测VIGS 转化体系是否成功的报告基因[16]。本研究以4 周龄的黄花菜幼苗为试验材料,通过TRV 诱导的VIGS 体系,发现被pTRV2-HcPDS 侵染的植株新叶出现不完全的光漂白现象,这与Zhong 等人[8-10]的研究现象一致,且通过RT-qPCR 发现叶片中的HcPDS 基因表达量相比接种TRV2 空载的阴性对照和空白对照植株分别下降了73.33%和71.72%。空白对照和阴性对照植株叶片则无光漂白现象出现,且空白对照和阴性对照的HcPDS 基因表达量相比无显著差异。进一步证明了本研究构建的黄花菜VIGS 体系可有效沉默HcPDS 基因。
VIGS 技术是作为一种研究功能基因的反向遗传学手段,已广泛应用于植物器官形成、生长发育、抗病虫害、非生物胁迫、次生代谢及细胞信号转导等生化过程中的相关基因功能研究,在植物功能基因组学方面发挥着重要作用[17]。目前,已成功在番茄[16]、烟草[19]、拟南芥[20]等多种植物中构建了适合本物种的VIGS 体系。在TRV 介导的VIGS体系中接种时期、接种方法、农杆菌接种浓度等因素直接影响接种成功率和基因沉默效率[8]。本研究中首次将VIGS 体系应用于萱草属植物,参考其他物种的侵染条件选用OD600=1.0 的农杆菌液和真空渗透法处理黄花菜幼苗。黄花菜幼苗在接种重组病毒载体30 d 后,其新生叶出现了较为明显的黄色斑点,但其并未出现完全的光漂白现象,后期需在进一步对农杆菌接种浓度和接种时间等条件进行优化。综合表型鉴定和表达检测两项结果分析,利用TRV构建黄花菜VIGS 载体能够有效沉默目的基因片段,可用于后续黄花菜基因功能研究。
本研究克隆得到了黄花菜HcPDS 基因序列,该基因编码的蛋白质具有PDS 基因家族典型的Phytoene desat 结构域。通过序列比对,发现HcPDS 基因与水仙、芦笋等植物中的PDS 基因具有较高的同源性。首次构建了黄花菜HcPDS 基因的VIGS 转化体系,黄花菜幼苗被侵染后,接种pTRV2-HcPDS 的植株新叶出现不完全的光漂白现象,叶片中的HcPDS 基因表达量相比接种TRV2 空载的阴性对照和空白对照植株分别下降了73.33%和71.72%,说明此VIGS 体系能够有效沉默目的基因片段,克服了黄花菜基因组未知等障碍,为黄花菜基因功能的研究奠定了技术基础。
