游泳运动对膝骨关节炎小鼠软骨退变和NF-κB激活的影响
2021-03-17蔡任,钱佳佳,许奇,许炜民,赵佩茹,袁嘉奇,李妍,黄桂成
蔡任,钱佳佳,许奇,许炜民,赵佩茹,袁嘉奇,李妍,黄桂成
摘要:目的:通过观测游泳运动对膝骨关节炎(KOA)小鼠软骨基质降解及NF-质降信号通路介导的炎症反应的影响,探讨游泳运动延缓KOA小鼠软骨退变的分子机制。方法:3月龄C57BL/6小鼠40只,随机分为空白组(Blank)、ACLT模型组(ACLT)、ACLT模型+游泳组(ACLT+Swim)、假手术组(Sham)和假手术+游泳组(Sham+Swim)。采用前交叉韧带横断术(ACLT)制作KOA模型,手术2周后,游泳组小鼠进行6周的无负重游泳运动(40 min/d,5 d/周)。游泳结束后,取各组小鼠膝关节软骨,HE染色观察軟骨病理学改变,免疫组织化学染色检测软骨中炎症介质表达、RT-PCR法检测软骨基质相关指标mRNA表达、Western blot技术检测软骨基质及NF-κB通路相关分子蛋白表达,ELISA方法检测血清中炎症指标表达水平。结果:1)与空白组相比:ACLT组软骨损伤明显,Mankins评分显著升高(P<0.01);软骨Col II含量显著下降,而MMP-13表达增高(P<0.01);软骨中炎症介质COX-2、iNOS表达增高,血清炎症因子TNF-α、IL-6表达亦增高(P<0.01);NF-κB通路中磷酸化p65、IκBα蛋白水平显著升高(P<0.01)。2)与ACLT组相比:ACLT+Swim组Mankin′s评分明显下降(P<0.01)Col IImRNA(P<0.05)及蛋白水平(P<0.01)均提升,MMP-13mRNA及蛋白水平均显著下降(P<0.01),软骨中炎症介质COX-2、iNOS及血清炎症因子TNF-α、IL-6均显著降低(P<0.01),p65、IκBα磷酸化水平亦明显下降(P<0.01)。结论:中等强度游泳运动可能通过调控NF-κB信号通路介导的炎症反应,抑制软骨基质降解从而延缓软骨退变,干预KOA小鼠病理进程。
关键词:游泳运动;膝骨关节炎;软骨退变;基质降解;炎症反应;核转录因子κB信号通路
中图分类号:G804.53文献标识码:A文章编号:1006-2076(2021)06-0025-09
Effects of swimming on cartilage degeneration and NF-κB activation in mice with knee osteoarthritis
CAI Ren1,QIAN Jiajia2,3,XU Qi2,XU Weimin2, ZHAO Peiru3,YUAN Jiaqi3,LI Yan3, HUANG Guicheng2
1.Dept.of Basic Physical Education,Nanjing University of Chinese Medicine,Nanjing 210023,Jiangsu,China;2.Laboratory for New Techniques of Restoration & Reconstruction of Orthopedics and Traumatology, Nanjing 210023, Jiangsu,China;3.Dept. of Rehabilitation Therapy, Nanjing University of Chinese Medicine, Nanjing 210023, Jiangsu,China
Abstract:Objective:To observe the effect of swimming exercise with moderate intensity on cartilage matrix degradation and inflammatory response mediated by NF-κB signaling pathway in KOA mice, and to explore the molecular mechanism of swimming exercise delaying cartilage degeneration in KOA mice. Methods: 40 C57BL/6 mice aged 3 months were randomly divided into blank group (Blank), ACLT model group (ACLT), ACLT+swim group (ACLT+Swim), sham operation group (Sham) and sham+swim group (Sham+Swim). KOA model was made by anterior cruciate ligament transection (ACLT), 2 weeks after the operation, mice in the swim group were swimming without weight for 6 weeks (40 min/D, 5d/week). After swimming, the cartilage of knee joint of mice in each group was taken, and the pathological changes of cartilage were observed by HE staining. The expression of inflammatory mediators in cartilage was detected by immunohistochemical staining. The mRNA expression of cartilage matrix related indicators was detected by RT-PCR. The protein expression of cartilage matrix and NF-κB pathway related molecules was detected by Western blot. The expression level of inflammatory indicators in serum was detected by ELISA. Results: 1)Compared with the blank group, the cartilage injury in ACLT group was obvious, Mankin's score was significantly increased (P<0.01); the content of Col II in cartilage was significantly decreased, but the expression of MMP-13 was increased (P<0.01); the expression of COX-2 and iNOS in cartilage was increased, and the expression of TNF-α and IL-6 in serum was also increased (P<0.01); the protein levels of phosphorylated p65 and IκBα in NF-κB pathway were significantly increased (P<0.01). 2) Compared with ACLT group, Mankin's score decreased significantly (P<0.01), Col IImRNA (P<0.05) and protein level (P<0.01) were both increased, MMP-13 mRNA and protein level decreased significantly (P<0.01), COX-2, iNOS in cartilage and TNF-α, IL-6 in serum decreased significantly (P<0.01), the level of p65 and IκBα phosphorylation decreased significantly (P<0.01) in ACLT+Swim group. Conclusion: Moderate intensity swimming can inhibit the degradation of cartilage matrix by regulating the inflammatory response mediated by NF-κB signaling pathway, thus delaying cartilage degeneration and intervening the pathological process of KOA mice. This study provides a theoretical and experimental basis for swimming assisted therapy of KOA.
Key words:swimming; KOA; cartilage degeneration; matrix degradation; inflammatory response; NF-κB signaling pathway
骨关节炎(Osteoarthritis, OA)是一种以关节软骨破坏和骨赘形成为特征的慢性退行性关节疾病,膝骨关节炎(Knee Osteoarthritis,KOA)是最常见的关节炎,也是老年人致残的主要原因之一,常伴有关节疼痛和活动受限,影响工作和日常活动。国际OA研究学会治疗指南指出,目前针对KOA的治疗方法主要是早期预防和症状缓解,到疾病晚期只能通过关节置换术减缓疾病的发展。但目前并没有有效的治疗方法可以真正改变骨关节炎病理进程。因此,寻找一种切实可行的方法以更安全、更有效的早期预防和缓解症状对KOA的防治具有重要意义。美国风湿学会建议将有氧运动纳入KOA治疗计划,游泳因其负重小、实施方便等优势可作为中老年KOA患者理想的有氧运动形式。多项研究证实游泳可以改善骨关节炎症状、延缓KOA进程,但有关游泳运动延缓KOA的分子机制研究较少。
II型胶原(Type II collagen,Col II)是关节软骨细胞外基质(Extracellular Matrix,ECM)的主要成分,而基质金属蛋白酶-13(Matrix Metalloproteinases-13,MMP-13)是与软骨分解代谢相关的最重要的蛋白酶,在Col II降解中占有重要地位。有研究表明,早期游泳可显著增加KOA大鼠软骨中Col II表达同时抑制MMP-13的过度表达,减轻关节软骨破坏,延缓OA进程,但其具体分子机制仍未完全明了。
虽然骨关节炎通常被认为是一种非炎症性疾病,但越来越多的研究表明,炎性反应参与了KOA的发生发展。核因子κB(nuclear factor-kappaB,NF-κB)信号通路作为经典的信号传导通路,广泛参与多种促炎细胞因子基因的转录调控。NF-κB家族由一组结构相关的Rel蛋白家族组成,其中NF-κBp65二聚体是其最常见的形式,静息状态下,NF-κBp65(p65)与抑制亚单位IκBα结合以非活性状态存在于细胞质中,在受到各种化学因子、细胞因子信号刺激,如白介素6(IL-6)、肿瘤坏死因子α(TNF-α)过量分泌,和膝关节机械应力改变时,IκBα磷酸化(p-IκBα)并发生降解,聚合物NF-κBp65磷酸化(phosphoNF-κBp65,p-p65)而被激活进入核内与诱导型一氧化氮合酶(inducible Nitric oxide synthase,iNOS)、環氧合酶-2(Cyclooxygenase-2,COX-2)、TNF-α、IL-6等炎症物质的DNA启动子特定位点结合,启动其基因表达,进而调控炎症反应及软骨细胞外基质的合成与降解。其中,iNOS和COX-2可促进MMP的产生和激活,抑制Col II和蛋白多糖的合成,使细胞外基质降解,导致软骨退化;TNF-α和IL-6可合成促炎性因子导致OA的炎性反应。同时NF-κB信号通路过度激活,可持续刺激IL-6、TNF-α等促炎因子产生,反馈作用于NF-κB信号通路,进一步导致膝关节软骨破坏,加速KOA发展。游泳运动是否可通过影响该信号级联调控炎症反应以延缓KOA软骨退变,目前未见相关研究报道。因此,本研究采用前交叉韧带横断术(Anterior Cruciate Ligament Transection,ACLT)构建KOA小鼠模型,并于术后2周实施中等强度的游泳运动,以观察游泳运动对NF-κB信号通路介导的炎症反应及软骨基质降解相关指标的影响,探索游泳运动延缓KOA疾病进程的作用机制,以期为游泳运动防治KOA提供实验依据。
1材料与方法
1.1实验动物及分组
SPF级健康3月龄C57BL/6小鼠40只(雌雄各半),体重(20±3)g,购于山东斯科贝斯生物科技股份公司,许可证号SCXK(鲁)20160001。在无特定病原体(SPF级)条件下常规喂养,12 h/12 h光暗交替,恒温恒湿,使用标准的啮齿动物水和食物。本研究所进行的实验均经南京中医药大学动物实验委员会批准(伦理号:201904A009)。
适应性喂养1周后,随机分为空白组(Blank)、ACLT模型组(ACLT)、ACLT模型+游泳组(ACLT+Swim)、假手术组(Sham)、假手术+游泳组(Sham+Swim),每组8只。模型组采用ACLT建立手术诱导的KOA模型,手术方法如前所述,构建轻度损伤模型。研究表明轻度损伤模型较适用于早期研究。假手术组仅暴露关节囊,不破坏韧带。
1.2运动方案
造模完成2周后,ACLT模型+运动组和假手术+游泳组参照文献中等强度运动方案,进行为期6周的无负重游泳运动。游泳项目包括两个阶段:适应和训练(适应旨在减少水诱导的压力,而不促进与体育锻炼相关的生理变化),第一周为适应阶段:第一天15 min/次,第二天到第七天30 min/次;第二周至第六周为训练阶段:40 min/次,1次/天,5次/周,共5周。空白组、模型组及假手术组常归饲养不运动,运动结束后各组取材进行各种测试。
1.3关节肿胀程度
在游泳训练开始前观察模型组与假手术组膝关节肿胀情况,并在训练结束后剔除各组小鼠右膝关节被毛,确定右侧髌骨位置后,以髌骨中点为测量起止点,用黑色记号笔标注术侧膝关节的周径,然后测量标记处长度,即膝关节肿胀度,共测量3次,计算平均值作为该小鼠膝关节肿胀度。
1.4苏木精-伊红(HE)染色检测
4多聚甲醛中固定膝关节组织24 h,10EDTA脱钙8周,常规梯度乙醇脱水,石蜡浸渍、包埋,4 μm厚切片。采用苏木精-伊红染液试剂盒(KGA224)进行染色(HE),每个切片随机取3到5个视野,在400倍光镜下观察软骨和软骨细胞的组织学和形态学特征,并根据改良Mankins评分标准对病理变化进行评分,得分越高,说明骨关节炎病变程度越高:0~1分为正常关节软骨,2~5分为轻度病变,6~9分为中度病变,10~14分为重度病变。取3次评分均值作为最终评分。
1.5免疫组织化学检测
4 μm关节组织切片37℃脱蜡30 min,将切片用二甲苯、梯度酒精水化,PBS冲洗;将放有切片的耐高温塑料染色架放入盛有抗原修复缓冲液的染色盒进行抗原修复,PBS冲洗;3H%2O2-甲醇溶液,室温封闭10 min,PBS冲洗;滴加iNOS(Affinity AF0199)和COX-2兔抗鼠一抗试剂(Abcam ab179800),稀释比例均为1∶100,4℃冰箱孵育过夜,PBS冲洗;滴加羊抗兔聚合物50 ul,室温湿盒孵育20 min,PBS冲洗;滴加DAB显色,显微镜下适时终止,自来水轻柔冲洗15 min;苏木素复染10 min,0.1%HCl分化,自来水冲洗后返蓝;梯度酒精脱水,二甲苯浸泡后中性树胶封片。光学显微镜下观察组织细胞中蛋白的表达情况,取3个高表达区域拍照保存(所有图片均400×拍摄)。被染成棕褐或棕黄色为阳性细胞,被染成蓝色为阴性细胞。
1.6Real-time PCR检测
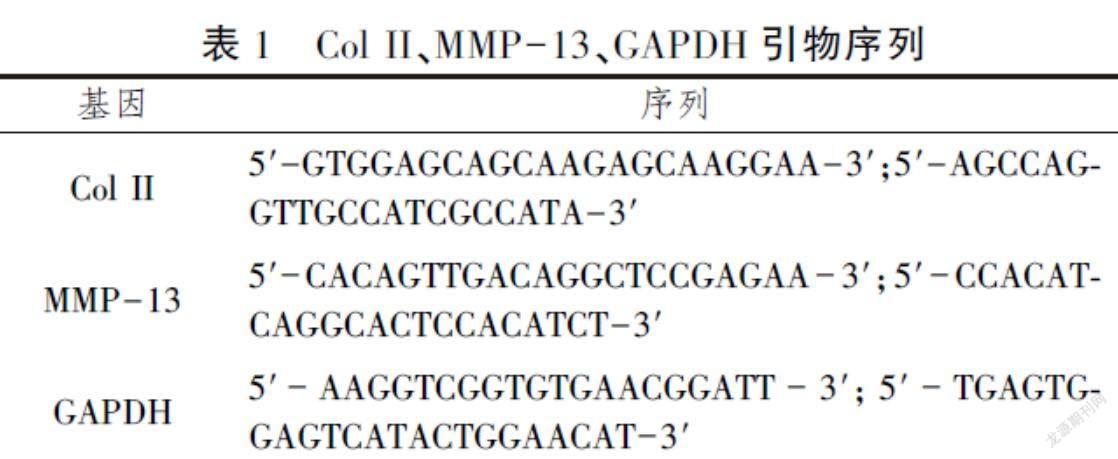
采用Trizol法提取小鼠膝关节软骨组织总RNA,采用cDNA第一链合成试剂盒(日本TaKaRa RR036B)将mRNA反转录成cDNA。PCR扩增以GAPDH作为内参照,应用荧光定量PCR循环仪(ABI Step one plus Real time-PCR system)进行RT-PCR反应,参数设置如下:95℃5 min,之后扩增40个循环(95℃15 s,60℃20 s,72℃40 s)。以GAPDH为内参校正,采用2-△△Ct法求得目的基因的相对表达水平,其中ΔCT(test)=CT(target,test)-CT(ref,test),ΔCT(calibrator)=CT(target,calibrator)-CT(ref,calibrator),ΔΔCT=ΔCT(test)-ΔCT(calibrator)。引物序列见表1。
1.7Western blot检测
各组称取100 mg关节软骨组用骨头钳钳碎,于研钵中加入5 ml液氮迅速研碎,加入1 ml预冷的Lysis Buffer(已加10 μL磷酸酶抑制剂,1 μL蛋白酶抑制剂和5 μL 100 mM PMSF混匀),10 000转/min,4℃离心5 min,取上清。BCA试剂盒测定各组蛋白浓度,向各组上清中加入四分之一体积的5剂蛋白上样缓冲液(Solarbio),混匀后100℃水浴加热10 min,-20℃分装保存。随后进行电泳,湿转,10奶粉封闭2 h,TBST洗膜后分別加入一抗CoI II(北京博奥森 bs-10589R,1∶500)、MMP-13(北京博奥森 bs-0575R,1∶500)、p65(Abcam ab16502,1∶500)、p-p65(Abcam ab194726,1∶500)、IκBα(Abcam ab32518,1∶2000)、p-IκBα(CST 2859,1∶1000)4℃过夜,再次清洗后加入二抗,室温孵育2 h清洗后ECL上机显影。使用Gel-Pro32软件对结果进行灰度分析。
1.8ELISA检测
各组小鼠采用眼球取血收集循环血液,并提取血清。根据TNFα(凯基生物 KGEMC102a)和IL-6 ELISA(凯基生物 KGEMC004)试剂盒说明书对各组血清进行检测。
1.9数据处理与分析
本研究计量资料结果均采用均数±标准差(x±s)的方式表示,数据处理和作图采用统计软件Graphpad Prism 8,多组间比较采用单因素方差分析(one-way ANOVA)。其中P<0.05为具有显著性差异,P<0.01为具有极显著性差异。
2实验结果
2.1膝关节肿胀程度评估
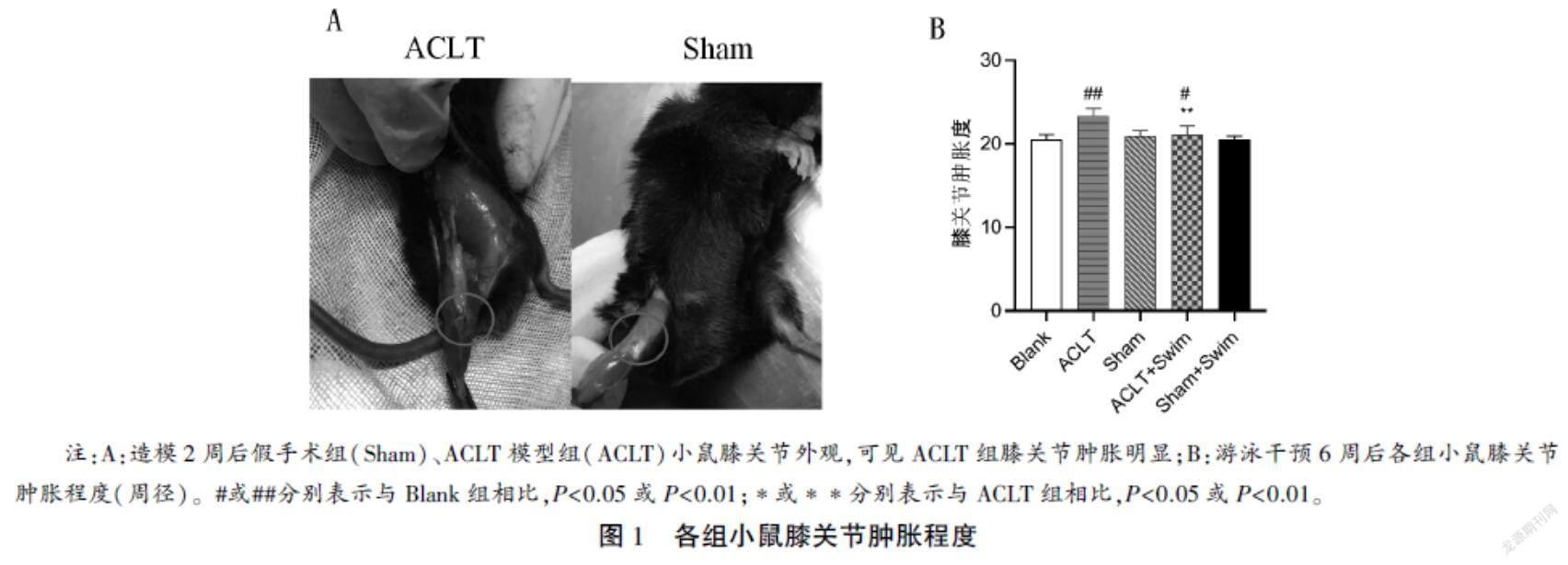
造模后2周,大体观察可见模型组小鼠膝关节肿胀程度(周径)较假手术组明显增加(见图1A);6周游泳运动后,与模型组相比,游泳组小鼠右膝关节的肿胀度显著降低(P<0.01),分析结果见图1B。
2.2游泳运动对KOA小鼠软骨病理变化的影响
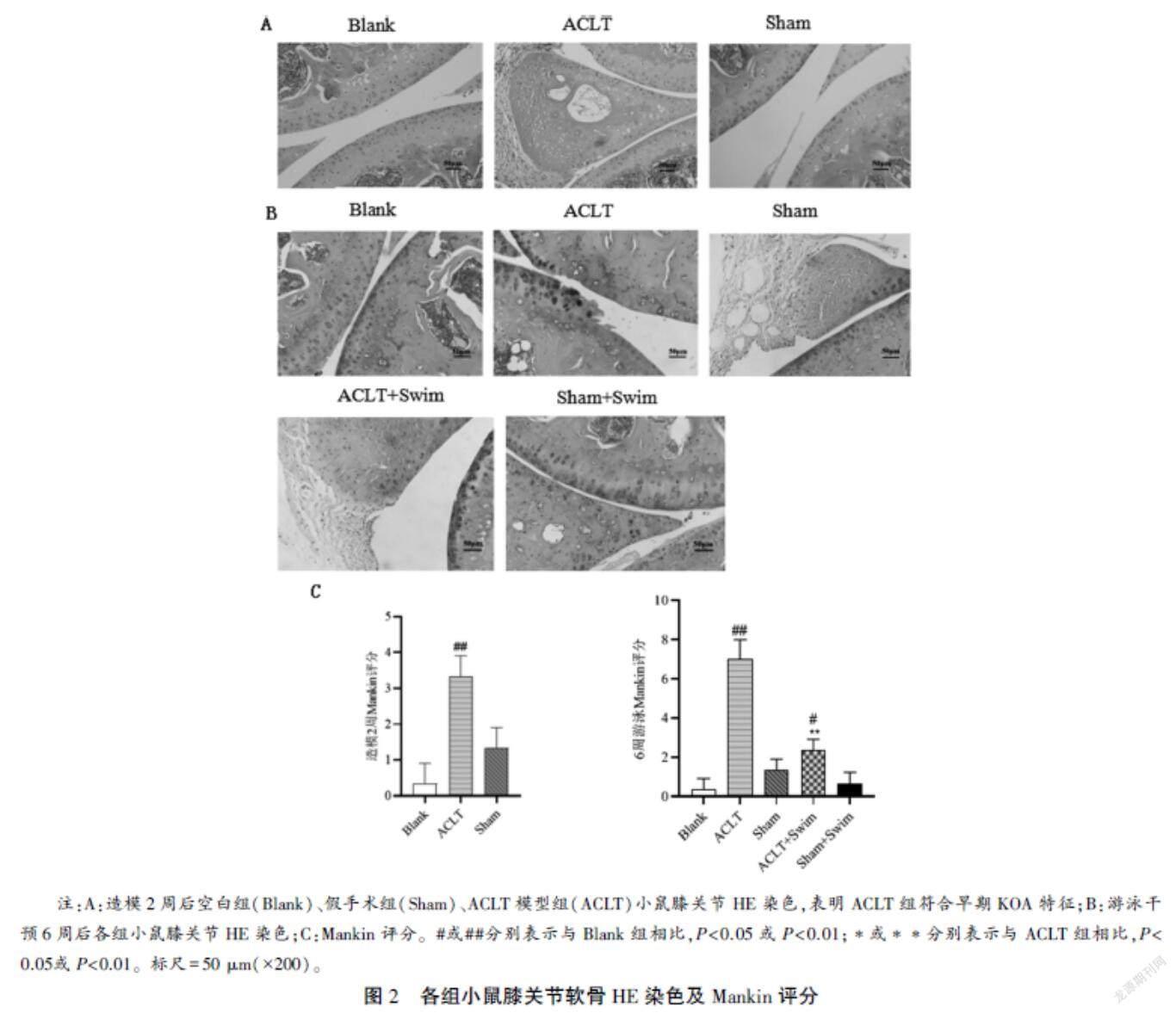
根据周凯等关于鼠类膝骨关节炎分期的描述,0~1分为正常软骨;2~6分为早期OA;7~10分为中期OA;11~14分为晚期OA。为验证本实验小鼠早期造模是否成功,2周后通过光镜下观察软骨变化情况,结果显示造模后2周后ACLT模型组Mankin评分为2~4分,符合早期OA特征(图2)。术后两周,游泳组进行为期6周的游泳训练,结束后取各组软骨组织采用HE染色观察软骨病变情况,结果显示空白组软骨表层光滑平整,软骨细胞数量正常、分布均匀,排列整齐,潮线完整,基质染色正常;ACLT模型组镜下观察为中度损伤,软骨表面不光滑,细胞数目减少,潮线不完整;而ACLT+Swim组可见软骨结构趋于正常,软骨细胞分布偶见不均,潮线连续度尚可;假手术组未见明显变化(图2)。同时用Mankin评分对各组病变程度进行定量分析,可见ACLT组明显高于空白组(P<0.01),而ACLT+Swim组的Mankin评分较模型组明显降低(P<0.01),表明游泳运动可改善KOA小鼠软骨损伤程度。
2.3游泳运动对KOA小鼠膝关节软骨基质降解的影响
为观察中等强度游泳对OA小鼠软骨基质降解的影响,采用RT-PCR法检测软骨中Col II、MMP-13的表达情况,如图3A所示,与空白组相比,ACLT模型组小鼠软骨组织中II型胶原mRNA表达明显下调(P<0.01),而游泳可增加KOA小鼠软骨中Col II的mRNA含量(P<0.05)。其次,模型组小鼠软骨组织中MMP-13的mRNA表达明显上调(P<0.01),而游泳显著降低了病变软骨中MMP-13表达(P<0.01)。同时,对各组软骨组织中总蛋白进行蛋白印迹分析,Col II和MMP-13的蛋白水平变化与mRNA水平一致(图3B)。假手术组无明显变化。
2.4游泳运动抑制KOA小鼠软骨NF-κB信号通路的作用
为了进一步探讨游泳抗炎作用的分子机制,采用western blot检测了各组NF-κB信号通路相关蛋白水平。与对照组相比,ACLT模型组的IκBα的表达明显降低而磷酸化IκBα(p-IκBα)水平显著上调,p65及磷酸化p65(p-p65)表达均升(见图4),表明OA小鼠软骨中NF-κB信号通路显著激活。而游泳运动可抑制IκBα和p65磷酸化,抑制NF-κB信号通路的活性,进而减轻炎症反应,调控KOA病理进程。
2.5游泳运动对KOA小鼠关节软骨及血清炎症介质表达的影响
为了观察骨关节炎软骨组织中的炎症反应,采用免疫组化法检测各组软骨组织中COX-2和iNOS蛋白表达,结果显示:正常软骨中COX-2、iNOS也有阳性表达,但仅局限在软骨浅层区域,而ACLT模型组关节破坏明显,COX-2和iNOS阳性蛋白表达明显提升,且到达深层结构(见图5A、B)。此外,为观察各组循环血中炎症因子的变化情况,采用ELISA试剂盒血清中TNF-α和IL-6进行检测,结果提示ACLT模型组与对照组相比,在蛋白质水平上IL-6和TNF-α的产生均明显增加(P<0.01)(见图5C),印证OA与全身炎症有关的理论。而6周游泳训练能显著降低软骨组织中iNOS和COX-2蛋白水平。同时,血清IL-6和TNF-α表达亦出现明显下调。
3讨论
3.1游泳运动对膝骨关节炎小鼠软骨退变的影响
美国风湿学会建议将有氧运动纳入骨关节炎治疗计划,但关节疼痛和僵硬等障碍对陆地负重活动形成较大障碍。游泳是一种常见的有氧运动方式,水的浮力作用使患者只需承受最小负重应力,同时,运动的持续时间和负荷相对可控,使得游泳成为中老年KOA患者理想的有氧运动形式。目前关于游泳运动治疗膝骨关节炎的研究多从宏观角度观察其缓解疼痛,减轻肿胀,改善运动功能的作用。Yazigi等指出水上运动疗法是由国际骨关节炎研究学会(OARSI)推荐的一种可以有效控制膝骨关节炎症状的康复疗法;Mohammed等研究表明,定期游泳锻炼可减轻与KOA相关的关节疼痛和僵硬,并改善中老年KOA患者肌肉力量和功能活动能力。一项回顾研究表明,游泳对膝关节健康有潜在的益处,尤其是在生命早期(35岁之前)游泳,但仍需更多的前瞻性研究来证实。迄今为止,尚缺乏游泳运动保护软骨的作用及机制研究。小鼠是用来研究生理和病理条件下分子背景最理想的模型。前交叉韧带横断术(ACLT)诱导的KOA模型是研究骨关节炎发病机制和治疗方法的成熟模型。研究表明,ACLT小鼠模型与人类骨关节炎改变非常相似,包括软骨下骨改变、关节软骨损伤和滑膜炎,但目前未见游泳运动对该模型的调控机制研究。本研究结果表明,游泳运动可显著降低ACLT诱导的KOA小鼠软骨中NF-κB信号通路介导的炎症反应及软骨基质降解水平,减轻软骨退变程度,进而延缓KOA进程。
KOA主要病变是关节软骨的退行性变和继发性骨质增生。其最早期的病理变化发生在关节软骨,继而影响软骨下骨、滑膜、关节囊等最终导致整个关节受累。软骨细胞是健康软骨中存在的唯一细胞类型,因此,软骨细胞的任何变异都会影响OA的进展。Col II是关节软骨细胞外基质(ECM)的一种多肽,是软骨细胞外基质的主要成分,关节软骨中Col II的纤网受损是软骨退变的关键事件。在OA的发展过程中,OA软骨细胞产生多种基质金属蛋白酶(MMPs),调节OA中ECM的降解和破坏等多种功能。其中,MMP-13是与软骨分解代谢相关的最重要的金属蛋白酶,具有分解Col II和蛋白多糖的作用。因此,MMP-13似乎是最重要的候选治疗靶点之一。我们的研究结果表明,6周的游泳运动可明显下调KOA小鼠软骨中MMP-13蛋白及mRNA表达,同时Col IImRNA及蛋白表达显著提升。提示,游泳可通过降低MMP-13表达、提高Col II含量从而抑制软骨降解发挥保护软骨的作用。
3.2游泳运动对膝骨关节炎小鼠软骨组织中NF-κB激活的影响
现有的研究尚未完全阐明OA的发病机制,但可以肯定的是,炎症和炎性细胞因子在OA的发生发展中起着至关重要的作用,是导致骨关节炎软骨退变的关键,而抑制炎症介质的产生能够延缓OA的进展。研究表明,iNOS和COX-2是常见的炎症介质,参与骨关节炎的病理进程。iNOS可催化产生NO,而NO可促进MMP的产生和激活,抑制Col II和蛋白多糖的合成,最终导致软骨细胞外基质降解。COX-2可介导炎症介质PGE2的产生,PGE2可有效激发软骨中的MMPs和ADAMTS-5表达,导致软骨的退化。炎症因子TNF-α和IL-6也被认为是OA发生的重要因素,它们可通过激活巨噬细胞,合成促炎性因子,从而导致OA的炎性反应。Mohammed等研究发现,12周游泳可降低骨关节炎患者血清中IL-6的表达,但其调控骨关节炎病理组织炎症反应的作用还不清楚。本研究结果显示,KOA模型组小鼠循环血中TNF-α和IL-6水平显著升高,同时病变软骨中COX-2、iNOS阳性表达也显著提高,而6周游泳运动可显著抑制软骨及循环血中炎症因子的表达,初步表明游泳运动可减轻KOA小鼠骨关节炎病理组织及全身炎症反应。
研究已证实多种细胞内信号通路参与调控炎症反应,其中核转录因子NF-κB通路起着至关重要的作用。NF-κB家族是由一组结构相关的Rel蛋白家族组成,包括NF-κB(p50/105)、NF-κB2(p52/1000)、RelA(p65)、RelB、c-Rel等,這些亚单位的N-末端都含有一个Rel同源区,介导Rel家族同DNA间的结合和蛋白间的二聚化作用,参与NF-κB的活化,其中NF-κB1(p50)和RelA(p65)异源二聚体是NF-κB活化的最常见的形式。通常情况下,胞质中的NF-κBp65二聚体与NF-κB抑制物α(inhibitor of NF-κBα,IκBα)结合,不具有活性。当受到炎症因子等刺激后,胞质中与NF-κBp65二聚体结合的IκBα磷酸化并与二聚体脱离进而被降解,NF-κBp65通过乙酰化或磷酸化被激活,导致活化的p65进入细胞核,调节下游相关基因如iNOS、COX-2、MMP-13的转录,加速OA的发展。因此,干扰NF-κB信号转导的靶向策略可能为OA治疗提供新的潜在治疗方案。目前,游泳能否通过抑制NF-κB信号转导从而延缓OA进程未见报道。本研究结果表明,KOA小鼠软骨中磷酸化IκBα(p-IκBα),p65及其磷酸化产物p-p65表达水平均显著升高,而6周游泳运动可以显著抑制其磷酸化水平,从而抑制了IκBα降解和NF-κBp65的活化。提示,游泳运动可以通过抑制NF-κB信号通路激活,减少相关炎症因子COX-2、iNOS、TNF-α、IL-6的表达,减轻炎症反应,进而降低MMP-13的表达,促进Col II合成以改善软骨基质的降解,减轻KOA软骨退变。
4結论
软骨退变是ACLT介导的KOA小鼠早期病理变化,软骨基质降解和NF-κB信号通路介导的炎症反应和是软骨退变的重要原因;游泳运动可降低KOA小鼠软骨基质降解,减轻软骨退变,并调节软骨中NF-κB信号通路,降低炎症反应。这些可能是游泳运动延缓骨关节炎病理进程的分子机制。
参考文献:
[1]KAMEKURA S,HOSHI K,SHIMOAKA T,et al.Osteoarthritis development in novel experimental mouse models induced by knee joint instability.OsteoArthritis and Cartilage,2005,13(7):632-641.
[2]LAWRENCE R C,FELSON D T,HELMICK C G,et,al.National Arthritis Data Workshop Estimates of the prevalence of arthritis and other rheumatic conditions in the United States.Arthtitis and Rheumatism,2008,58(1):26-35.
[3]MA Y,SUN X,HUANG K,et,al.Sanguinarine protects against osteoarthritis by suppressing the expression of catabolic proteases.Oncotarget,2017,8(38):62900-62913.
[4]BANNURU R R,OSANI M,VAYSBROT E,et al.OARSI guidelines for the non-surgical management of knee,hip,and polyarticular osteoar- thritis.Osteoarthritis Cartilage,2019,127(11):1578-1589.
[5]GLYN S,PALMER A J,AGRICOLA R,et al.Osteoarthritis.Lancet,2015,386(9991):376-387.
[6]FAN Z,LIU Y,SHI Z,et al.MiR5 promotes interleukin‐1β‐induced chondrocyte apoptosis and catabolic activity by targeting PIK3R1-mediated PI3K/Akt pathway. Journal of Cellular and Molecular Medicine,2020,24(120):8441-8451.
[7]HOCHBERG M C,ALTMAN R D,APRIL K T,et al.American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee.Arthritis Care Res,2012,64(4):465-474.
[8]Yazigi F,ESPANHA M,VIEIRA F,et al.The PICO project:aquatic exercise for knee osteoarthritis in overweight and obeseindividuals.BMC Musculoskelet Disord,2013,14(1):1-14.
[9]MOHAMMED A,JEFFREY R.BAKER R,et,al.Improved Function and Reduced Pain after Swimming and Cycling Training in Patients with Osteoarthritis.The Journal of Rheumatology,2016,43(3):1-7.
[10]LO G H,IKPEAMA U E,DRIBAN J B,et al.Evidence that Swimming May Be Protective of Knee Osteoarthritis:Data from the Osteoarthritis Initiative.American Academy of Physical Medicine and Rehabilitation,2020,12(6):529-537.
[11]HSIEHA Y L,YANG C C.Early intervention of swimming exercises attenuate articular cartilage destruction in a rat model of anterior cruciate ligament and meniscus knee injuries.Life Sciences,2018(212):267-274.
[12]KS S,GJ N,AL B.In vivo reduction or blockade of interleukin-1β in primary osteoarthritis influences expression of mediators implicated in pathogenesis.Osteoarthritis Cartilage,2012,20(12):1610-1618.
[13]DING Q H,CHENG Y,CHEN W P,et al.Celastrol,an inhibitor of heat shock protein 90beta potently suppresses the expression of matrix metalloproteinases, inducible nitric oxide synthase and cyclooxygenase-2 in primary human osteoarthritic chondrocytes.European Journal of Pharmacology,2013,708(1-3):1-7.
[14]李爱云,钟丛丛,张宁.小檗碱抑制NF-κB p65改善肝脏糖异生的作用研究.中华中医药杂志,2019,034(005):1956-1960.
[15]HILIGSMANN M, COOPER C,ARDENrden N.,et al.Health economics in the field of osteoarthritis:An expert's consensus paper from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis(ESCEO).Seminars in Arthritis and Rheumatism,2013,43(3):303-313.
[16]OCHI T,OHKUBO Y,MUTOH S.Role of cyclooxygenase-2, but not cyclooxygenase-1, on type II collagen-induced arthritis in DBA/1J mice.Biochemical Pharmacology,2003,66(6):1055-1060.
[17]LI D,NI S,MIAO KS.,et al.PI3K/Akt and caspase pathways mediate oxidative stress-induced chondrocyte apoptosis.Cell Stress and Chaperones,2019,24(1):195-202.
[18]EELDMANN M,BRENNAN F M,MAINI R N.Role of cytokines in rheumatoid arthritis.Annu. Rev. Immunol,1996,14(1):397-440.
[19]Marcu K B,Otero M,Olivotto E,et al. NF-κB signaling:multiple angles to target OA. Curr Drug Targets,2010,11(5):599-613.
[20]許炜民,钱佳佳,韩龙,等.温经通络汤对小鼠膝骨关节炎软骨形态改变和VEGF、MMP-13、HIF-1α表达情况的影响.中医药信息,2020,37(6):6-12.
[21]张钧,陈晓莺,许豪文.运动对心肌细胞中凋亡调控基因表达的影响.体育科学,2005,25(8):79-82.
[22]LIU W N,XUE X L,XIA J,et al.Swimming exercise reverses CUMS-induced changes in depression-like behaviors and hippocampal plasticity-related proteins.Journal of Affective Disorders,2018(227):126-135.
[23]CONTARTEZE R V,MANCHADO F B ,GOBATTO C A,et al.Stress biomarkers in rats submitted to swimming and treadmill running exercises.Comp.Biochem.Physiol.A Mol.Integr.Physiol,2008,151(3):415-422.
[24]王若旭,刘源,李峰,等.筋骨痛消丸对膝骨关节炎大鼠模型血清MLT,MMP-3,MMP-13的影响. 中国医药指南, 2020, 18(11):35-37.
[25]PATEL D V,SAWANT M G,KAUR G.Evaluation of anti-osteoarthritic activity of Vigna mungo in papain induced osteoarthritis model.Indian J Pharmacol,2015,47(1):59-64.
[26]周凯,罗雪梅,朱明双.鼠类膝骨关节炎模型评价方法现状分析.风湿病与关节炎,2015,4(7):66-69.
[27]ALKATAN M,MACHIN D R,BAKER J R.Effects of Swimming and Cycling Exercise Intervention on Vascular Function in Patients With Osteoarthritis.Am J Cardiol,2016,117(1):141-145.
[28]FENG K,GE Y W,CHEN Z X,et al.Curcumin Inhibits the PERK-eIF2α-CHOP Pathway through Promoting SIRT1 Expression in Oxidative Stress-induced Rat Chondrocytes and Ameliorates Osteoarthritis Progression in a Rat Model.Oxidative medicine and cellular longevity,2019:20198574386.
[29]GUO X C,WEI Z W,ZHANG X J,et al.Ipriavone attenuates the degeneration of cartilage by blocking the Indian hedgehog pathway.Arthritis Res.Ther.2019,21(1):109.
[30]于長隆.骨科康复学.北京:人民卫生出版社,2010:780-781.
[31]LI F,YAO J,HAO Q,et al.miRNA-103 promotes chondrocyte apoptosis by down-regulation of Sphingosine kinase-1 and ameliorates PI3K/AKT pathway in osteoarthritis.Bioscience Reports,2019,39(10):1-11.
[32]ANDO A,HAGIWARA Y,TSUCHIYA M,et al.Increased expression of metalloproteinase-8 and -13 on articular cartilage in a rat immobilized knee model.Tohoku Journal of Experimental Medicine,2009,217(4):271.
[33]BLASIOLI D J,KAPLAN D L.The roles of catabolic factors in the development of osteoarthritis.Tissue Engineering Part B Reviews,2014,20(4):355-363.
[34]XIE L Z, XIE H G,CHEN C H,et al.Inhibiting the PI3K/AKT/NF-κB signal pathway with nobiletin for attenuating the development of osteoarthritis:in vitro and in vivo studies.Food Funct,2019(10):2161-2175.
[35]CHEN Y L,YAN D Yi,WU C Y,et al.Maslinic acid prevents IL-1β-induced inflammatory response in osteoarthritis via PI3K/AKT/NF-κB pathways.J Cell Physiol,2020,236(3):1939-1949.
[36]LI N,RIVERA M A,ZHANG M,et al.LXR modulation blocks prostaglandin E2 production and matrix degradation in cartilage and alleviates pain in a rat osteoarthritis model.Proceedings of the National Academy of Sciences,2010,107(8):3734-3739.
[37]SCHULIGA M.NF-kappaB Signaling in Chronic Inflammatory Airway Disease.Biomolecules, 2015,5(3):1266-1283.
[38]KABACAOGLU D,RUESS D A,AI J.NF- B/Rel Transcription Factors in Pancreatic Cancer:Focusing on RelA,c-Rel,and RelB.Cancers(Basel),2019,11(7):937.
[39]GHOSH S,KARIN M.Missing pieces in the NF-kappaB puzzle.Cell,2002,109(Suppl):S81-S96.
[40]DURAND J K,BALDWIN A S.Targeting IKK and NF- B for Therapy.Adv Protein Chem Struct Biol,2017(107):77-115.
[41]REBER L,VERMEULEN L,HAEGEMAN G,et al.Ser276 phosphorylation of NF-kB p65 by MSK1 controls SCF expression in inflammation.PLoS One,2009,4(2):e4393.
[42]CHEN L F,GREENE W C.Shaping the nuclear action of NF-kappaB.Nat Rev Mol Cell Biol,2004,5(5):392-401.
[43]ROMAN J A,JIMENEZ S A.NF-kappaB as a potential therapeutic target in osteoarthritis and rheumatoid arthritis.Osteoarthritis Cartilage,2006,14(9):839-848.
[44]YING X,CHEN X,CHENG S,et al.Piperine inhibits IL-βinduced expression of inflammatory mediators in human osteoarthritis chondrocyte.Int Immunopharmacol,2013,17(2):293-299.
