米根霉发酵对脱脂薏米麸皮营养组成及抗氧化活性的影响
2021-03-16王晓乐陈晓明
徐 磊 高 珊 王 心 许 欢 侯 阳 王晓乐 陈晓明
(淮阴工学院生命科学与食品工程学院,淮安 223003)
薏米属禾本科,又名薏苡仁、六谷米等,是一种典型的药食两用资源,其加工利用价值较高,具有“世界禾本科植物之王”的美誉。薏米麸皮是薏米精白过程的主要副产物,约占糙薏米质量的8%,含有丰富的蛋白质、纤维素、脂肪和矿物质等营养成分,同时富含薏苡素、生育酚、多酚等多种天然生物活性成分[1]。薏米麸皮中的功能性成分具有抗发炎镇痛[2]、治疗高尿酸血症[3]等多种生理活性。我国是薏米种植和消费大国,具有较为完整的薏米产业链,然而目前我国薏米麸皮利用率仍较低,主要用作动物饲料或者直接被抛弃,造成了薏米资源的严重浪费。探寻薏米麸皮的高值转化利用技术成为薏米加工企业和科研工作者面临的重要问题。
微生物发酵作为一种典型的食品加工技术,已被广泛用于各种谷物及其副产物的开发利用中,不仅可改善谷物质地和赋予新的风味,还可以增强其生理活性。Yin等[4]研究表明植物乳杆菌发酵薏米可以显著提高其游离氨基酸、可溶性膳食纤维及有机酸含量,同时还可改善薏米浆的风味和稳定性。刘磊等[5]利用复合乳酸菌对脱脂米糠进行半固态发酵,发现发酵可提高可溶性膳食纤维和总酚含量,同时还可以提高米糠提取物中必需氨基酸和非必需氨基酸比值。Shin等[6]研究发现黑米麸皮经泡盛曲霉和米曲霉固态发酵后,乙醇提取液的酚酸含量、自由基清除活力和酪氨酸酶抑制活性显著提高。
米根霉具有发达的淀粉和蛋白酶系,是药和酒曲中的优势菌种,在我国传统发酵中扮演着重要角色[7]。目前关于米根霉发酵对薏米麸皮营养组成和抗氧化活性的影响鲜有报道。本研究以脱脂薏米麸皮为原料,采用米根霉发酵脱脂薏米麸皮,分析了发酵过程中游离氨基酸、多肽、多酚、黄酮、酚类物质组成及抗氧化活性的变化,旨在为基于薏米麸皮功能性产品的开发以及拓宽薏米麸皮的加工途径提供新思路和技术指导。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
米根霉(1010CFU/g);乙腈:色谱纯;6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、2,4,6-三(2-吡啶基)三嗪(TPTZ)等均为分析纯。
脱脂薏米麸皮:实验室自制。新鲜薏米麸皮购自福建省浦城县官路神农薏米专业合作社,经正己烷脱脂,40 ℃烘干,粉碎过80目筛后备用。
1.1.2 实验仪器
ZQLY-180S振荡培养箱,TGL20M冷冻离心机,SCIENTZ-10N冷冻干燥机,Agilent 1100及Agilent 1260氨基酸专用高效液相色谱仪,LC-2030液相色谱仪。
1.2 方法
1.2.1 发酵脱脂薏米麸皮的制备
准确称取30 g脱脂薏米麸皮和0.3 g米根霉于100 mL烧杯,加入45 mL蒸馏水搅拌混匀。然后置于37 ℃恒温培养箱中,分别发酵0、12、24、48、72 h,取样冷冻干燥,磨粉过80目筛,-20 ℃贮存备用。
1.2.2 pH、可滴定酸和还原糖含量测定
参考崔晨晓等[8]的方法测定pH和可滴定酸。准确称取5 g发酵脱脂薏米麸皮,置于100 mL锥形瓶中,加入50 mL去离子水,室温磁力搅拌30 min后直接测定pH。采用0.1 mol/L NaOH溶液滴定悬浮液使pH值至8.5,记录消耗的NaOH溶液体积,可滴定酸以每克样品所消耗的NaOH溶液表示(mL/g)。
制备的发酵薏米麸皮悬浮液4 000 r/min离心10 min,收集上清液,然后采用3,5-二硝基水杨酸比色法测定还原糖含量,结果以每克样品含葡萄糖表示(mg/g)。
1.2.3 游离氨基酸分析
参考GB/T 18246—2019《饲料中氨基酸的测定》的方法,使用安捷伦氨基酸自动分析仪对发酵薏米麸皮中的18种游离氨基酸进行分析。
1.2.4 多肽分子量分布测定
参考Zhao等[9]的方法进行多肽分子量分布分析。HPLC系统选用TSK gel G2000 SWXL凝胶柱(300 mm×7.8 mm);流动相为10%乙腈(含0.1%TFA);柱温为30 ℃;检测器波长为220 nm;流速为0.5 mL/min。准确称取0.4 g发酵脱脂薏米麸皮溶于4 mL流动相,室温振荡提取2 h,10 000 r/min离心20 min后收集上清液。上清液经0.45 μm的微孔滤膜过滤后进行HPLC分析,进样量为20 μL。
1.2.5 游离型、结合型酚类物质的提取
参考Zhao等[3]的方法提取游离型、结合型酚类物质。准确称取1 g发酵脱脂薏米麸皮,加入20 mL预冷的酸化甲醇溶液(甲醇∶去离子水∶浓盐酸=64∶15∶1),室温下振荡提取2 h,然后4 000 r/min离心15 min收集上清液。离心所得残渣在相同条件下再重复提取两次。合并3次离心所得上清液,在45 ℃下旋蒸至干燥,所得残余用甲醇重新定容到10 mL,此即为游离型酚类物质提取液,贮存于-40 ℃冰箱待用。
将上述游离型酚类物质提取后的残渣收集于100 mL锥形瓶中,加入2 mol/L NaOH溶液20 mL,并充氮密封,于室温下振荡水解2 h,接着用6 mol/L HCl调整pH值至2.0。然后用20 mL乙酸乙酯萃取6次,合并萃取液,40 ℃旋转蒸发至干燥,残留物用甲醇定容到10 mL,得结合型酚类物质提取液,于-40 ℃冰箱储存备用。
1.2.6 总酚、总黄酮含量测定
1.2.6.1 总酚含量
采用福林酚法测定总酚含量[3]。取0.2 mL稀释1倍的酚类物质提取液至离心管中,加入1.3 mL去离子水和0.25 mL福林酚试剂,充分混匀后静置6 min,再加入0.75 mL 20% Na2CO3溶液和2.5 mL去离子水,漩涡混匀后于40 ℃水浴避光孵育2 h,于760 nm波长下测定吸光值。同时以0.2 mL甲醇代替提取液作空白对照,以没食子酸标准品绘制标准曲线。总酚含量以每100 g干基(DW)所对应的没食子酸(GAE)当量表示(mg GAE/100 g DW)。
1.2.6.2 总黄酮含量
参考Amir等[10]的方法测定总黄酮含量。取0.5 mL稀释1倍的酚类物质提取液,加入2 mL 30%乙醇溶液和0.15 mL 5% NaNO2,充分混匀后反应6 min。然后加入0.15 mL 10% Al(NO3)3·6H2O溶液,混匀后静置 6 min。最后加入2 mL 1 mol/L NaOH溶液和0.2 mL去离子水,混匀后室温避光孵育15 min,于510 nm波长下测定其吸光值。同时以0.5 mL甲醇代替样品作空白对照,以芦丁标准品制作标准曲线。总黄酮含量以每100 g干基所对应的芦丁(RE)当量表示(mg RE/100 g DW)。
1.2.7 酚类物质组成测定
参照Chen等[11]的方法,采用LC-2030液相色谱仪对酚类物质提取液中的酚类物质进行定性和定量分析。选用SunFire C18色谱柱(4.6 mm×250 mm,5 μm);柱温设置为35 ℃;检测器波长为280 nm;流速为0.9 mL/min。采用梯度洗脱,流动相A和B分别为水(含0.1%乙酸)和甲醇(含0.1%乙酸)。各样品过0.45 μm的微孔滤膜后进行HPLC分析,进样量为20 μL,结果以每克干重脱脂薏米麸皮所含有的化合物含量表示(μg/g DW)。
1.2.8 抗氧化活性测定
1.2.8.1 ABTS+·清除能力
参考Erel等[12]的方法测定ABTS+·清除能力。取0.1 mL多酚提取液,加入3.9 mL 新鲜配制的ABTS+·工作液,混匀后在25 ℃下避光反应15 min,测定734 nm处吸光值。同时以0.1 mL甲醇代替样品作为空白对照,以Trolox标准品绘制标准曲线。ABTS+·清除能力以每克干基所对应的Trolox当量表示(μmol TE/g DW)。
1.2.8.2 铁离子还原能力(FRAP)
参考Benzie等[13]的方法测定FRAP。取2.7 mL新鲜配制的FRAP试剂,分别加入90 μL酚类物质提取液和270 μL去离子水,振荡混匀后于室温避光处反应30 min,测定593 nm下吸光值。同时以90 μL甲醇代替提取液作空白对照,用Trolox标准品绘制标准曲线。FRAP以每克干基所对应的Trolox当量表示(μmol TE/g DW)。
1.3 数据统计与分析
所有实验均重复测定3次,结果表示为平均值±标准偏差。采用SPSS 19.0软件对实验数据进行Duncan’s多重比较(P<0.05表示差异显著),使用Origin 9.0软件进行绘图。
2 结果与分析
2.1 发酵对pH、可滴定酸及还原糖含量的影响
脱脂薏米麸皮发酵过程中pH、可滴定酸和还原糖含量的变化与米根霉生长繁殖过程中代谢产物的积累具有密切关系。由表1可知,随着发酵时间的延长,脱脂薏米麸皮的pH呈逐渐降低的趋势,而可滴定酸呈逐渐增加的趋势。张杰等[14]报道黑青稞在米根霉发酵后,pH显著降低,而总酸含量显著提高,这与本研究结果一致。发酵12 h后,脱脂薏米麸皮还原糖含量显著增加,而后随着发酵时间的延长还原糖含量逐渐降低,72 h后还原糖含量仅为未发酵脱脂薏米麸皮的51.9%。
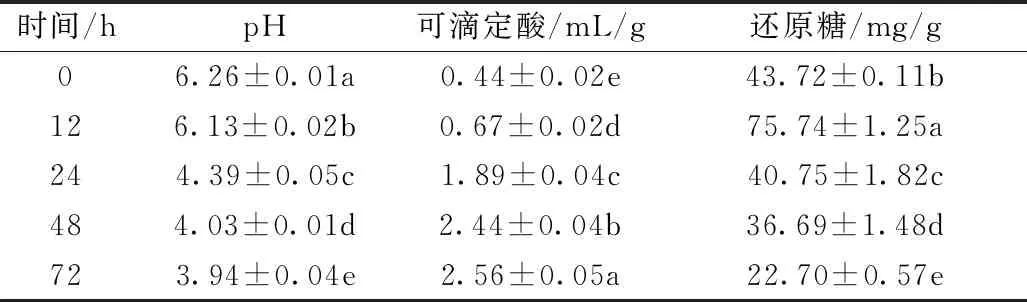
表1 脱脂薏米麸皮发酵过程中pH、可滴定酸和还原糖含量的变化
2.2 发酵对游离氨基酸含量的影响
微生物发酵谷物过程中可利用其自身蛋白酶系降解谷物蛋白生成氨基酸,一部分作为氮源供给自身代谢,另一部分则作为游离氨基酸存在于谷物中[14]。脱脂薏米麸皮发酵过程中游离氨基酸含量的变化如表2所示。发酵过程中总游离氨基酸含量显著增加,从发酵初期至发酵结束增加了近9倍。发酵72 h后,必需氨基酸的含量从0.88 mg/g增加到13.43 mg/g,非必需氨基酸的含量从2.27 mg/g增加到18.32 mg/g,必需氨基酸与非必需氨基酸的比值从0.39增加到0.73。发酵过程中,除了丝氨酸、精氨酸、酪氨酸和赖氨酸,其他游离氨基酸都随着发酵时间的延长含量呈缓慢上升趋势;必需氨基酸中,亮氨酸、缬氨酸和苯丙氨酸含量变化最为明显,发酵72 h后分别增加了2.82、2.52、1.93 mg/g;而非必需氨基酸中,谷氨酸、丙氨酸和天冬氨酸含量变化最为明显,发酵72 h后分别增加了5.89、3.10、2.31 mg/g。γ-氨基丁酸是一种谷物中广泛存在的四碳非蛋白质氨基酸,对人体健康具有很多益处[15]。脱脂薏米麸皮发酵初期γ-氨基丁酸含量为0.22 mg/g,随着发酵时间的延长含量逐渐增加,72 h后增长了2.7倍。Kim等[16]在大米麸皮孵育过程中也报道了显著增长的γ-氨基丁酸含量。
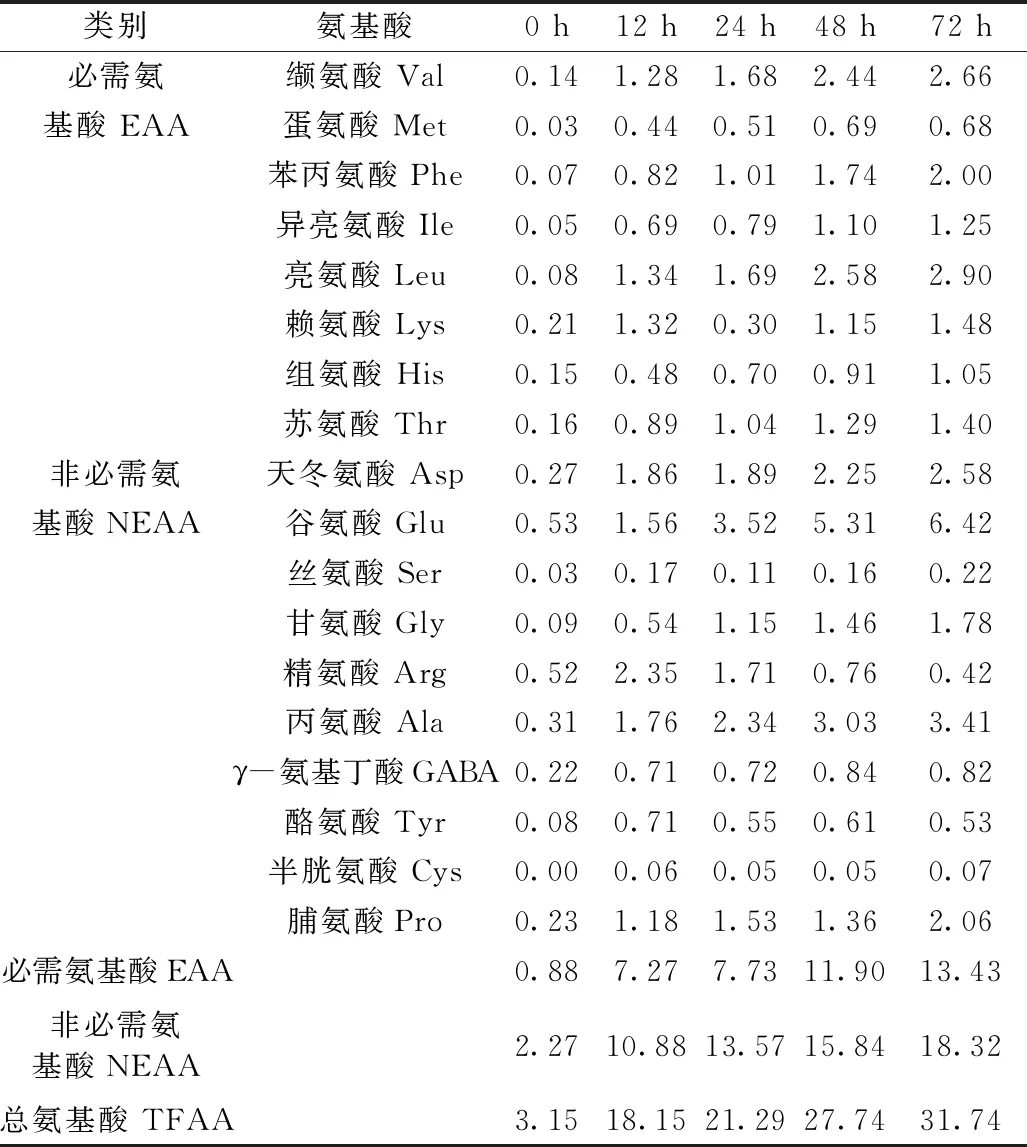
表2 脱脂薏米麸皮发酵过程中游离氨基酸含量的变化/mg/g
2.3 发酵对多肽分子量分布的影响
多肽是一种重要的功能性物质,据报道来源于薏米蛋白的多肽具有治疗扁平疣、肿瘤等疾病的功效[17]。表3为脱脂薏米麸皮发酵过程中多肽分子量分布的分析。脱脂薏米麸皮发酵过程中,48.63%~54.77%的多肽分子量小于180 u,22.37%~27.02%的多肽分子量位于500~180 u,表明脱脂薏米麸皮中的多肽主要是一些三肽、二肽及氨基酸。脱脂薏米麸皮发酵过程中分子质量位于15 000~1 000 u的多肽比例随发酵时间的延长逐渐降低,而分子质量低于500 u的多肽比例随着发酵时间的延长逐渐增加。分子质量位于1 000~500 u的多肽比例在发酵12 h后显著降低,12~48 h之间呈逐渐增加的趋势,而后又显著降低。与本研究结果一致,Liu等[18]在脱脂小麦胚芽发酵过程中也报道了显著增加的小分子多肽含量和显著降低的大分子多肽含量。小分子多肽具有更高的功能活性[19],脱脂薏米麸皮发酵过程中显著增加的小分子多肽比例可显著提高其生物活性。

表3 脱脂薏米麸皮发酵过程中多肽分子量分布的变化
2.4 发酵对多酚和黄酮含量的影响
酚类物质是一种广泛存在于植物体中的重要次生代谢产物,具有抑菌、抗氧化、抗肿瘤等多种生物活性。根据酚类物质与植物细胞中其他组分结合的紧密程度可将酚类物质分为游离型和结合型。脱脂薏米发酵过程中不同结合形态多酚和黄酮含量的变化如图1所示。未发酵脱脂薏米中游离型、结合型和总多酚含量分别为245.67、273.11、518.78 mg GAE/100 g DW。随着发酵时间的延长游离型和总多酚含量逐渐增加,发酵72 h后分别增长了111.7%和53.2%,而结合型多酚含量在发酵过程中未发生显著变化(P>0.05)。脱脂薏米麸皮中的黄酮主要以游离态的形式存在,未发酵脱脂薏米中游离型、结合型和总黄酮含量分别为184.45、69.62、254.06 mg RE/100 g DW。随着发酵时间的延长,游离型和总黄酮含量逐渐增加,发酵72 h后分别增长了168.6%和121.9%,而结合型黄酮含量在发酵过程中保持不变。Shumoy等[20]报道tefinjera在发酵过程中游离型、结合型多酚和黄酮含量随着发酵时间显著提高。冉玉兵等[21]在研究乳酸菌发酵龙眼果浆时发现,发酵可显著提高游离型多酚含量而对结合多酚含量无影响。微生物代谢过程中产生的各种酶可水解植物细胞壁促进酚类物质释放,但不同植物细胞壁在组成和结构方面存在显著差异也导致发酵过程中游离型、结合型酚类物质变化的不一致。
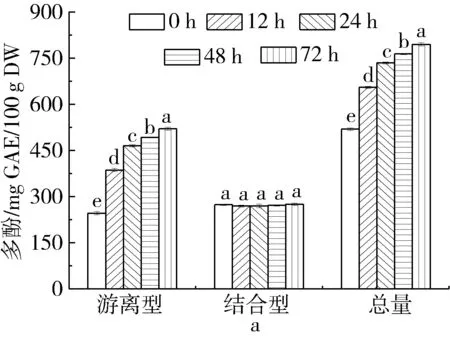

注:同一指标不同小写字母表示差异显著(P<0.05),余同。图1 脱脂薏米麸皮发酵过程中不同形态多酚和黄酮含量的变化
2.5 发酵对酚酸组成的影响
脱脂薏米麸皮发酵过程中酚酸组成及含量变化见表4。脱脂薏米麸皮发酵过程中共检出8种游离型酚酸和4种结合型酚酸,各酚酸含量随发酵时间发生显著变化。脱脂薏米麸皮中的3,4-二羟基苯甲酸、4-羟基苯甲酸和丁香酸以游离态的形式存在,随着发酵时间的延长含量逐渐升高,发酵72 h后分别增长了3.4、3.2、7.9倍。咖啡酸也以游离态的形式存在,发酵初期其含量从18.4 μg/g DW增加到38.0 μg/g DW,而后随着发酵时间的延长逐渐降低,发酵72 h后为10.0 μg/g DW。脱脂薏米麸皮发酵过程中,游离型和结合型的绿原酸含量随着发酵时间的延长都呈逐渐增加的趋势。脱脂薏米麸皮中游离型和结合型齐墩果酸含量随着发酵时间的延长均显著增加(P<0.05),发酵72 h分别增长了3.0、0.6倍。脱脂薏米麸皮中游离型香豆酸主要以结合态形式存在,发酵过程中游离型香豆酸逐渐降低,而结合型香豆酸在发酵前24 h逐渐增加,之后含量逐渐降低,总香豆酸含量变化与结合型香豆酸变化基本一致。阿魏酸也主要以结合态形式存在,发酵过程中结合态和总阿魏酸含量分别降低了20.2%和16.6%,而游离型阿魏酸含量增长了78%。发酵过程中的生物学作用可促进结合态酚类物质的释放,提高游离态多酚含量,同时酚类物质也可发送生物转化作用变成其他物质导致其含量降低[22]。
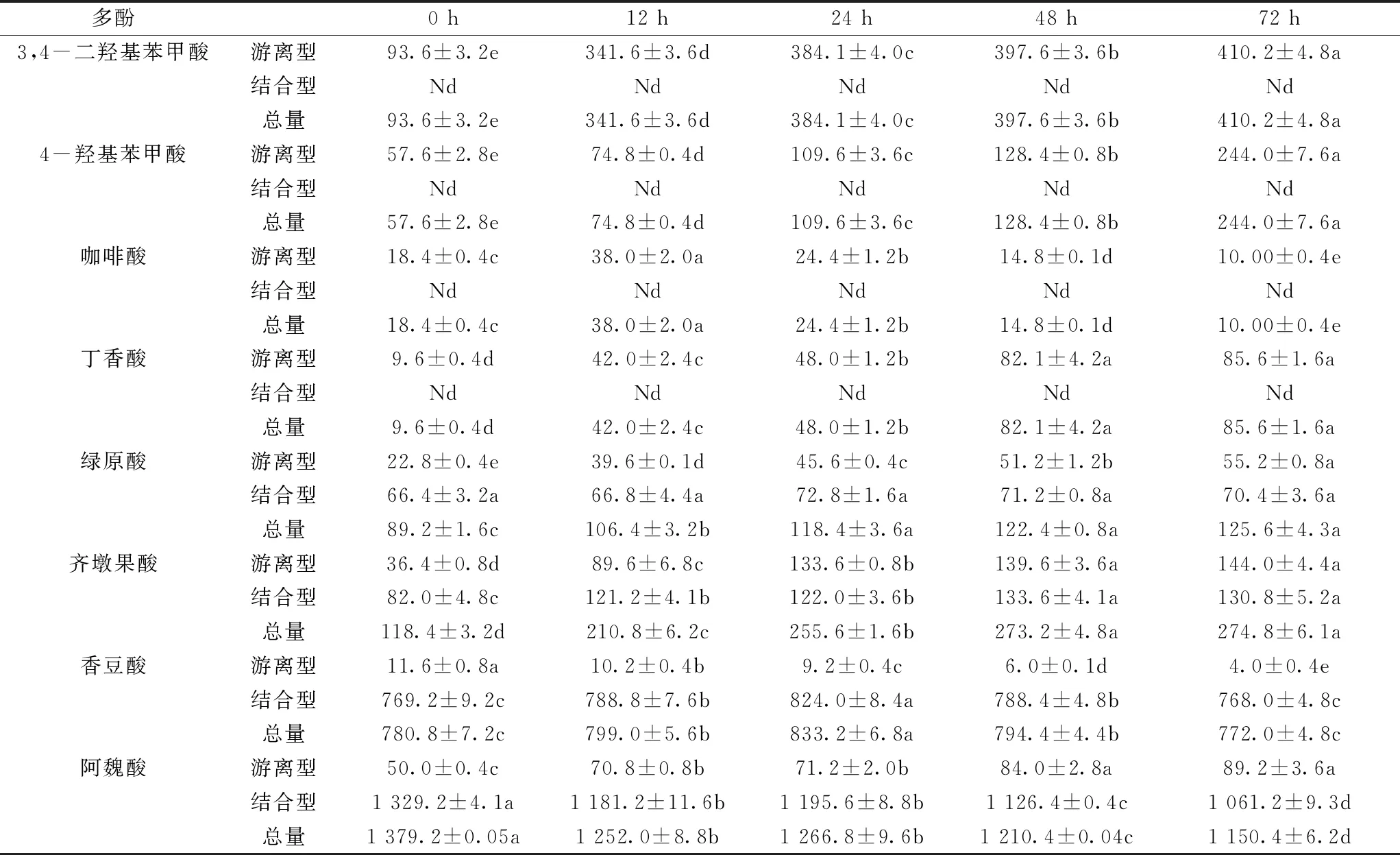
表4 脱脂薏米麸皮发酵过程中游离型、结合型和总酚酸含量的变化/μg/g DW
2.6 发酵对抗氧化活性的影响
谷物中的酚类物质可通过提供电子、氢原子或者鳌合金属离子的方法淬灭和清除自由基,因此具有较高的抗氧化活性[23]。本研究采用FRAP和ABTS+·清除能力表征脱脂薏米发酵过程中酚类提取物的抗氧化活力,结果如图2所示。脱脂薏米发酵过程中,随着发酵时间的延长游离型和总酚类物质提取物的FRAP逐渐增加,发酵72 h后分别增长了119.6%和60.5%,而结合型多酚含量在发酵过程中保持不变(P>0.05)。在发酵过程中,脱脂薏米的游离型和总酚类物质提取物的ABTS+·清除能力随着发酵时间的延长显著上升(P<0.05),在72 h相较于未发酵脱脂薏米分别增长了52.1%和25.9%,而结合型酚类物质提取物的ABTS+·清除能力在整个发酵过程中未发生显著变化(P>0.05)。Gan等[24]也报道了可食用豆类发酵过程中可显著提高游离型酚类物质提取物的抗氧化活力。
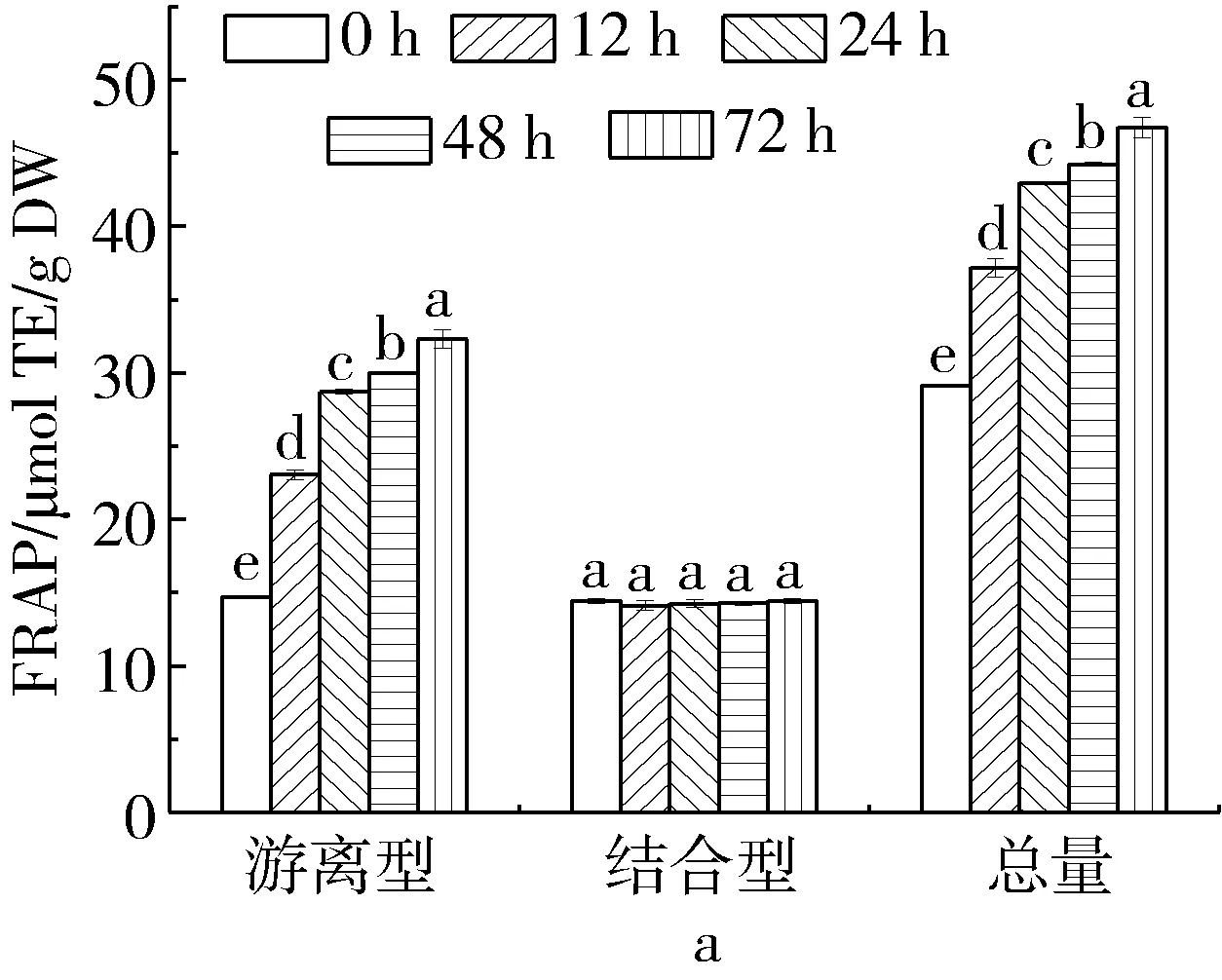
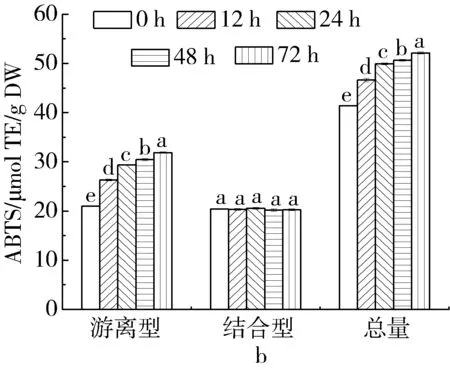
图2 脱脂薏米麸皮发酵过程中不同形态多酚提取物的FRAP和ABTS+·清除能力的变化
3 结论
以脱脂薏米麸皮为原料,考察了米根霉发酵对其营养组成及抗氧化活性的影响。脱脂薏米麸皮经米根霉发酵后pH显著下降、可滴定酸显著提高(P<0.05),而还原糖含量呈先上升后下降的趋势。在发酵过程中,脱脂薏米麸皮的总游离氨基酸增加了近9倍,小分子多肽(分子质量小于500 u)比例随着发酵时间延长逐渐提高。米根霉发酵显著提高了脱脂薏米麸皮的游离型多酚和黄酮含量(P<0.05),但对结合型多酚和黄酮含量无显著影响(P>0.05)。脱脂薏米麸皮发酵过程中共检出8种游离型酚酸和4种结合型酚酸,发酵处理提高了大部分游离型酚酸含量。此外,发酵处理后脱脂薏米麸皮的游离型酚类提取物的抗氧化活力显著提高(P<0.05),而对结合型酚类提取物的抗氧化活力无显著性影响(P>0.05)。该研究可为薏米麸皮的加工利用提供新思路和技术指导。
