肝细胞癌患者PBMCs TLR 2/4表达和小肠细菌过度生长对TACE术后生存期的影响*
2021-03-15王森钰罗援烨陈王丽盛以泉郭满盈
许 超,王森钰,罗援烨,陈王丽,周 芸,盛以泉,郭满盈
肝细胞癌(hepatocellular carcinoma,HCC)是全球范围内最常见的肿瘤,肝动脉化疗栓塞(transcatheter arterial embolization,TACE)治疗是错过最佳手术时机患者的首选治疗方法,但术后肿瘤复发或转移时有发生,影响患者预后[1-3]。据文献报道,慢性肝脏疾病患者肠道微生态遭到损害,存在菌群失调和细菌移位,易引发小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)[4-6]。SIBO能够通过Toll 样受体(Toll-like receptor,TLR)不同信号途径加重肝损害,导致HCC的发生,还可导致肠内毒素产生或吸收增多,引起内毒素血症,加剧病情发展。TLR2和TLR4是大量表达于外周血单个核细胞(peripheral blood monocytes,PBMCs)表面的受体分子,在非特异性免疫过程中具有识别作用,可参与对肿瘤的免疫监视,在HCC发生和发展过程中发挥着重要的作用。目前,有研究表明慢性肝脏疾病患者PBMC表面TLR2和TLR4的表达与SIBO有一定的关系[7,8]。本研究检测了47例接受TACE治疗的HCC患者PBMCs表面TLR2和TLR4表达和SIBO情况,现报道如下。
1 资料与方法
1.1 一般资料 2013年1月~2016年6月我院收治的HCC患者47例,男性29例,女性18例;年龄43~77岁,平均年龄为(56.87±6.63)岁。符合中华医学会肿瘤学分会修订的原发性肝癌规范化诊治的专家共识的诊断标准[9],肿瘤直径为3~7 cm,平均为(5.03±0.56)cm;TNM分期:Ⅲ期30例、Ⅳ期17例。纳入患者肝功能Child-Pugh分级为A级/B级,Karnofsky评分≥60分。排除标准:①转移性肝癌;②既往有心、脑血管疾病,合并肺部疾病或肾功能不全;③恶液质;④伴有严重的全身感染;⑤过敏体质;⑥既往有肝移植手术史或3个月内接受过大型手术史。另选择同期在本院体检的100例健康人作为对照组,男性59例,女性41例;年龄为39~75岁,平均年龄为(55.67±10.34)岁。两组性别和年龄比较差异无统计学意义(P>0.05)。本研究经我院医学伦理委员会审核通过,患者给出知情同意书。
1.2 治疗方法 所有HCC患者均接受TACE治疗,应用的化疗药物为黄石李时珍药业集团武汉李时珍药业有限公司生产的注射用羟基喜树碱(国药准字H20030315)等和明胶海绵颗粒作为血管栓塞剂。
1.3 有关检测 抽取空腹静脉血2 mL,置于美国BD公司提供的肝素抗凝管内,使用美国贝克曼CytoFLEX流式细胞仪检测PBMCs表面TLR2和TLR4表达,以平均荧光强度的几何均数(geometric mean fluorescence,GMF)表示。
1.4 SIBO评估 使用英国EC60Gastrolyzer氢气检测仪,以荷兰Abbott Biologicals B.V.生产的乳果糖口服液(注册证号H20171057)为底物,严格按照乳果糖氢呼气试验(lactulose hydrogen breath test,LHBT)操作规程检测。SIBO阳性判定标准:空腹基础呼气氢气浓度>20 ppm或试餐后呼气氢气浓度上升超过12 ppm,即为SIBO阳性;反之,则为SIBO阴性[10]。
1.5 统计学处理 采用SPSS 20.0软件对所得数据进行分析,计量资料用t检验,计数资料用x2检验,采用Kaplan-Meier绘制生存曲线,分别以3年总生存率和3年无事件生存率作为观察终点,以P<0.05表示差异具有统计学意义。
2 结果
2.1 HCC组与健康人SIBO阳性率及PBMCs表面TLR2和TLR4阳性表达强度比较 HCC组SIBO阳性率及PBMCs表面TLR2+和TLR4+细胞表达强度显著高于健康人(P<0.05,表1)。
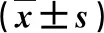
表1 两组SIBO阳性率(%)及PBMCs表面TLR2和TLR4阳性表达强度比较
2.2 SIBO阳性与SIBO阴性HCC患者PBMCs表面TLR2和TLR4阳性表达强度比较 SIBO阳性组PBMCs表面TLR2+细胞和TLR4+细胞表达强度显著高于SIBO阴性组(P<0.05,表2)。
2.3 不同生存期患者SIBO阳性率及PBMCs表面TLR2和TLR4阳性表达强度比较 在本组47例HCC
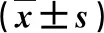
表2 SIBO阳性与SIBO阴性HCC患者PBMCs表面TLR2和TLR4阳性表达强度比较
患者中,术后失访1例(2.1%)SIBO阳性患者。46例HCC患者生存期为(19.09±1.90)个月,以中位生存期16个月为界,结果短生存23例,长生存23例。长生存组PBMCs表面TLR2+细胞和TLR4+细胞表达强度和SIBO阳性率显著低于短生存组(P<0.05,表3)。

表3 两组SIBO阳性率(%)及PBMCs表面TLR2和TLR4阳性表达强度比较
2.4 PBMCs表面TLR2和TLR4表达强度及SIBO对HCC患者术后生存期的影响 采用中位数法将HCC患者分为PBMCs表面TLR2高表达组(>91.5 GMF)和TLR2低表达组(≤91.5 GMF)各23例,也将TLR4分为高表达(>43.4 GMF)和TLR4低表达(≤43.4 GMF)组,各23例。生存分析显示,TLR2高表达患者3 a累积生存率和3 a累积无事件生存率分别为17.4%和13.0%,显著低于TLR2低表达组的52.2%和43.5%(P<0.05);TLR4高表达患者3 a累积生存率和3 a累积无事件生存率分别为13.0%和8.7%,也显著低于TLR4低表达组的56.5%和47.8%(P<0.05);30例SIBO阳性患者3 a累积生存率和3 a累积无事件生存率分别为10.0%和3.3%,显著低于16例SIBO阴性患者的81.3%和75.0%(P<0.05)。
3 讨论
HCC确切病因或发病机制尚不明确,可能是多种因素共同作用的结果。流行病学资料显示大部分HCC是在慢性肝炎,如HBV和HCV感染或肝硬化的基础上发展而来[11,12]。近年来,肠-肝轴研究发现HCC患者肠道内需氧菌所占比例明显增多,而厌氧菌所占比例明显减少,推测肠道微生态可能在肝癌的发生、发展中发挥重要作用[13,14]。HCC患者低蛋白血症、门脉高压均可引起胃肠道淤血、水肿,肠道屏障功能、蠕动功能等各项生理功能减弱,易造成外来致病菌的入侵和繁殖,将大大增加继发肠道菌群移位和SIBO的风险[15-17]。本研究HCC组SIBO阳性率为71.4%,显著高于健康人的6.0%,提示HCC患者普遍存在小肠细菌过度生长。
TLRs是连接非特异性免疫和特异性免疫的单个跨膜非催化性蛋白质,在肿瘤发生发展过程中能够通过识别某些内源性配体发挥肿瘤免疫监视的作用。据文献报道,TLRs免疫耐受的打破可诱导肝脏持续的炎症反应,加速慢性肝病发展为HCC的进程[18]。TLR2和TLR4均可通过病原相关分子模式防御外源性病原微生物的入侵,并通过疾病相关分子模式识别坏死细胞中纤维蛋白原和热休克蛋白等内源性配体,在促进肿瘤细胞的生长和迁移中可发挥重要作用[19]。本研究中HCC组PBMC表面TLR2+细胞和TLR4+细胞表达强度显著高于健康对照者,提示PBMC表面TLR2和TLR4介导的信号通路可促进HCC的发生进展。本研究中SIBO阳性组PBMC表面TLR2+细胞和TLR4+细胞表达强度显著高于SIBO阴性组,提示SIBO可能是PBMC表面TLR2和TLR4表达水平上调的机制之一,而TLR2和TLR4表达水平上调又可通过介导肝脏炎症反应,加重肝脏损伤,提高SIBO阳性率。SIBO可通过不同信号途径激活TLR2和TLR4,诱导大量细胞因子的释放,进一步加剧肝脏炎性反应,加快HCC的发展进程[20]。
本研究长生存组患者在入院时、治疗后3个月和6个月外周血PBMC表面TLR2+细胞和TLR4+细胞表达强度及SIBO阳性率呈现明显下降趋势,且均显著低于短生存期组,表明PBMC表面TLR2和TLR4表达及SIBO与HCC患者治疗效果和预后关系密切,可作为疗效评估的指标。生存分析显示TLR2和TLR4高表达患者和SIBO阳性患者3 a累积生存率和3 a累积无事件生存率显著低于TLR2和TLR4低表达及SIBO阴性患者,进一步说明TLR2和TLR4表达及SIBO与HCC患者的预后生存关系密切,TLR2、TLR4和SIBO可促进HCC细胞增殖、侵袭和迁移,加速HCC患者病情恶性发展,降低患者的术后生存率,有望应用于HCC患者的临床预后评估。SIBO的形成可能加速了内毒素血症的发生,后者可能激活了肝内库佛氏细胞,加速细胞因子的分泌和释放,后者可能作用于肝星状细胞,诱导其分化和增殖,形成肝纤维化,加重肝损害。
