乳铁蛋白对大鼠上颌扩弓及复发过程中腭中缝骨吸收的影响及机制探究
2021-03-12李天成陈建伟邹淑娟李贵凤
程 烨 李天成 陈建伟 邹淑娟 李 煌 李贵凤
上颌扩弓是正畸治疗中用来改善生长发育期儿童上颌骨横向发育不足的常用手段[1],因其治疗效果的显著性和治疗结束后较高的复发率,一直以来是被学者们广泛研究的临床问题。人们试图寻找一种可靠的方法来增加上颌扩弓治疗后结果的稳定性、减少扩弓量的复发。
在上颌扩弓过程中,腭中缝的骨改建是维持扩弓效果稳定性的关键,腭中缝成骨量不足或破骨量过多被认为是导致上颌扩弓后复发的主要原因[2]。本课题组前期研究发现,乳铁蛋白(lactoferrin,LF)灌胃干预可以在大鼠上颌扩弓过程以及去除扩弓装置的复发阶段中促进腭中缝的新骨形成、增强腭中缝的骨质,从而减低上颌扩弓治疗后的复发率、维持其稳定性[3]。然而,LF 灌胃的作用机制尚不甚清楚。
OPG/RANKL/RANK 作用轴是细胞间调节破骨细胞破骨活性的重要通路[4]。核因子KB 受体活化因子(receptor or activator of nuclear factor-KB,RANK)分布在破骨前体细胞膜上,通过与成骨细胞表达的核因子KB 受体活化因子配体(receptor or activator of nuclear factor-KB ligand,RANKL)结合活化破骨前体细胞。RANKL 与RANK 的作用受到骨保护素(osteoprotegerin,OPG)的调节。OPG 也由成骨细胞表达,竞争性与RANK 结合,阻碍破骨细胞破骨分化[5]。去势大鼠LF 干预实验显示LF 是通过上调OPG/RANKL 表达比例来抑制破骨细胞活性的[6]。故LF 可能通过OPG/RANKL/RANK 作用轴,在上颌扩弓过程中抑制腭中缝的破骨活动。
本实验在前期研究基础上,进一步探究LF 在上颌扩弓及复发过程中对腭中缝骨吸收的影响和作用机制。实验仍然采用LF 灌胃的方式对大鼠上颌扩弓及复发过程进行干预,观察在此过程中LF 对OPG/RANKL/RANK 作用轴关键因子OPG、RANKL表达的影响,初步探究LF 影响破骨活动的作用机制。
资料和方法
1.动物处理及分组
16 只5 周龄雄性Wistar 大鼠(成都达硕实验动物有限公司,中国),体重100±10g,SPF 级,用相同的基础饮食、饮水饲养。大鼠适应性饲养1 天后(D0),随机分为2 组:单纯扩弓组(EO),安装扩弓装置;扩弓+LF 组(E+LF),扩弓同时给予1g/kg/d LF溶液灌胃;每组8 只大鼠。7 天的上颌扩弓后(D7),每组随机挑选4 只大鼠处死并获取腭部标本,其余大鼠去除口内装置即进入复发阶段。复发7 天后(D14),处死剩余的每组4 只大鼠并获取腭部标本。本研究动物实验经四川大学华西口腔医院动物伦理委员会审查批准。
大鼠扩弓装置的安装、LF 灌胃干预、腭部标本的获取和处理等实验步骤已在本研究前期实验发表的文章中有详尽阐述。
2.免疫组织化学染色
石蜡切片经常规脱蜡后浸泡于抗原修复液(柠檬酸盐修复液或EDTA 修复液) 中,水浴升温至75℃后恒温加热50 分钟。切片自然冷却、浸洗,之后置于3%过氧化氢溶液中避光浸泡30 分钟。浸洗、擦干切片,滴加抗原封闭剂(1%牛血清)将标本完全覆盖,37℃孵育1 小时。吸干抗原封闭剂,滴加1%牛血清稀释的一抗:组织蛋白酶k(cathepsin k,CTSK)抗体、RANKL 抗体、OPG 抗体(Abcam 公司,美国),37℃孵育1 小时,4℃冰箱中过夜。阴性对照标本不滴加一抗。浸洗、擦干切片,按照二抗ABC 试剂盒(Vector Laboratories 公司,美国)说明书,分别滴加二抗和显色剂,分别37℃孵育1 小时后洗净。擦干切片,滴加新鲜配置的DAB 显色液,镜下控制显色时间,自来水终止显色并清洗,部分染色苏木素复染。
切片在普通光学显微镜(Nikon 公司,日本)下观察并采图。在相同大小的视野中(2048×2048 像素)对CTSK 阳性细胞进行计数,统计破骨细胞的数量。利用Image J 软件(National Institutes of Health,美国)分别提取固定大小视野中(2048×2048 像素)的RANKL、OPG 的阳性表达区域,并且分别计算阳性表达区域面积占视野总面积的百分比。
3.统计学分析
所有量化的实验结果均以平均数±标准差的形式表示,使用SPSS 软件(SPSS 公司,美国)对两组或两个时间点(D7、D14)之间的数据进行t 检验比较。P<0.05 则被认为有统计学差异。
结 果
1.CTSK 免疫组织化学染色
在两个实验组的大鼠标本中,胞质阳性染色的多核细胞即破骨细胞在腭中缝的分布情况相似:在D7 时多位于中缝两侧骨端的骨髓腔边缘,少数分布在腭部骨板鼻腔侧的骨膜下;而在D14 时则在中缝两侧的骨髓腔边缘分布减少,而多位于鼻腔侧的骨膜下(图1)。破骨细胞进行计数结果显示:在D7、D14 两个时间点,E+LF 组大鼠腭中缝的破骨细胞都显著少于EO 组(图2A)。
2.RANKL 免疫组织化学染色
RANKL 的阳性显色大部分位于腭中缝的成骨细胞、软骨细胞、骨膜细胞等的细胞质中,少量位于这些细胞周围的组织基质中。这样的组织分布特点在检测的标本之间都没有显著差异(图3)。计算RANKL 阳性表达面积占比结果显示,RANKL 的表达量在两个时间点有相似的组间差异,即E+LF 组明显多于EO 组(图2B)。
3.OPG 免疫组织化学染色
OPG 在D7、D14 两个时间点的组织表达规律与RANKL 极为相似,即对于所有标本OPG 的阳性显色大部分位于标本腭中缝的成骨细胞、软骨细胞、骨膜细胞等细胞的胞质中,少部分位于这些细胞周围的组织基质中(图4)。计算视野中OPG 阳性表达面积的百分比结果表明:OPG 的阳性表达面积在D7、D14 两个观测点均为E+LF 组显著大于EO 组(图2C)。

图2 免疫组织化学染色量化结果(柱顶竖条表示标准差;* 表示P<0.05)

图3 RANKL 免疫组织化学染色(比例尺100μm 如图所示)
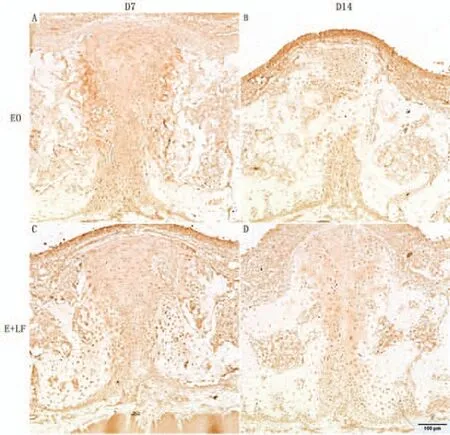
图4 OPG 免疫组织化学染色(比例尺100μm 如图所示)
利用上述RANKL、OPG 的阳性表达面积计算结果,计算OPG 和RANKL 表达量的比值。计算结果显示:在D7 和D14,OPG/RANKL 表达量的比值在E+LF 组明显大于EO 组(图2D)。
讨 论
本研究的前期实验发现,LF 灌胃可以在大鼠上颌扩弓及复发的过程中促进腭中缝的新骨形成,并且此作用呈一定的计量依赖性,1g/kg 体重的高浓度LF 灌胃可以在此过程中增强腭中缝的骨质[3]。本研究便在前期研究的基础上,继续采用1g/kg 体重LF灌胃,进一步探究LF 在大鼠扩弓和复发过程中对腭中缝骨吸收活动的影响及其作用机制。
CTSK 是破骨细胞特异性表达与骨质溶解密切相关的重要水解酶[7],和TRACP 5b、降钙素受体一同被视作破骨细胞的重要标志物[8]。CTSK 的表达量常被用来衡量破骨细胞的活性[8~10]。CTSK 免疫组织化学染色结果表明LF 灌胃干预可能不会影响腭中缝破骨细胞的组织分布,但可能在一定程度上抑制了上颌扩弓及复发过程中腭中缝的破骨活动。这与Hou 等[6]、Walli 等[11]的研究结果较为一致。然而,Kawazoe 等的大鼠体内实验[12]、Inubushi 等的体外细胞实验则得出了相对不同的结果。这两个研究表明LF 只能抑制炎症反应介导的骨吸收过程[13],而对正畸应力刺激导致的破骨活动则没有作用。联系本实验的研究结果,可以推测产生这样研究结果差异的原因可能是Kawazoe 等的实验采用的LF 大鼠灌胃浓度为500mg/kg 体重,尚未达到可以抑制应力相关破骨活动的浓度。
OPG/RANKL/RANK 作用轴是细胞间调节破骨细胞破骨活性的重要通路[4]。RANK 分布在破骨前体细胞的细胞膜上,通过与成骨细胞表达的RANKL结合从而活化破骨前体细胞。RANKL 与RANK 的作用受到OPG 的调节。OPG 也由成骨细胞表达,竞争性与RANK 结合,阻碍破骨细胞破骨分化[5]。故OPG 与RANKL 的表达平衡调节着机体的破骨活动以及骨代谢。当OPG/RANKL 表达量的比例升高时,破骨功能受到抑制;而当其比例降低时,破骨活动则被促进[14]。一项对去势大鼠的LF 干预实验显示LF是通过上调OPG/RANKL 表达比例来抑制破骨细胞活性的[6]。在大鼠腭中缝受应力牵张以及复发改建的过程中,LF 对破骨活动的抑制作用可能与OPG/RANKL/RANK 作用轴有关。
在本实验中,OPG 和RANKL 的表达量在LF 的干预作用下都有提高,这可能是由LF 导致的成骨样细胞的增殖和骨膜下细胞向腭中缝区域的聚集引起的。OPG 和RANKL 都是由成骨细胞表达的,当成骨细胞的量增加,自然会导致OPG 和RANKL 表达量的同时增加。然而OPG/RANKL 表达量的比值在两个时间点都因为LF 的干预作用而显著大于EO组,表明LF 在此过程中促使了OPG/RANKL 表达比例的上调。即LF 对破骨活动的抑制作用是通过调节OPG/RANKL/RANK 作用轴来实现的。
综上所述,高浓度LF 灌胃可以在大鼠上颌扩弓及复发的过程中抑制腭中缝的破骨活动;对破骨活动的抑制作用可能是通过调节OPG/RANKL/RANK 作用轴实现的。
