在线、离线结合快速筛选杨梅叶中黄酮类抗氧化活性成分
2021-03-12赵露田胜刘璐刘叶童珊珊徐希明
赵露,田胜,刘璐,刘叶,童珊珊,徐希明
(江苏大学药学院,江苏 镇江 212013)
杨梅叶中富含黄酮、有机酸、多糖等多种生物活性成分,具有降血糖、肝脏保护、抗氧化、抗菌等作用[1-2]。研究表明,杨梅叶黄酮化合物对自由基具有较强的清除能力[3-4]。但目前杨梅叶中黄酮类成分的抗氧化活性成分的筛选研究尚停留在总提取物、总黄酮或杨梅苷、槲皮素等个别化合物层面[5],基于在线筛选的方法一次性分离及评价杨梅叶中的多个抗氧化活性成分尚不清楚。经典的抗氧化活性测定方法包括ABTS自由基清除实验、2,2-联苯基-1-苦基肼基(DPPH)自由基清除实验、铁离子还原(FRAP)实验等[6-7]。本实验结合经典的抗氧化评价方法,建立了一种2,2-联苯基-1-苦基肼基-高效液相色谱(DPPH-HPLC)在线筛选杨梅叶中抗氧化活性成分的方法。
1 材料与方法
1.1 试剂与仪器
DPPH(批号:C10091989,上海麦克林生化科技有限公司);总抗氧化能力检测试剂盒(ABTS 法,南京建成生物工程研究所);甲醇和乙腈购买自国药集团(色谱纯);对照品购买自上海阿拉丁生化科技股份有限公司;槲皮素、杨梅素、杨梅苷和山柰酚质量分数均≥98%,杨梅叶采自江苏镇江江苏大学图书馆后山,经江苏大学药学院傅海珍老师鉴定为双子叶纲杨梅科杨梅属植物杨梅(Myricarubra)的干燥叶子;抗坏血酸、2,4,6-三吡啶基三嗪(TPTZ)、醋酸、FeCl3及其他试剂等均为分析纯;娃哈哈纯净水若干。
LC-20AT VP型高效液相色谱仪、SPD-20A 型紫外检测器均为日本Shimadzu公司产品;N2000型色谱数据工作站(浙江大学智达信息工程有限公司);XT120A型电子天平(瑞士Precisa公司);酶标仪(美国BioTek公司);KQ-250B型超声波清洗仪(昆山市超声仪器有限公司)。
1.2 实验方法
1.2.1 供试品和对照品溶液的制备 采摘的新鲜杨梅叶经清洗、烘干后粉碎,过180 μm筛,脱脂,得杨梅叶细粉。称取烘干的脱脂细粉0.6 g,置于锥形瓶中,按料液比1∶20加入12 mL无水乙醇(含1.2 mol/L盐酸),于功率100 W、频率40 kHz 超声条件下提取2次,每次提取40 min。合并提取液后抽滤并减压浓缩,残渣用无水乙醇溶解并转移至10 mL量瓶中,稀释至刻度,摇匀,过0.45 μm微孔滤膜,待用。
分别精密称取10 mg对照品槲皮素、杨梅素、杨梅苷、山柰酚,置于10 mL容量瓶中,用甲醇溶解并定容,即得质量浓度为1 mg/mL的四个活性成分对照品溶液。
1.2.2 DPPH-HPLC法在线筛选杨梅叶中抗氧化活性成分 色谱柱为Shimadzu C18柱(150 mm×4.6 mm,5 μm);检测波长254 nm;柱温30 ℃;体积流量0.8 mL/min;进样量20 μL;流动相为乙腈-0.1%磷酸溶液,梯度洗脱:0~30 min,20%乙腈;30~32 min,20%~30%乙腈;32~45 min,30%乙腈;45~60 min,20%~30%乙腈。
DPPH·溶液(2 mg/L甲醇溶液)流速 0.4 mL/min,混合后的检测波长为517 nm,柱后反应管长615 cm。仪器组装参考文献[8-9]进行,见图1。

图1 DPPH-HPLC在线分析仪器示意图
1.2.3 HPLC方法学考察
1.2.3.1 线性关系考察 精密吸取“1.2.1”中四个活性成分,杨梅素、槲皮素、杨梅苷、山柰酚的对照品溶液,按10∶2∶1∶1比例混合,配制成混合对照溶液。精密量取混合对照溶液0.1、0.2、0.4、0.6、0.8、1.0 mL,置于10 mL量瓶中,加甲醇稀释,摇匀。分别精密吸取20 μL,按“1.2.2”色谱条件测定。
1.2.3.2 精密度试验 取混合对照溶液,重复进样6次,记录杨梅苷、杨梅素、槲皮素、山柰酚的峰面积,计算其相对标准偏差(RSD)值。
1.2.3.3 重复性试验 取同一批杨梅叶粉末,按“1.2.1”方法平行制备 6 份供试溶液,进样分析,测定峰面积,计算其含量的质量分数。
1.2.3.4 稳定性试验 精密吸取同一供试品溶液,室温放置,于0、2、4、8、12 h进样,记录峰面积,计算RSD值。
1.2.4 DPPH自由基清除率检测 精确称量20 mg DPPH,置于250 mL容量瓶中,用甲醇定容,得到200 μmol/L DPPH-甲醇溶液。取“1.2.1”中不同浓度样品溶液50 μL,加入DPPH-甲醇溶液150 μL,对照组用50 μL甲醇代替样品溶液,空白组用150 μL甲醇代替DPPH溶液,充分振荡混匀,避光反应30 min,517 nm处测其光密度值,计算自由基清除率。DPPH自由基清除率(%)=[1-(D样本-D空白)/D对照]×100%。
1.2.5 ABTS总抗氧化能力实验 取试剂盒中的ABTS溶液和氧化剂等体积配制,得ABTS工作母液,室温避光存放12~16 h后方可使用。使用前,用80%乙醇将ABTS工作母液稀释成ABTS工作液,用蒸馏水稀释对照品。将试剂盒中10 mmol/L Trolox(水溶性VE)标准溶液稀释成0.1、0.2、0.4、0.6、0.8、1.0 mmol/L。于24孔板中每孔加入200 μL ABTS工作液和10 μL各浓度Trolox标准溶液,轻轻混匀,静置孵育2~6 min,在734 nm处测光密度。处理数据,绘制Trolox标准曲线。按上述测定Trolox标准溶液的方式测定不同浓度的样品溶液,平行3次实验。
1.2.6 FRAP实验 FRAP工作液配制:300 mmol/L醋酸缓冲液(pH 3.6)、10 mmol/L TPTZ溶液(溶于40 mmol/L HCl,现配现用)、20 mmol/L FeCl3溶液,按10∶1∶1配制。取150 μL不同浓度样品溶液,加入2 850 μL预热至37 ℃的FRAP工作液中,摇匀,避光37 ℃放置30 min;于593 nm波长处测定光密度,平行3次实验。
2 结果
2.1 HPLC方法学考察结果
2.1.1 线性关系 以各对照品质量浓度(mg/mL)为横坐标(X),峰面积(A)为纵坐标(Y)进行线性回归,得到回归方程:杨梅苷Y=3 619 531X-1 307.356 0 (R2=0.999 3),杨梅素Y=2 433 527X-14 072.000 0(R2=0.999 0),槲皮素Y=1 890 813X-1 272.906 0 (R2=0.999 2),山柰酚Y=4 763 985X-2 611.206 0(R2=0.999 1)。由上述线性回归方程,计算得杨梅叶生药中各组分的含量:槲皮素0.590 3 mg/g、杨梅素3.199 5 mg/g、杨梅苷0.290 0 mg/g、山柰酚0.092 6 mg/g。
2.1.2 精密度试验 取混合对照溶液,重复进样6次,测得杨梅苷、杨梅素、槲皮素、山柰酚峰面积的RSD分别为0.41%、0.40%、0.26%、1.02%,表明仪器精密度良好。
2.1.3 重复性试验 测得杨梅苷、杨梅素、槲皮素、山柰酚含量质量分数的RSD值分别为0.40%、0.13%、0.15%、0.17%,表明方法重复性良好。
2.1.4 稳定性试验 测得杨梅苷、杨梅素、槲皮素、山柰酚峰面积的RSD分别为0.43%、0.55%、0.29%、1.24%。结果表明,供试溶液室温放置12 h内稳定。
2.2 DPPH-HPLC法在线筛选杨梅叶中抗氧化活性成分结果
由色谱图2得出,杨梅叶粗提液经DPPH-HPLC分析,有4个明显倒峰出现(反应时间约为180 s,即前后两个色谱图的保留值相差约3 min);经与对照品保留值相比,筛选出杨梅叶粗提液中主要的抗氧化黄酮类成分应为杨梅苷、杨梅素、槲皮素、山柰酚。

A: 反应前;B:反应后
2.3 DPPH自由基清除活性
在10~150 μg/mL浓度范围内,杨梅叶中四种黄酮类成分均显示有较强的清除DPPH自由基的作用,且在10~50 μg/mL范围内具有较明显的浓度依赖关系,即所有被测组分的DPPH·清除能力都随样品浓度的增加而增强。样品清除DPPH自由基能力采用DPPH·清除率为50%时所需样品浓度IC50值表示,详见表1。槲皮素、杨梅素、杨梅苷、山柰酚、L-抗坏血酸、Trolox 的IC50分别为17.42、20.22、30.44、26.23、21.40、41.68 μg/mL,表明槲皮素和杨梅素对DPPH自由基的清除效应强于L-抗坏血酸,自由基清除效果较好,杨梅叶中的四种黄酮类成分均具有比Trolox更强的抑制DPPH·的作用。
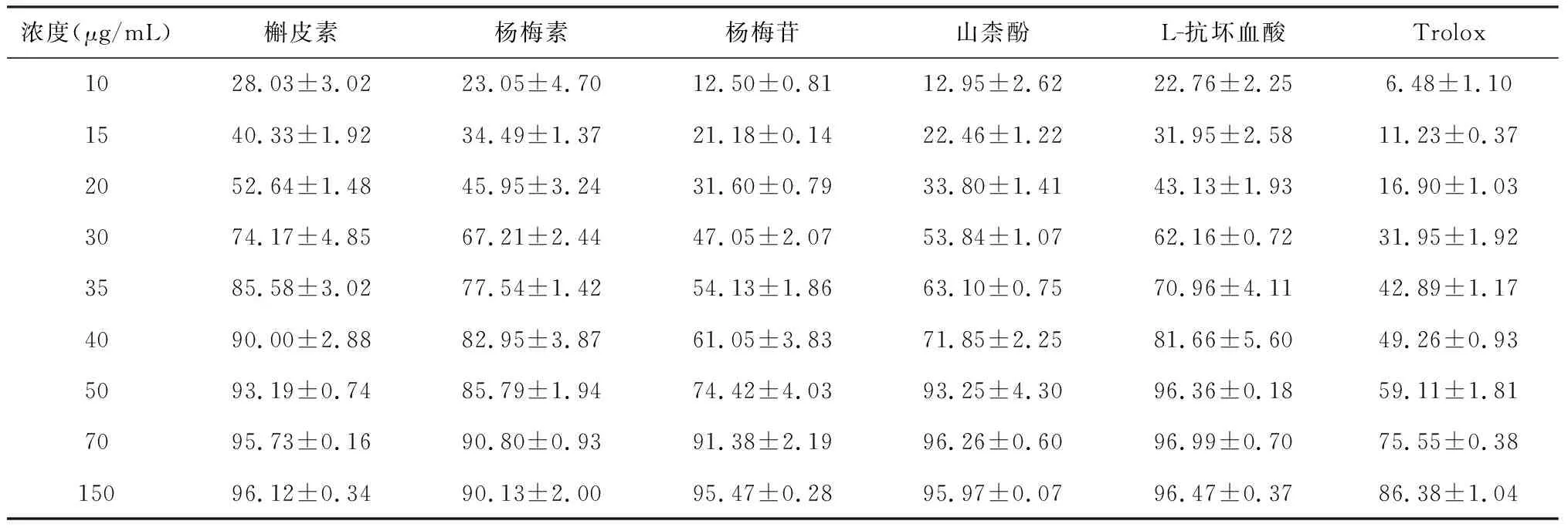
表1 杨梅叶中黄酮类成分对DPPH自由基的清除作用 %
2.4 ABTS自由基清除活性
Trolox标准曲线的方程式为Y=-0.591 8X+0.758 2 (R2=0.996 2)。各样品对ABTS+自由基清除能力见图3。杨梅叶中四种黄酮类成分均有不同程度的抗氧化作用,各样品清除ABTS+自由基的能力:槲皮素>杨梅素>L-抗坏血酸>山柰酚≈杨梅苷。由此表明,槲皮素和杨梅素对ABTS+自由基的清除效应较L-抗坏血酸高,自由基清除效果较好,而杨梅苷和山柰酚的抗氧化能力较弱。

图3 杨梅叶中黄酮类成分对ABTS+自由基的清除作用
2.5 铁离子还原力
杨梅叶中黄酮类成分铁离子还原力测定结果见图4。槲皮素、杨梅素、杨梅苷、山柰酚、L-抗坏血酸样品的D(593 nm)值:槲皮素>杨梅素>L-抗坏血酸>山柰酚≈杨梅苷。由此表明,槲皮素和杨梅素较杨梅苷和山柰酚具有明显的还原效果,即具有更强的抗氧化能力。

图4 铁离子还原力测定
3 讨论
本研究利用紫外检测器在波长200~400 nm内对对照品溶液进行紫外光谱全扫描,结果显示,杨梅素、杨梅苷、槲皮素和山柰酚在波长254 nm和360 nm处均有良好吸收。由于杨梅素、杨梅苷、槲皮素在360 nm处的吸收强度小于254 nm处,兼顾三者的灵敏度,因此确定检测波长为254 nm。四种活性成分的化学结构中均含有酚羟基,具有一定的弱酸性,在流动相中加入适量磷酸以改善峰形和分离效果。在上述色谱条件下,槲皮素、杨梅素、杨梅苷和山柰酚与相邻色谱峰的分离度均大于1.5,理论塔板数按杨梅素峰计算不低于4 000,各色谱峰拖尾因子在0.95~1.05内。样品含量测定结果表明,杨梅叶中杨梅素含量最高,山柰酚含量较少。
经典的中药活性成分研究需先将各物质通过分离纯化鉴定,再分别进行抗氧化实验的评价,耗时长且无法即时对提取方法进行测评。本实验将高效液相检测装置进行简单改造,建立DPPH-HPLC在线筛选抗氧化活性成分的方法,待测液首先经过适宜的色谱条件得到良好分离;随后,第一个紫外检测器得到色谱峰正信号,给出各个组分信息;经与DPPH自由基反应后的第二个检测器设置波长为517 nm,样品中如有抗氧化活性物质,则与DPPH自由基反应后,517 nm处响应值降低,相应的色谱峰为负值,无抗氧化活性的物质基本无负峰出现。本法筛选出杨梅叶粗提液中主要的抗氧化黄酮类成分应为杨梅苷、杨梅素、槲皮素、山柰酚。
为证实本法的抗氧化活性筛选结果,筛选出的抗氧化活性化合物通过DPPH、ABTS、FRAP实验验证其抗氧化活性,证实杨梅叶黄酮类化合物在线、离线相结合的筛选抗氧化活性成分的方法具有切实的可行性。DPPH·是以氮为中心的稳定自由基,其醇溶液呈紫色,在517 nm处有强吸收,如果试验样品能清除DPPH·,表明样品具有降低羟自由基、烷自由基或打断脂质过氧化链反应的作用[10]。ABTS在适当的氧化剂作用下氧化成绿色的ABTS+,在抗氧化物存在时ABTS+产生被抑制,通过测定705 nm处ABTS+光密度可计算样品的总抗氧化能力[11]。FRAP法是基于氧化还原反应,在酸性pH值下,Fe3+与TPTZ形成复合物(Fe3+-TPTZ),在还原物质的作用下,复合物被还原为Fe2+而呈明显的蓝色,在593 nm达最大吸收,其吸光度变化与还原物质的含量呈正比例关系,可以作为测定物质总抗氧化能力的一种方法[12]。综合分析以上不同方法的抗氧化试验,结果表明,杨梅叶中黄酮类成分的抗氧化活性为槲皮素的抗氧化能力最强,其次为杨梅素,且两者的抗氧化能力都强于L-抗坏血酸,而杨梅苷和山柰酚的抗氧化能力较弱。本实验在建立杨梅叶提取物化学成分色谱分离的基础上,进行抗氧化活性在线筛选,另针对四种活性成分进行DPPH·清除能力、总抗氧化能力以及还原力的研究,验证了DPPH-HPLC的分析结果。该法快速、有效,为杨梅叶这类可能含有易氧化降解成分的中药活性物质快速筛选提供了一定参考。
