长链非编码RNA AL139147.1在胃癌中的表达及对MKN-45胃癌细胞生长的影响
2021-03-12周新童任天宇党胜春
周新童,任天宇,党胜春
(江苏大学附属医院普外科,江苏 镇江 212001)
胃癌的发生发展复杂,涉及多个癌基因和信号分子[1-3]。长链非编码RNA (Long non-coding RNA,LncRNA)是一种长度超过200个核苷酸的转录本[4],本身并不参与蛋白质编码,其在肝癌、肺癌、结肠癌等多种肿瘤的增殖、转移过程中起重要作用[5]。LncRNA AL139147.1位于染色体1p31.3,长度为1 156 bp。目前,关于AL137147.1在胃癌中的表达及其对肿瘤生理过程的影响尚不清楚。近几年来,学者多利用公共数据库来获得大样本数据进行研究[6]。因此,本研究拟通过生物信息学方法,分析AL139147.1在胃癌中表达;并通过慢病毒介导的RNA干扰,沉默胃癌MKN-45细胞株中的AL139147.1表达,研究其对细胞增殖和生长周期的影响。
1 材料和方法
1.1 材料
胃癌细胞系AGS、MKN-45、HGC-27以及正常人胃上皮GES-1细胞均购于中国科学院上海生物化学与细胞研究所。RPMI 1640(美国Invitrogen公司);10%胎牛血清(美国Gibco公司);转染试剂聚凝胺(上海吉凯公司);Trizol试剂(上海普飞生物公司);逆转录及PCR试剂盒(大连TaKaRa公司);DEPC(北京博奥拓达科技);RNA 6000纳米试剂盒(美国安捷伦公司);逆转录酶(美国Promega公司); MTT及二甲基亚砜(上海试一化学试剂公司);Annexin V及碘化丙啶(北京夏思生物科技)。
AL139147.1及内参GAPDH引物由上海生工公司设计,AL139147.1上游引物:5′-TAGGTAATACCATTCGGGACA-3′,下游引物5′-CCATTCTGTAGGT TGCCTGTT-3′;GAPDH上游引物:5′-TGACTTCAACAG CGACACCCA-3′,下游引物:5′-CACCCTGTTGCTGTAGCCAAA-3′。AL139147.1 3个不同的目标短发夹RNA(shRNA)序列如下,shRNA#1:TCTACCAATGTGATGCGAA;shRNA#2:GCCCTCATTGCCAAGACAA;shRNA#3:GGTGGACCAGATGACCTTA;以及阴性对照序列(TTCTCCGAACGTGTCACGT)均由上海吉凯基因有限公司设计。慢病毒载体GV493和病毒包装的质粒购自上海吉凯基因有限公司,并经测序证实。
1.2 方法
1.2.1 生物信息学数据筛选 胃癌转录组测序数据TCGA-STAD-HT-Seq来自https:∥portal.gdc.cancer. gov癌症基因组图谱(The Cancer Genome Atlas,TCGA) ,共获得407个样本,其中胃癌组织375例,癌旁对照组织32例,同时下载胃癌临床样本文件TCGA-STAD,共计443例样本信息。行预后分析以及用临床资料来进行相关性分析时,将胃癌患者的测序数据与临床信息合并,共剩下375例。健康者胃黏膜组织测序数据来自https:∥gtexportal.org基因型-组织表达数据库(Genotype-Tissue Expression,GTEx),共获得194个样本。首先采用edgeR包对获取的数据进行标准化,之后通过sva包的combat函数实现批次校正,最后提取出375例胃癌组织、32例癌旁对照组织及194例正常胃黏膜组织中的AL139147.1表达用于后续研究。
1.2.2 细胞学实验
1.2.2.1 细胞培养 所有细胞均培养于RPMI 1640培养基中,其中含有10%胎牛血清、青霉素(100 U/mL)和链霉素(100 mg/L),并保持37 ℃室温和5% CO2浓度。
1.2.2.2 细胞分组和转染 将AL139147.1的3个目标shRNA序列以及阴性对照序列克隆至GV493载体中,并进行测序验证。随后取对数生长期的MKN-45细胞,分为空白对照组、阴性对照组、shRNA干扰组(shRNA#1组、shRNA#2组、shRNA#3组),接种于含无血清培养基的6孔板中,并维持5×105个/孔密度;当融合度达70 %时,通过聚凝胺将4 μL慢病毒空载体、携带阴性对照序列或目标shRNA序列的载体分别转染入各组细胞;培养16 h后,将细胞转移至完全培养基中,通过qRT-PCR检测AL139147.1相对表达量,从3个shRNA干扰组中选出AL139147.1表达降低最显著者用于后续实验。
1.2.2.3 qRT-PCR检测各细胞株中AL139147.1相对表达量 收集胃癌AGS、MKN-45、HGC-27细胞系以及正常人胃上皮GES-1细胞,以及“1.2.2.2”中各分组细胞;加入Trizol试剂、氯仿,离心分离上层清液;加入异丙醇沉淀RNA;用75 %乙醇漂洗2次;完全溶解于不含RNA酶的水中。用Nanodrop 2000分光光度计测定RNA浓度和D(260 nm)、D(280 nm)值。用RNA 6000纳米试剂盒检验RNA质量。用寡核苷酸引物和逆转录酶将总RNA逆转录成cDNA,反应条件:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min。PCR反应体系12 μL,其中绿色荧光混合物6 μL,上游引物和下游引物各0.15 μL,cDNA模版2 μL,双蒸水5.1 μL。反应条件:95 ℃热启动3 min,95 ℃变性10 min,56 ℃退火30 s,共40个循环。以GAPDH作为内部参照,用公式2-ΔΔCt计算AL139147.1相对表达。
1.2.2.4 MTT法检测细胞增殖 取“1.2.2.2”中MKN-45细胞,设shRNA#3组、阴性对照组和空白对照组,接种于96孔板,细胞密度5×103个/孔,孵育1~5 d。加入10 μL MTT(5 g/L),孵育4 h;每组细胞加入150 μL二甲基亚砜,孵育10 min;用酶标仪测量490 nm波长处光密度(D)值,绘制生长曲线,即可间接反映细胞增殖情况。每组实验重复3次。
1.2.2.5 流式细胞术检测细胞周期 细胞分组同“1.2.2.4”,用胰蛋白酶处理,PBS洗2次;并依次加入500 μL Annexin V结合缓冲液以及5 μL碘化丙啶;混合均匀后避光孵育约10 min;用流式细胞仪分析G0/G1期、S期和G2/M期细胞比例;每组实验重复3次。
1.3 统计学分析

2 结果
2.1 AL139147.1在胃癌中呈高表达且与患者预后有关
数据库分析结果显示,与癌旁对照组织和正常胃黏膜组织相比,胃癌组织中AL139147.1表达明显升高(Z=8.397,4.420,P均<0.05),癌旁组织和正常胃黏膜组织之间差异无统计学意义(Z=0.422,P=0.671)。见图1。生存分析显示,AL139147.1高表达患者总体生存和无病生存期均短于AL139147.1低表达者(P均<0.05)。见图2。

图1 AL139147.1在胃癌组织、癌旁组织和正常胃黏膜组织中的表达

图2 AL139147.1表达与患者总体生存时间及无病生存时间的关系
2.2 AL139147.1表达与临床病理特征间相关性
结果显示,AL139147.1表达与T分期、TNM分期以及肿瘤分化程度相关(P均<0.01),而与年龄、性别、肿瘤部位、胃癌家族史、N分期及M分期无明显相关性(P均>0.05)。见表1。
2.3 AL139147.1在胃癌细胞株中的表达
qRT-PCR检测结果显示,AGS、MKN-45癌细胞株中AL139147.1表达水平显著高于正常胃上皮GES-1细胞株(t=10.533和6.659,P均<0.05),其中MKN-45细胞更为明显,而HGC-27细胞表达与GES-1细胞比较差异无统计学意义(t=2.328,P>0.05)。因此,选择MKN-45细胞用于构建稳定低表达AL139147.1的细胞模型。
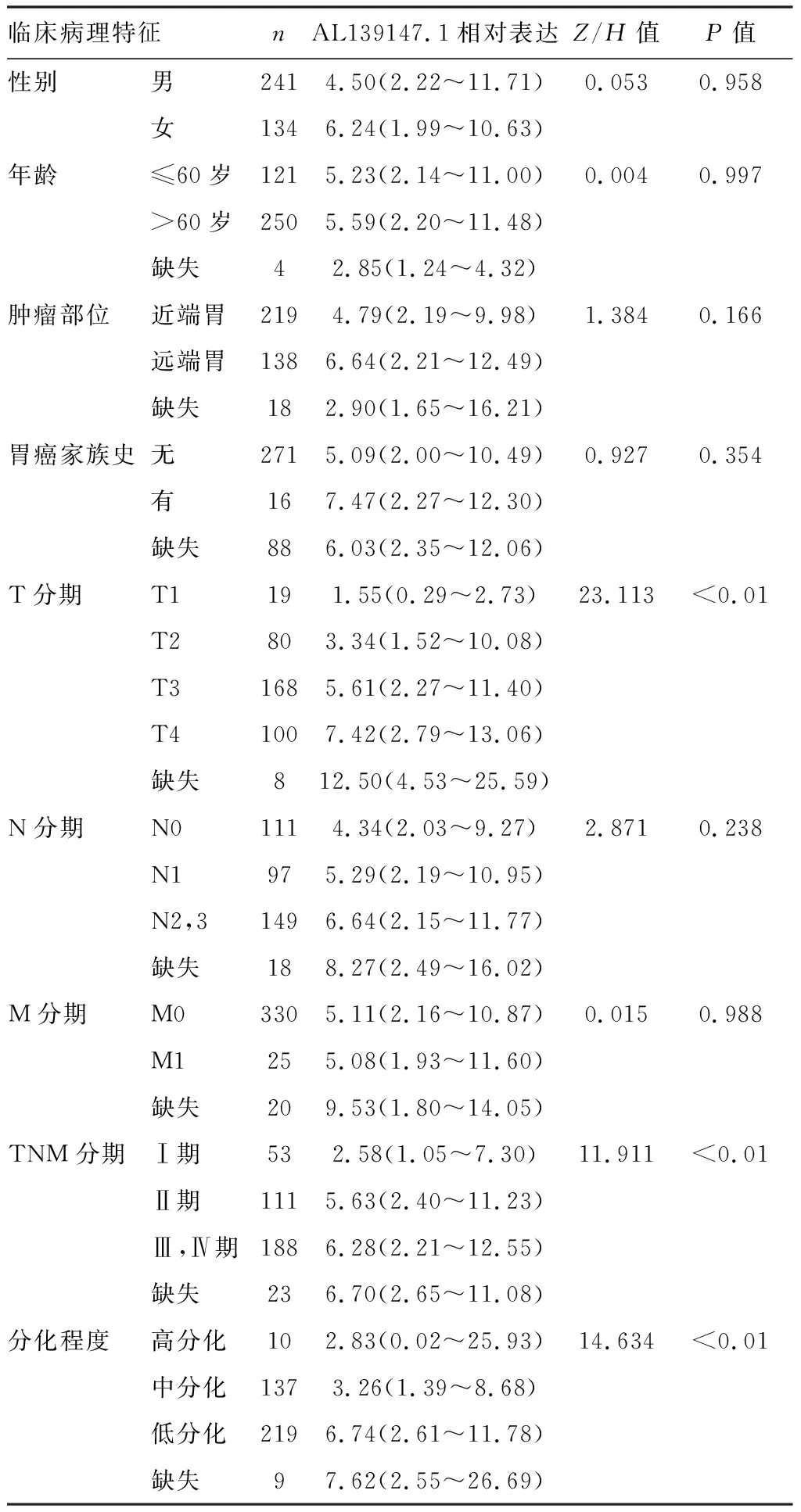
表1 胃癌患者AL139147.1表达与临床病理特征相关性
与阴性对照组相比,转染shRNA#3序列后,MKN-45细胞中AL139147.1表达水平显著降低(t=5.156,P<0.01),转染shRNA#1、shRNA#2序列后AL139147.1表达降低,但差异无统计学意义(P均>0.05)。因此,选择shRNA#3序列用于后续实验。见图3。
2.4 AL139147.1沉默减缓胃癌细胞增殖
MTT结果显示,与空白对照组及阴性对照组相比,shRNA#3组在培养了2、3、4、5 d光密度均显著降低(P均<0.05),而培养1 d差异无统计学意义(t=1. 348和1.362,P均>0.05)。由此表明MKN-45细胞增殖在AL139147.1沉默后明显减慢。见图4。
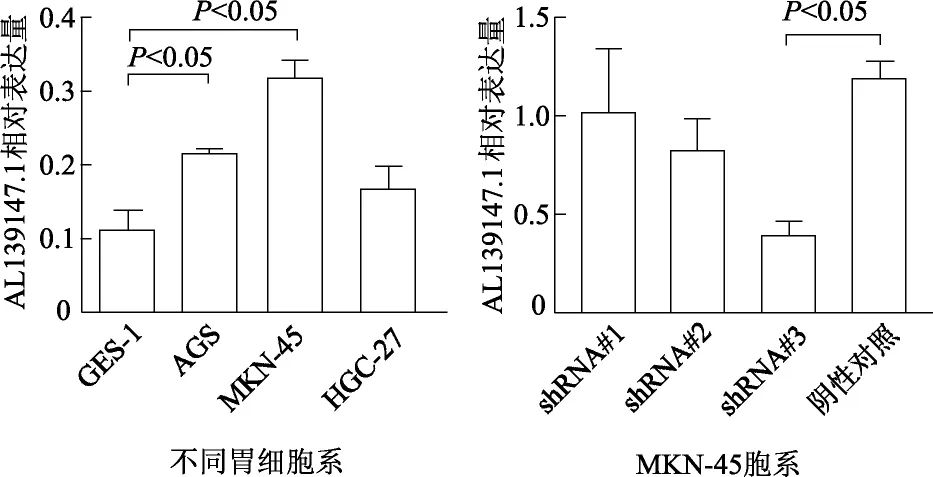
图3 qRT-PCR检测AL139147.1表达

a:P<0.05,与同时间点空白对照组比较;b:P<0.05,与同时间点阴性对照组比较
2.5 AL139147.1沉默致细胞周期停滞于G2/M期
流式细胞术结果显示,各组G0/G1期细胞比例差异无统计学意义(F=5.049,P>0.05),S期(F=39.943,P<0.01)和G2/M期(F=100.094,P<0.01)细胞间均有显著差异。其中,与空白对照组和阴性对照组相比,shRNA#3组中S期细胞比例均显著降低(t=9.181和6.771,P均<0.05),G2/M期细胞比例均显著增加(t=20.333和9.255,P均<0.05);空白对照组和阴性对照组S期、G2/M期细胞比例差异无统计学意义(P均>0.05)。
由此表明,AL139147.1表达沉默导致细胞周期停滞在G2/M期,从而影响胃癌细胞生长。见图5。
3 讨论
本研究通过TCGA和GTEx,分析AL139147.1在胃癌组织、癌旁对照组织及正常胃黏膜组织中的表达,发现其在胃癌中呈高表达;生存分析显示 AL139147.1表达较高患者生存时间更短,提示AL139147.1促进胃癌的发生发展,对患者预后判断具有一定价值。由于高通量测序数据具有一定的误差及背景噪音[7],本研究虽然在分析前已对数据进行标准化及批次校正,但结果仍需要更进一步验证。

a:P<0.05,与空白对照组比较;b:P<0.05,与阴性对照组比较
进一步分析发现,AL139147.1表达与T分期有关,提示AL139147.1可能影响肿瘤的生长。目前TNM分期已被视为胃癌患者生存的重要预测指标[8]。与Ⅰ期和Ⅱ期相比,Ⅲ期和Ⅳ期胃癌患者表现出较高的局部复发率和较差的生存结果,提示AL139147.1表达对判断胃癌的具体临床分期有一定的指导作用。AL139147.1表达与肿瘤分化程度有关,提示其可能影响肿瘤的分化及病理分型。有研究显示,胃癌分化程度虽然与胃癌患者预后无关,但与T分期和TNM分期显著相关[9]。因此,AL139147.1表达可能仅与T分期、TNM分期及肿瘤分化程度中的一个或两个参数直接相关,而与剩余因素只是间接相关,需要进一步分析。
qRT-PCR通过对样本中的微量核酸进行指数倍扩增,极大提高检测灵敏度,对LncRNA研究具有重要价值[10]。本研究通过qRT-PCR发现,胃癌AGS、MKN-45细胞中AL139147.1表达显著高于正常胃上皮GES-1细胞,而HGC-27细胞中表达高于GES-1细胞,但差异无统计学意义,提示AL139147.1并非在所有胃癌细胞中均呈高表达。
近几年来,很多研究表明LncRNA在癌细胞增殖、转移、细胞周期等生物学过程中起重要作用[6,11-12]。本研究结果显示,AL139147.1能够减缓胃癌MKN-45细胞增殖,并使其细胞周期停滞在G2/M期。由此推断,AL139147.1通过调控细胞分裂的G2/M期,从而影响胃癌细胞生长。此作用在其他胃癌细胞及实体肿瘤上是否同样存在,尚需后续验证。
综上所述,AL139147.1在胃癌中呈高表达,对胃癌临床分期、病理分级以及预后判断具有一定的价值,其表达沉默可以抑制胃癌MKN-45细胞增殖,使细胞周期停滞在G2/M期。
