N-乙酰半胱氨酸对哮喘小鼠模型气道炎症和氧化应激的影响
2021-03-12徐莉莉张军尚璐璐丁慢玲郑金旭
徐莉莉,张军,尚璐璐,丁慢玲,郑金旭
(1. 江苏大学附属医院呼吸科,江苏 镇江 212001; 2. 江苏大学附属澳洋医院呼吸科,江苏 苏州 215600)
支气管哮喘(简称哮喘)是以嗜酸性、中性粒细胞炎症和气道高反应性为特征的最常见的气道疾病之一[1]。哮喘患者气道中炎症细胞和结构细胞可产生大量活性氧,机体有一定的抗氧化能力,但是当活性氧过多时,造成气道上皮、内皮等结构不同程度的损伤,进而加重气道炎症,增加气道高反应性等[2-4]。组织核因子E2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)是一种氧化还原敏感的碱性亮氨酸拉链转录因子,参与多种抗氧化基因的转录调控。研究表明,激活Nrf2表达能减轻卵清白蛋白(Ovalbumin,OVA)诱导的哮喘小鼠的炎症[5-6]。N-乙酰半胱氨酸(N-acetylcysteine,NAC)是半胱氨酸的乙酰基衍生物,增加细胞内还原型谷胱甘肽含量,中和氧化剂[7]。目前,NAC在肺部疾病中如慢性阻塞性肺疾病[8]、急性呼吸窘迫综合征[9]、间质性肺疾病[10]等的治疗中发挥抗炎、抗氧化作用。但NAC对哮喘的作用及机制尚未有明确研究[11-12]。为此,本研究探讨NAC对哮喘模型小鼠气道炎症和氧化应激的影响及可能机制。
1 材料和方法
1.1 材料
1.1.1 实验动物 雌性BALB/c小鼠18只,6~8周,体重18~22 g,购自江苏大学实验动物中心[许可证号:SYXK(苏)202003784]。
1.1.2 主要试剂和仪器 OVA(Ⅴ级,美国Sigma公司);氢氧化铝凝胶(美国Pierce公司);氮乙酰半胱氨酸泡腾片(江苏大学附属医院,进口药品注册证号:H20150548,意大利Zambon S.p.A.公司);丙二醛、谷胱甘肽试剂盒(南京建成生物工程研究所);IL-13、IL-5、IFN-γ ELISA试剂盒(美国Proteintech公司);PCR试剂盒(日本TaKaRa公司);Trizol试剂(美国Invitrogen公司);引物及内参(GADPH)序列由金唯智公司设计合成,序列:HO-1上游5′-AAGCCGAGAATGCTGAGTTCA-3′,下游5′-GCCGTGTAGATATGGTACAAGGA-3′;Nrf2上游:5′-TAGATGACCATGAGTCGCTTGC-3′,下游5′-GCCAAACTTGCTCCATGTCC-3′;GAPDH上游5′-TGGATTTGGACGCATTGGTC-3′,下游5′-TTTGCACTGGTACGTGTTGAT-3′;超声雾化器(江苏鱼跃医疗设备股份有限公司);PCR仪器(美国Thermo公司);酶标仪(美国Bio-Rad公司);微量移液器(德国Eppendorf公司);HE染液试剂盒(武汉谷歌生物有限公司);血细胞计数板(上海求精有限公司)。
1.2 方法
1.2.1 哮喘模型构建 参照文献[13-14]建立哮喘模型。按随机数字法将18只小鼠均分为对照组,哮喘组,N-乙酰半胱氨酸组,每组6只。致敏阶段:第1天、第8天、第15天予哮喘组和N-乙酰半胱氨酸组每只小鼠腹腔注射致敏液0.2 mL(内含100 μg OVA+2 mg氢氧化铝凝胶+0.2 mL PBS);激发:于第22天开始,每天予2.5% OVA雾化吸入45 min,连续1周。对照组均予PBS替代,N-乙酰半胱氨酸组在每次雾化前30 min予NAC(300 mg/kg)灌胃,对照组和哮喘组予等量PBS灌胃。
1.2.2 取材和检测
1.2.2.1 ELISA法测定血清中相关细胞因子含量 1%戊巴比妥(10 mL/kg)腹腔注射麻醉小鼠,待其活动减弱后,眼球采血,置于EP管,每只约1 mL;冰上静置3 h,分离血清;4 ℃,3 000 r/min离心10 min,按照说明书分别检测IL-5、IL-13和IFN-γ含量。
1.2.2.2 BALF细胞总数及分类计数 采血处死后,将小鼠固定于手术板,颈部常规备皮、消毒,暴露气管,“T”形切口,插管,夹紧气管套管,0.8 mL预冷PBS注入肺,回抽并轻轻按摩肺部。重复3次,每次回收率>80%。4 ℃,1 500 r/min离心15 min;弃上清液,用1 mL PBS重悬,用血细胞仪计数细胞总数,瑞士染色分类计数,用光学显微镜计至少200个细胞,按标准形态分计中性粒细胞、嗜酸性粒细胞。
1.2.2.3 肺组织样本采集 肺泡灌洗结束后,每组小鼠均沿着颈部切口向下剪开胸部皮肤,逐层剥离肌肉和组织,暴露胸腔,取肺组织以备后续检测。
1.2.2.4 HE染色及炎症评分 取左肺用4%中性多聚甲醛室温固定48 h,中间换液一次;石蜡包埋、切片4 μm,溶蜡,二甲苯脱蜡,降级浓度梯度乙醇脱水,水洗;苏木素染色3 min,水洗;分色、氨化,水洗;伊红液染色2 min;乙醇脱水,二甲苯透明;中性树脂封固、烤片。在高倍显微镜下观察,使用Image Pro软件采集图片。炎症评分细则根据文献[15]如下,根据血管和支气管周围炎症细胞浸润程度进行评分:0分,无炎症细胞;1分,偶尔有炎症细胞缠绕;2分,薄层(1~5)层炎症细胞包围;3分,炎症细胞层厚>5层。
1.2.2.5 肺组织丙二醛和谷胱甘肽测定 取右肺组织,超声匀浆机研磨,4 ℃,4 000 r/min离心15 min;取上清液,按照说明书检测丙二醛、谷胱甘肽含量。
1.2.2.6 实时荧光定量PCR测Nrf2 mRNA、HO-1 mRNA表达 超声匀浆机研磨肺组织,用Trizol提取总RNA,按说明书逆转录合成cDNA,反应体系:引物混合液2 μL、dNTP混合液 4 μL、二硫苏糖醇2 μL、RNA模板4 μL、 缓冲液4 μL、逆转录酶 1 μL和无酶水 3 μL。PCR反转录仪上进行孵育,42 ℃ 50 min,85 ℃ 5 min,-20 ℃保存。以cDNA为模板,配制荧光定量PCR反应体系:2×SYBR GreenⅠ预混液10 μL、上游引物0.8 μL、下游引物0.8 μL、DNA模板2 μL和无酶水6.4 μL,共20 μL。PCR条件:95 ℃反应10 min;95 ℃反应15 s;60 ℃反应60 s;40个循环,计算2-ΔΔCt值分析相关mRNA表达。
1.3 统计分析

2 结果
2.1 各组小鼠血清炎症因子的比较
与对照组相比,哮喘组血清细胞因子IL-5、IL-13含量显著增加(t=5.090,12.443,P<0.05),IFN-γ含量明显降低(t=-10.344,P<0.05)。与哮喘组相比,N-乙酰半胱氨酸组中血清细胞因子IL-5、IL-13含量明显降低(t=-4.568,-12.981,P均<0.05),IFN-γ含量明显增加(t=14.109,P<0.05)。见图1。

a:P<0.05,与对照组相比;b:P<0.05,与哮喘组相比
2.2 各组小鼠支气管肺泡灌洗液细胞数比较
如图2所示,与对照组相比,哮喘组白细胞总数、嗜酸性粒细胞和中性粒细胞数显著增加(t=10.491,39.099,12.323,P均<0.05);与哮喘组相比,N-乙酰半胱氨酸组白细胞总数、嗜酸性粒细胞和中性粒细胞数明显减少,差异有统计学意义(t=-6.658,-19.704,-5.154,P均<0.05)。
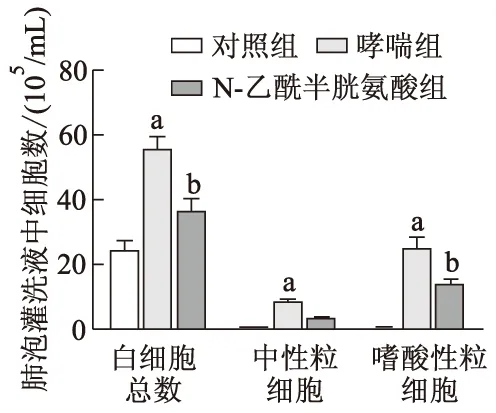
a:P<0.05,与对照组相比;b:P<0.05,与哮喘组相比
2.3 各组小鼠肺组织炎症的比较
肺组织HE染色显示,对照组肺泡及气道结构规整,管腔无狭窄,偶有少量炎症细胞。哮喘组肺组织结构明显紊乱,肺泡结构破坏明显,管腔狭窄,炎症渗出明显,血管周围水肿;N-乙酰半胱氨酸组炎症和肺组织损伤程度较哮喘组减轻。3组中哮喘组小鼠评分最高,哮喘组评分明显高于对照组(t=7.675,P<0.05),N-乙酰半胱氨酸组评分明显低于哮喘组(t=-8.935,P<0.05)。见图3。
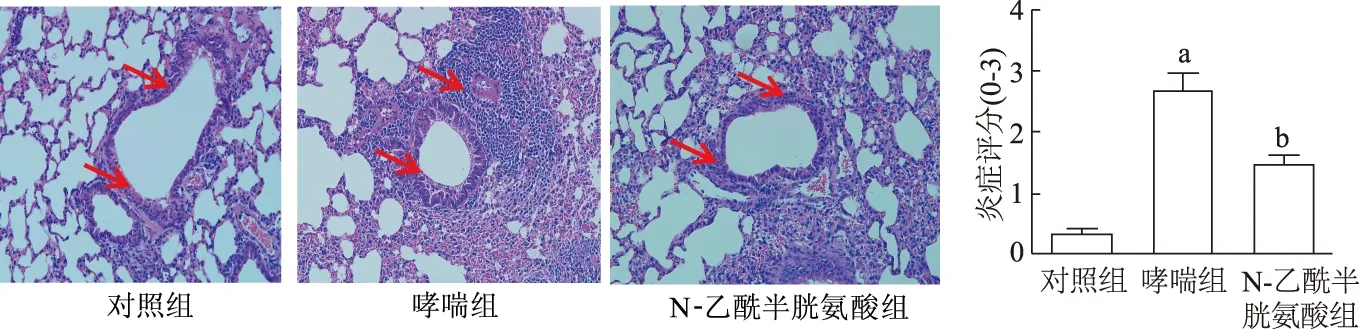
a:P<0.05,与对照组相比;b:P<0.05,与哮喘组相比
2.4 各组小鼠肺组织中丙二醛和谷胱甘肽含量的比较
与对照组比较,哮喘组肺组织中丙二醛含量明显升高,谷胱甘肽含量明显降低 (t=7.974,-4.850,P均<0.05);与哮喘组比较,N-乙酰半胱氨酸组中丙二醛含量明显降低,而谷胱甘肽含量明显升高(t=-6.709,5.772,P均<0. 05)。见图4。

a:P<0.05,与对照组相比;b:P<0.05,与哮喘组相比
2.5 各组小鼠肺组织HO-1 mRNA和Nrf2 mRNA表达比较
与对照组比较,哮喘组小鼠肺组织中Nrf2 mRNA、HO-1 mRNA表达差异无统计学意义(P均>0.05);与哮喘组相比,N-乙酰半胱氨酸组肺组织Nrf2 mRNA、HO-1 mRNA表达明显升高(P均<0.05)。见图5。

a:P<0.05,与对照组相比;b:P<0.05,与哮喘组相比
3 讨论
哮喘动物模型是研究抗哮喘药物及探究其发病机理的关键步骤,以OVA诱导哮喘小鼠模型,具备与人哮喘相似的临床症状和病理表现,是构建哮喘的理想模型[14]。本实验采用OVA诱导,成功构建哮喘模型小鼠,并将NAC作为干预药物,研究结果显示NAC具有抗哮喘作用。
嗜酸性粒细胞和中性粒细胞是哮喘重要的效应细胞,嗜酸性粒细胞在炎症部位释放的颗粒蛋白刺激黏液生成,引起组织水肿和气道阻塞,释放各种细胞因子和趋化因子,加重炎症[16]。中性粒细胞可以分泌多种炎症介质和细胞因子,促进炎症反应,导致气道重塑[17]。哮喘与Th1/Th2细胞失衡及其特有的细胞因子谱密切相关[18]。本研究显示,相对于对照组,OVA诱导的哮喘小鼠炎症细胞数、IL-5、IL-13水平显著增加,IFN-γ水平显著降低,肺组织HE染色显示气道周围有大量炎性细胞、结构紊乱、破坏。NAC的干预明显减少炎症细胞数量,降低Th2细胞因子水平,增加Th1细胞因子水平,减轻上述气道病理损伤表现,且炎症评分明显降低。由此推测,NAC能缓解哮喘小鼠气道炎症反应。
丙二醛是脂质过氧化中最丰富的活性醛,是细胞损伤的重要信号分子,作为细胞和组织氧化应激的指标[19]。谷胱甘肽是细胞内主要的硫醇抗氧化剂,是活性氧清除剂,在维持上皮完整性方面起着重要作用[20]。在本研究中,NAC显著抑制OVA诱导的氧化应激,NAC组小鼠肺组织中丙二醛含量减少,谷胱甘肽含量升高,提示NAC通过抗氧化反应对OVA诱导的哮喘有保护作用。
Nrf2/HO-1信号通路轴在调节氧化应激、炎症反应中起关键作用[5,21]。为进一步研究NAC保护机制,本实验研究NAC对Nrf2/HO-1信号通路的影响。结果表明N-乙酰半胱氨酸组Nrf2、HO-1mRNA表达明显升高。由此推测NAC可能通过激活Nrf2/HO-1信号通路起抗哮喘作用,这与Sussan等[22]研究显示的激活Nrf2表达能降低哮喘易感性观点一致。
