蛹期薜荔榕小蜂的琼脂培养
2021-03-09吴文珊陈友铃吴婷婷
赵 萌,吴文珊,陈友铃,吴婷婷
(福建师范大学生命科学学院,福建省发育与神经生物学重点实验室,福州 350117)
蛹期是寄生蜂生长发育过程中重要阶段,气候因素直接影响寄生蜂的生长发育,温度和光周期对蛹期昆虫发育的影响尤为显著(Hagstrum and Milliken,1988;文礼章等,1997;陈乾锦等,2004)。昆虫作为变温动物,不同种类的昆虫蛹,其发育需要不同的温度条件,文献表明室内培养昆虫蛹的最适温度范围为20~31℃,蛹发育历期随温度的升高而缩短(仵均祥等,1994;Dunnetal.,2008;顾俊荣等,2012),但温度过高可导致蛹的羽化率下降或无法羽化(李倩等,2017)。光周期对昆虫蛹的生长发育也产生影响(Watanabe,2000),通常认为短光周期(≤12 h)更利于昆虫蛹的羽化(徐金汉等,2002;孙晓婷等,2019),例如小地老虎Agrotisypsilon、黏虫Mythimnaseparata蛹期生长发育的最适光周期为0L∶24D (褚艳娜等,2014;王熠等,2019)。但光周期对斑翅食蚧蚜小蜂Coccophagusceroplastae蛹期的发育历期影响不明显(张方平等,2010)。
榕小蜂与榕树互惠共生,榕小蜂为榕树授粉,同时依赖榕树雌(瘿)花子房做为孕育场所,完成生命周期(罗光坦等,2000)。目前,榕-蜂生物学、行为学、化学生态学及繁殖生态学等领域的研究已取得丰硕的进展(彭艳琼等,2005;Herreetal.,2008;吴文珊和陈友铃,2008;Chenetal.,2012;Jansen-Gonzalezetal.,2012;杨升等,2017),但榕小蜂在虫瘿中漫长发育阶段的相关研究几为空白,亦无室内饲养或培养榕小蜂成功的先例。薜荔Ficuspumilavar.pumila属荨麻目(Urticales)桑科(Moraceae)榕属Ficus常绿攀援藤本植物,广泛分布于我国长江以南各个省区,是热带和亚热带植物生态系统的关键树种(张秀实等,1998)。薜荔瘦果富含果胶、蛋白质、维生素及矿质元素等养分(吴文珊和方玉霖,1999),是开发低脂低热保健饮品的首选资源,但薜荔结实依赖膜翅目(Hymenoptera)榕小蜂科(Agaonidae)的薜荔榕小蜂Wiebesiapumilae,没经榕小蜂授粉的花序将提前脱落(陈勇等,2003)。本实验以琼脂培养蛹期薜荔榕小蜂W.pumilae,探究不同温度和光周期对蛹期小蜂发育的影响,实现对榕小蜂蛹期发育的连续性观察;同时通过琼脂培养缩短蛹期榕小蜂的发育历期,解决蛹期植食性寄生蜂无法依据形态进行种类鉴定的难题,并有望不受环境、季节和寄主等因素的限制,快速获得大量标准化的实验虫源。
1 材料与方法
1.1 供试昆虫
薜荔榕小蜂采集于福州闽侯镇(26°01′N,119°12′E)。薜荔榕小蜂W.pumilae分子证据显示存在3个隐存种(Chenetal.,2012),本研究中的种类是分布于南部的隐存种2,由于目前尚未对该复合群其进行分类命名,仍用学名Wiebesiapumilae。
1.2 野外薜荔榕小蜂及其虫瘿的发育观测
2019年8月初,对新生长的薜荔雄花序进行标记,并选取其中的90个用100目的尼龙网袋(20 cm×20 cm)罩住以阻止小蜂进入薜荔果实干扰实验,每天观察花序发育状态,8月31日隐头花序的苞口开始松动,果内散发出芳香气味,表明花序小花开放进入雌花期(引诱传粉榕小蜂进果传粉或繁殖时期),于是打开网袋,每果放入15头小蜂产卵,翌日统计每果进蜂数,共获得产卵薜荔雄果88个。此后,每7 d随机采摘3个已被产卵的雄果,用密封袋装好带回实验室,将其纵向剖开,随机取30个虫瘿在立体显微镜下解剖,用解剖针将虫瘿划开并取出小蜂,置于载玻片上,使用显微镜观察并记录小蜂发育过程中的形态变化及虫瘿表皮层、保护层、内皮层的形态变化,监测榕小蜂发育进程,观测统计指标如下:

(2)虫瘿含水量:将剔除榕小蜂后的虫瘿立即置于2 mL指形管内,防止水分流失,每管10个虫瘿,共3组,使用分析天平称量,记录虫瘿总重,随后置于80℃烘箱内烘干至恒重后,记录虫瘿烘干后重量。虫瘿含水量(%)=(虫瘿总重-烘干后重量)/虫瘿总重×100%。
(3)羽化率:羽化,指榕小蜂已羽化但未打洞离开虫瘿。雌(雄)蜂羽化率(%)=雌(雄)蜂羽化成虫数/雌(雄)蜂总数×100%。
(4)出飞率:出飞,指羽化榕小蜂已打洞离开虫瘿。雌(雄)蜂出飞率(%)=雌(雄)蜂出飞成虫数/雌(雄)蜂总数×100%。
1.3 蛹期薜荔榕小蜂的琼脂培养
1.3.1琼脂培养基的制备:琼脂培养基的组成:琼脂15 g;超纯水1 000 mL,pH 7。将配制好的琼脂培养基分别放入高压蒸汽灭菌锅进行高压蒸汽灭菌(121℃ 0.105 MPa灭菌30 min);灭菌后将琼脂培养基分装入90 mL培养皿成平板,使各培养皿中形成至少5 mm厚的琼脂层(琼脂层厚度约为培养皿壁高度的1/2)。所有实验材料置于超净台内紫外线杀菌30 min。
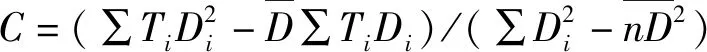
1.3.3不同光周期下蛹期薜荔榕小蜂发育速率观测:在28℃条件下,将虫瘿分别置于0L∶24D,10L∶14D,12L∶12D,14L∶10D和24L∶0D光周期处理的培养箱内,小蜂镜检同1.3.2节,并计算1.2节中的各项。每个培养皿30粒虫瘿,每个处理设5次重复。
1.4 数据分析
利用Excel 2016和SPSS 21软件进行实验数据处理,并依据Duncan氏多重检验进行多组样本间差异显著性分析。
2 结果
2.1 野生型薜荔榕小蜂预蛹至出飞发育过程中的形态变化
2.1.1预蛹:薜荔榕小蜂预蛹是5龄幼虫(图1:A)发育至初期蛹之间的一个短暂的过渡时期,虫体乳白,呈“C”型弯曲(图1:B)。在预蛹时期,虫体内部正在发生着某些组织器官解离与重组,出现蛹期的器官分化,并且中肠的活动静止,整个虫体处于不吃不动的状态,当发育至末期,虫瘿内壁虫体排出的蛹便清晰可见,雌性发育历期为23.06±5.67 d(n=39);雄性发育历期为21.97±6.68 d(n=31)。
2.1.2蛹:薜荔榕小蜂的蛹属于裸蛹(或离蛹),依据蛹的颜色以及其他特征,可以分为初期蛹、中期蛹和成熟蛹。
初期蛹:雌、雄蛹体的体色皆呈白色,分为头、胸、腹3部分,两性蛹体差异明显:雌性头扁腹圆,初具翅芽,复眼较大,随着发育的进行逐渐呈淡粉色(图1:C);雄性身体较雌性略瘦长,腹部渐细(图1:D),无翅芽,复眼小且无色。雌性发育历期为16.30±6.22 d(n=41);雄性发育历期为15.58±8.49 d(n=31)。
中期蛹:雌性蛹体依然呈白色,复眼颜色逐渐加深至黑色,单眼亦可见(图1:E),头部微微变黑;雄性身体的骨化速度较雌性更快,黑色复眼此时已经可见,头、胸、前翅皆呈淡黄色(图1:F)。雌性发育历期为16.95±6.36 d(n=50);雄性发育历期为15.91±8.54 d(n=27)。
成熟蛹:雌性已基本完成形态的分化,头、胸、腹的颜色依次加深至黑色,触角、附肢、足也变为黑色,翅折叠在蛹皮内,呈黑色盘状,蛹体保持静止状态(图1:G);雄性蛹体体色与雌性出现明显的差异,呈黄色,且末期颜色进一步加深至黄褐色,此时蛹体已完全骨化,与雄性成虫形态相似,头、背板、附肢由淡黄色逐渐变为黄褐色,身体能够轻微扭动(图1:H)。雌性发育历期为12.84±2.41 d(n=38);雄性发育历期为11.84±3.31 d(n=26)。
2.1.3成虫:羽化成虫:已羽化但在虫瘿内的成虫。雌成虫身体为黑色,头部扁平,两对触角,1对复眼和3只单眼清晰可见,两对翅已展开,覆密毛;前、中、后足均能活动,腹部具产卵器(图1:I);雄成虫身体为棕褐色,个体较雌性略小,具复眼,无单眼,一对触角,背无翅,虫体极度弯曲,前后足腿节粗壮,中足退化(图1:J)。雌蜂羽化至出飞的历期为8.17±1.51 d(n=49);雄蜂羽化至出飞的历期为7.16±2.58 d(n=44)。
出飞成虫:羽化并已离开虫瘿的成虫,雌、雄蜂各形态特征同羽化成虫(图1:K-L)。
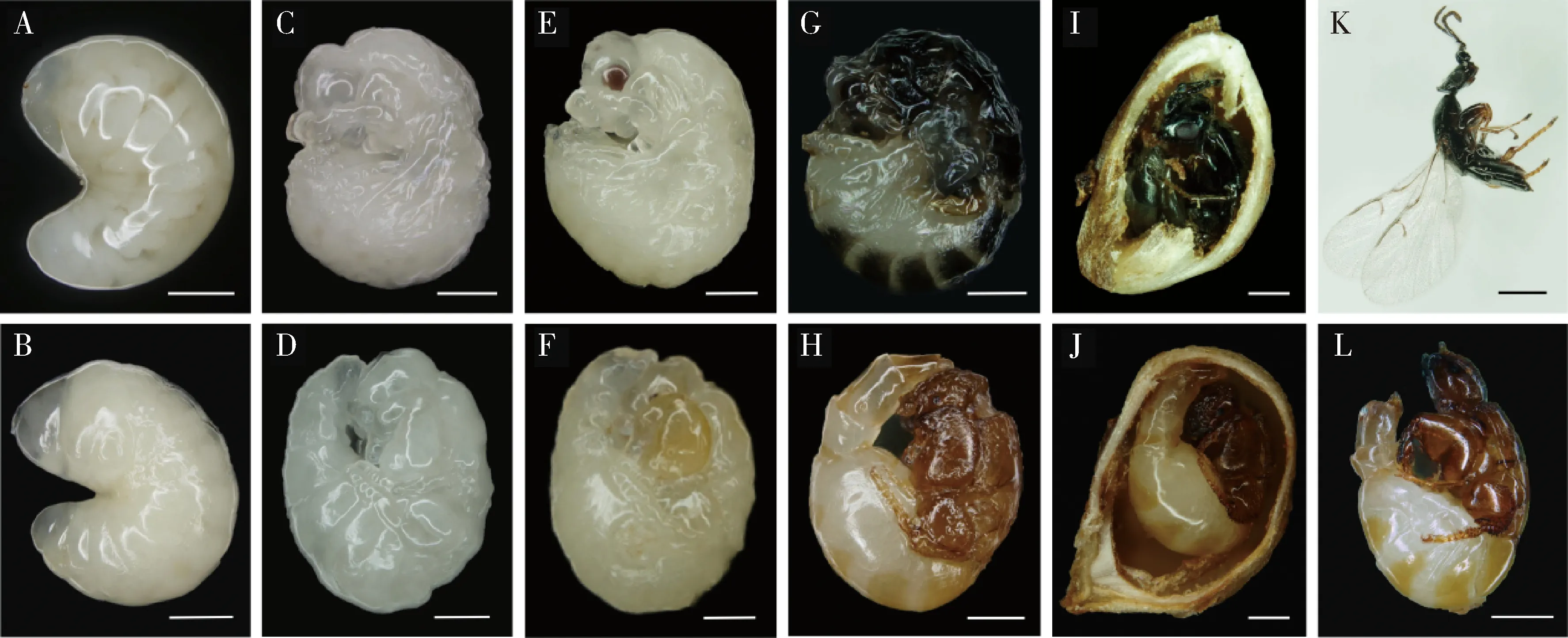
图1 薜荔榕小蜂5龄幼虫至出飞成虫发育过程中的形态变化Fig.1 Morphological changes during the developmental process of Wiebesia pumilae from the 5th instar larva to adult flying out of gallsA:5龄幼虫5th instar larva;B:预蛹Prepupa;C:雌性初期蛹Early female pupa;D:雄性初期蛹Early male pupa;E:雌性中期蛹Middle female pupa;F:雄性中期蛹Middle male pupa;G:雌性成熟蛹Mature female pupa;H:雄性成熟蛹Mature male pupa;I:羽化的雌成虫Emerged female adult;J:羽化的雄成虫Emerged male adult;K:雌性出飞成虫Female adult flying out of galls;L:雄性出飞成虫Male adult flying out of galls.标尺Scale bars=500 μm.
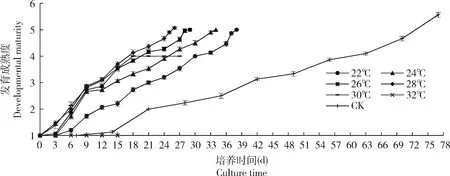
图2 温度对琼脂培养的蛹期薜荔榕小蜂发育的影响Fig.2 Effect of temperature on the development of Wiebesia pumilae in the pupal stage cultured on agar culture mediumCK:野外In the wild.发育成熟度:将榕小蜂从预蛹至成虫期的发育过程分6个阶段并以数值1-6依次赋值,则发育成熟度为每阶段所有实验小蜂赋值的平均值。Developmental maturity:The developmental process of fig wasps from prepupa to adult was divided into six stages and successively assigned by values 1-6,and the developmental maturity was the average value of all experimental fig wasps at each stage.

图3 30℃和32℃下琼脂培养的薜荔榕小蜂的存活率Fig.3 Survival rates of Wiebesia pumilae cultured on agar culture medium at 30℃ and 32℃
2.2 琼脂培养时温度对小蜂发育的影响
琼脂培养时,32℃下,薜荔榕小蜂发育停滞在预蛹阶段,表明高温阻碍薜荔榕小蜂的发育(图2),蛹体表面在第3天出现轻微皱缩,半致死率发生在第12天(图3),此时蛹体逐渐失去原本的形态,开始腐烂变软,体节已无法辨认,白色脂肪粒融为一团;第16天小蜂全部死亡,此时蛹体明显缩小,脂肪粒消失,变成无色透明状;30℃条件下,小蜂的半致死率发生在第21天(图3),部分小蜂能够发育至成熟蛹,但蛹体因失水变得不饱满且透明,失去正常虫态,无法羽化。
22~28℃范围内,薜荔榕小蜂发育速率与温度呈正相关(R2均大于0.96),培养温度越高薜荔榕小蜂发育历期越短,薜荔榕小蜂均能成功羽化,但4个温度下的薜荔榕小蜂羽化率无显著性差异(P>0.05)(表1),因此,仅从发育历期看,28℃培养薜荔榕小蜂发育最快,此条件下,薜荔榕小蜂从预蛹发育至成虫的历期较野外发育的雌、雄蜂(CK)提前约44.00 d(图2)。
琼脂培养条件下的薜荔榕小蜂发育较整齐,成熟蛹阶段通常没有其他发育期的薜荔榕小蜂存在,但野外对照组却有中期蛹存在(表1);雄蜂在22~28℃下的成熟蛹期和羽化期的发育历期没有显著差异(P>0.05),而雌蜂在各发育期均存在显著性差异(P<0.05)(表2);琼脂培养下雄蜂有少量出飞,而雌蜂均未能出飞(表1)。

表1 琼脂培养时不同温度下羽化期薜荔榕小蜂出飞率及虫瘿内未出飞小蜂的发育状态Table 1 The eclosion rate of Wiebesia pumilae wasps in the emergence period and the developmental status of non-eclosed wasps in galls cultured on agar culture medium at different temperatures
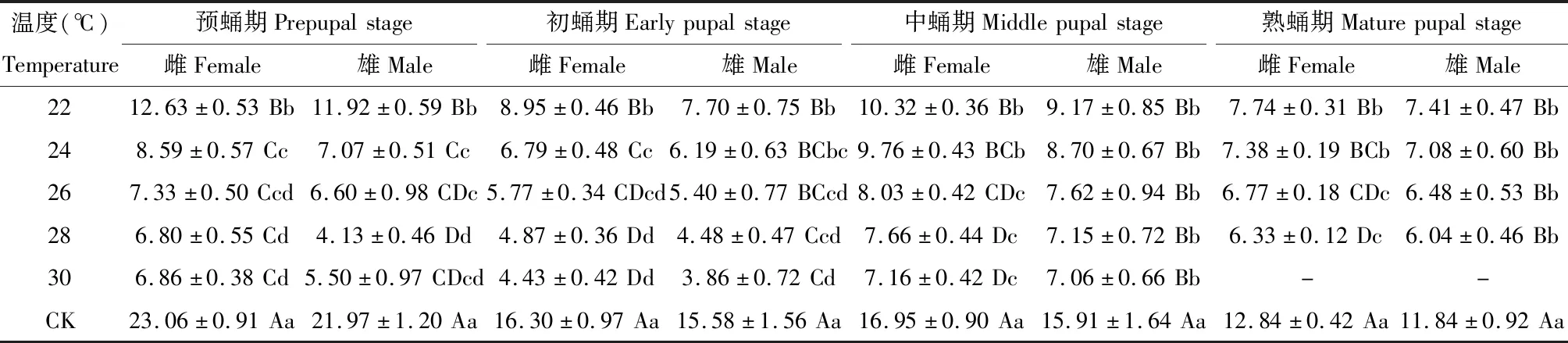
表2 琼脂培养时不同温度下薜荔榕小蜂各阶段蛹发育历期(d)Table 2 The developmental duration (d) of various stages of Wiebesia pumilae pupae cultured on agar culture medium at different temperatures
2.3 琼脂培养时温度对虫瘿内雌成虫寿命的影响
琼脂培养时,22,24,26和28℃下虫瘿内羽化薜荔榕小蜂雌成虫的寿命分别为48.97,36.62,28.86和22.24 h,各温度之间差异显著(P<0.05)(图4);用线性模型拟合雌性成虫的平均寿命(y)与温度(x)的直线回归方程:y=-0.20x+6.5,R2=0.96,说明虫瘿内薜荔榕小蜂雌成虫的寿命随温度的升高而显著缩短。

图4 不同温度下琼脂培养虫瘿内薜荔榕小蜂雌成虫寿命Fig.4 Longevity of female adults of Wiebesia pumilae in galls cultured on agar culture medium at different temperatures图中数据为平均值±标准误;柱上大小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)(Duncan氏多重检验)。Data in the figure are mean±SE.Different capital and small letters above bars indicate extremely significant differences (P<0.01) and significant differences (P<0.05),respectively (Duncan’s multiple range test).
2.4 薜荔榕小蜂蛹发育起点温度和有效积温
根据不同温度下蛹期薜荔榕小蜂的发育历期,采用直接最优法求出其不同发育阶段的发育起点温度和有效积温,表3结果表明,薜荔榕小蜂不同发育阶段的发育起点温度和有效积温均有差异,越是薜荔榕小蜂成熟的阶段,其发育起点温度越低,而所需有效积温越高。培养温度应高于预蛹至羽化成虫整个蛹期发育各阶段的发育起点温度,即培养温度的设置不低于17.18℃。
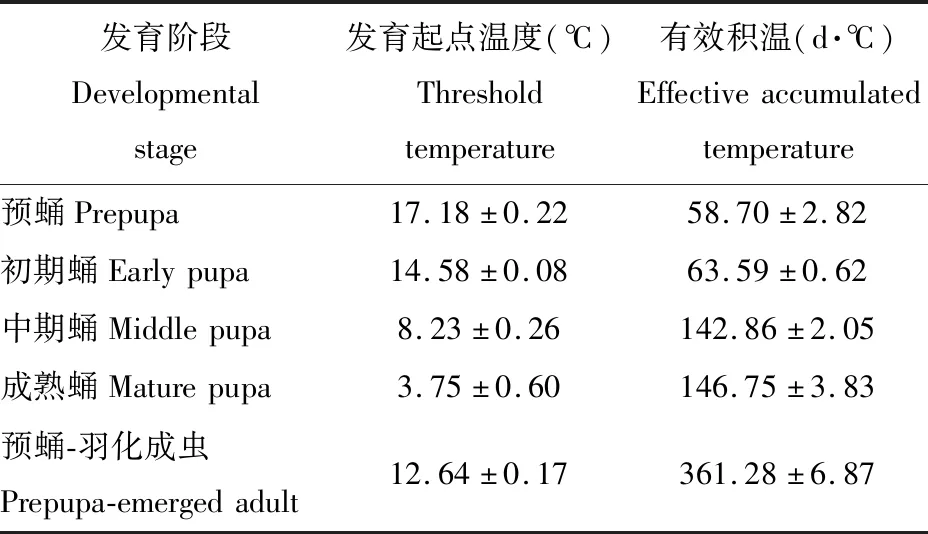
表3 蛹期薜荔榕小蜂的发育起点温度及有效积温Table 3 The threshold temperature and effective accumulated temperature of Wiebesia pumilae in the pupal stage
2.5 琼脂培养时光周期对蛹期薜荔榕小蜂发育的影响
琼脂培养时,28℃下,不同光周期对蛹期薜荔榕小蜂发育速率的影响无显著性差异(P>0.05)(表4),这可能是因为虫瘿的表皮层和内皮层在培养过程中很快就从黄色转为褐色,阻碍了光照对薜荔榕小蜂的作用,抑或自然条件下虫瘿位于密闭的榕果中,故蛹期薜荔榕小蜂对光的变化不敏感。
2.6 琼脂培养薜荔榕小蜂虫瘿含水量的变化
对不同温度下琼脂培养的虫瘿含水量测定结果表明(图5),随温度的升高,含水量下降速度逐渐加快;培养时间越长,虫瘿含水量越低。榕小蜂羽化时,22,24,26和28℃下的虫瘿含水量分别为37.34%,38.23%,39.94%和41.79%,两两之间均呈极显著性差异(P<0.01),且极显著低于野外对照组(51.63%)(P<0.01)。低含水量导致虫瘿表皮层、保护层、内皮层非常坚硬,给薜荔榕小蜂雌、雄蜂的打洞行为带来极大的困难。
2.7 野外生长和琼脂培养条件下的薜荔榕小蜂虫瘿发育形态特征比较
虫瘿壁分为表皮层、保护层和内皮层,虫瘿腔内具营养层和瘿室。野外预蛹阶段的虫瘿被湿润饱满的花被紧紧包裹,表皮层呈浅黄色,湿润且柔软(图6:A);保护层呈米白色且富有弹性,为位于瘿室内的蛹提供良好的生存空间;内皮层呈浅褐色,质感湿润柔软,使用镊子很容易从将其从保护层上完整剥离(图6:B,C)。野外薜荔榕小蜂羽化成虫阶段,虫瘿柄脱水明显,易与虫瘿分离,表皮层变为浅褐色,略有脱水(图6:D);保护层无明显变化,内皮层转呈褐色,因失水而无法完整撕下,质感较脆(图6:E-F)。琼脂培养条件下的虫瘿结构在预蛹期时,与野外无明显差异,羽化成虫时期,表皮层为深褐色,由于极度失水,干燥变硬,紧紧贴在保护层上(图6:G);保护层因脱水逐渐变硬,弹性减小;内皮层质感干硬,易碎成粉末状(图6:H-I)。
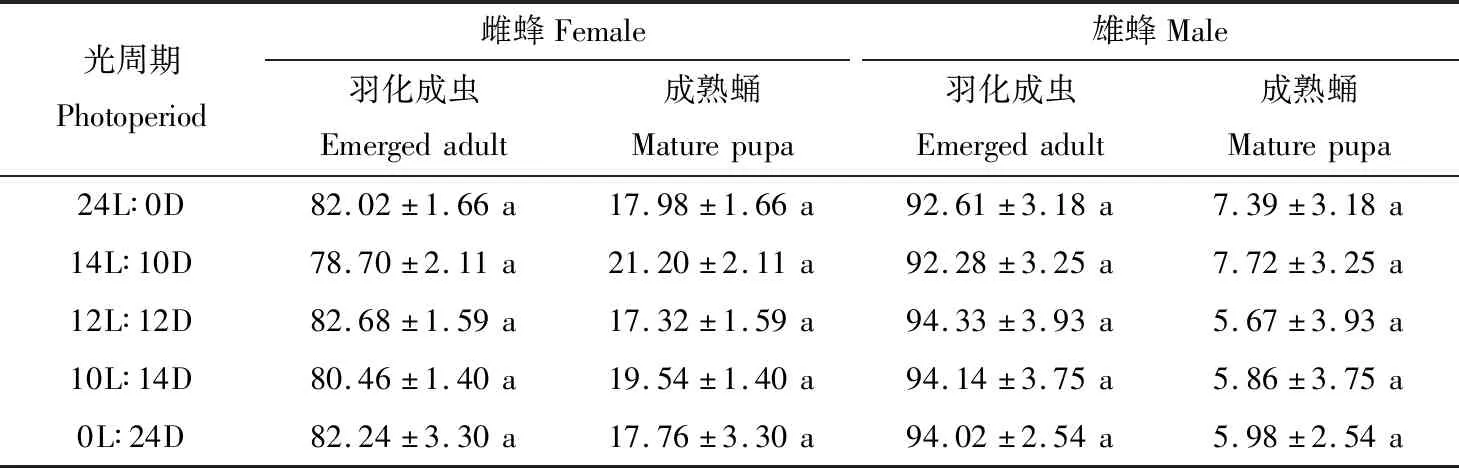
表4 不同光周期下琼脂培养的薜荔榕小蜂的不同虫态个体占比(%)Table 4 Proportions of individuals of different developmental status (%) of Wiebesia pumilae cultured on agar culture medium at different photoperiods

图5 不同温度下琼脂培养的薜荔榕小蜂虫瘿含水量Fig.5 The water content of Wiebesia pumilae galls cultured on agar culture medium at different temperatures
3 讨论
榕小蜂依赖专一的寄主供给营养才能完成发育,因此人工培养榕小蜂十分困难。本研究通过琼脂培养法实现了蛹期薜荔榕小蜂的室内培养,通过比较不同温度对蛹期薜荔榕小蜂发育的影响,确定了28℃为最适培养温度,为薜荔榕小蜂的批量生产创造了可能性;榕小蜂的成虫期通常1~2 d,而幼虫期长达数十天甚至数月,因此榕小蜂成虫采样极为困难,而易采集的幼期榕小蜂却难以鉴定,成为榕-蜂协同进行化领域的研究瓶颈,榕小蜂蛹期琼脂培养的成功,缩短了榕小蜂的发育历期,可快速便捷地获得虫源,为榕-蜂相关实验提供便利。
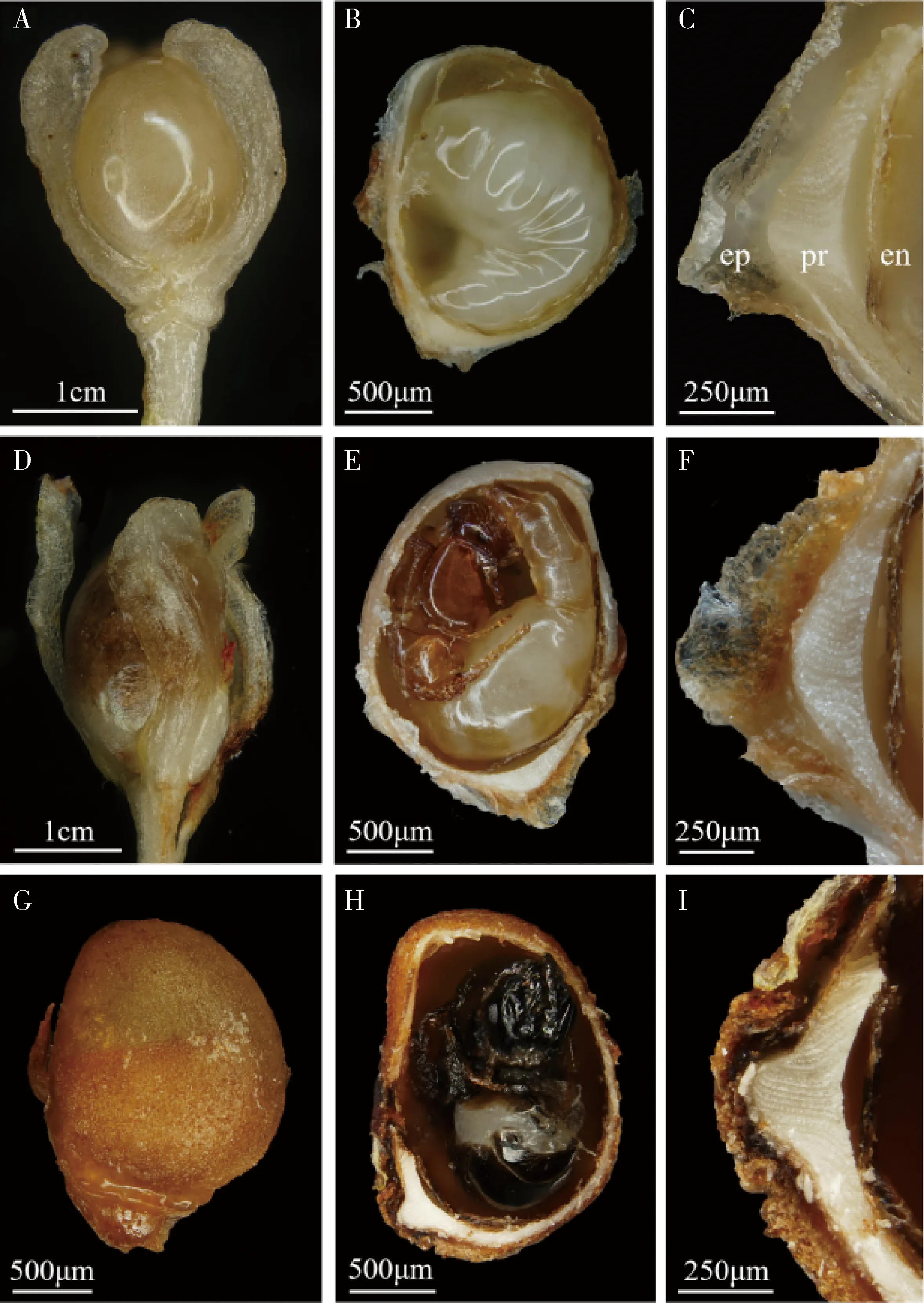
图6 野外和琼脂培养条件下薜荔榕小蜂预蛹及羽化成虫阶段的虫瘿结构比较Fig.6 Comparison of gall structure in prepupal and emerged adult stages of Wiebesia pumilae in the wild and cultured on agar culture mediumA-C:野外预蛹发育阶段Prepupal stage in the wild.A:虫瘿Gall;B:虫瘿内的预蛹Prepupa in gall;C:虫瘿壁Gall shell.D-F:野外羽化成虫阶段Emerged adult stage in the wild.D:虫瘿Gall;E:虫瘿内的雄性羽化成虫Emerged male adult in gall;F:虫瘿壁Gall shell.G-I:琼脂培养的羽化成虫阶段Emerged adult stage on agar culture.G:虫瘿Gall;H:虫瘿内的雌性羽化成虫Emerged female adult in gall;I:虫瘿壁Gall shell.ep:表皮层Epidermis;pr:保护层Protective layer;en:内皮层Endodermis.
3.1 薜荔榕小蜂蛹期发育与温度的关系
昆虫属于变温动物,受外界环境的影响较大;在自然进化的过程中,昆虫采取了一系列的措施来适应温度的变化并且形成了长期的协同适应机制(陈丽芳等,2015)。本研究结果表明,培养温度在22~28℃下薜荔榕小蜂均能完成个体发育,在此范围内培养温度越高,薜荔榕小蜂发育速率越快,但28℃下,虽发育最快,薜荔榕小蜂蛹期发育缩短了44.00 d(图2),但成虫寿命却缩短了近85%,因此建议将培养至成熟蛹阶段的薜荔榕小蜂转入22℃或更低的温度下培养,不仅可以延长成虫寿命,也能够减少虫瘿的水分蒸发,有利于薜荔榕小蜂打洞出飞;琼脂培养在预蛹和初期蛹发育历期的缩幅显著大于中期蛹和成熟蛹,可能是由于薜荔榕小蜂预蛹和初期蛹的发育起点温度较高,而有效积温较小的缘故;雄蜂的中蛹期和熟蛹期在22~28℃下的发育历期没有显著差异,而雌蜂在各发育时期均存在差异(表2),表明雌蜂比雄蜂对温度变化更为敏感。另外,在30℃和32℃培养温度下,薜荔榕小蜂在发育过程中均出现因失水造成体表皱缩的现象,可能是当外界环境温度超过一定限度时,薜荔榕小蜂增加了体内水分的蒸发以降低体内及体表温度,以避免高温伤害。持续高温也会使正常细胞内的水分平衡遭到破坏,对细胞产生不可恢复的损伤(Eliopoulos and Stathas,2003;Skovgrd and Nachman,2015),进而改变细胞、蛋白质等生物大分子的结构和功能(杜尧等,2007),导致小蜂死亡。由于30℃培养过程中,部分薜荔榕小蜂死亡,而部分小蜂能发育至成熟蛹(但无法羽化),表明薜荔榕小蜂对高温的耐受性存在个体差异,耐受性高的薜荔榕小蜂存活期较长,并由此推测30℃可能是薜荔榕小蜂的高温耐受性极限,超过此极限则导致预蛹滞育。
3.2 薜荔榕小蜂羽化后未能出飞的原因
自然界中雄性薜荔榕小蜂通常先于雌蜂羽化,并自行咬破虫瘿壁钻出,雌蜂则在虫瘿中等待雄蜂到来,雄蜂寻找到雌蜂所在虫瘿后从外部咬破虫瘿壁与其交配,雌蜂在此基础上,将雄蜂咬破的洞口继续扩大后钻出虫瘿,经苞口携粉出飞(Liuetal.,2019),而琼脂培养条件下绝大多数羽化薜荔榕小蜂均未能出飞的原因包括:(1)虫瘿的含水量低。从图5中的CK曲线可以看出,薜荔榕小蜂从预蛹到蛹羽化为成虫阶段虫瘿的含水量(湿度)变化为:预蛹-中期蛹阶段,含水量变化不明显,呈略有下降的趋势;但进入成熟蛹(56 d)之后,虫瘿含水量急剧下降,推测此期苞口开始松动,造成隐头果内湿度下降;但羽化期虫瘿含水量仍有51.63%,极显著高于琼脂培养条件下的虫瘿含水量最高组(41.79%)。琼脂培养基虽具有良好的保湿效果,但受培养温度(培养温度越高,虫瘿失水越快)和培养时长(培养时间越长,虫瘿失水越快,而培养温度越低,培养时间越长)影响,虫瘿组织因失水变化剧烈,表皮层和内皮层变为褐色、坚硬的革质状态,保护层弹性减小且硬度增大,从而给榕小蜂的打洞行为带来了极大的困难。(2)薜荔榕小蜂寿命缩短。虫瘿含水量降低,导致虫瘿内的湿度降低,影响小蜂体内水分平衡与代谢。(3)琼脂培养导致虫瘿固着不稳,增加了薜荔榕小蜂出飞打洞难度和速度。由于虫瘿均以虫瘿柄独立插在琼脂培养基中,出飞的雄蜂无法到达雌蜂所在虫瘿开掘交配孔,导致雌蜂无法出飞。
