角倍蚜虫瘿对盐肤木光合特性和总氮含量的影响
2013-12-09杨子祥陈晓鸣唐翊峰
李 杨,杨子祥,陈晓鸣,刘 平,唐翊峰
(中国林业科学研究院资源昆虫研究所,国家林业局资源昆虫培育与利用重点实验室,昆明 650224)
角倍蚜虫瘿对盐肤木光合特性和总氮含量的影响
李 杨,杨子祥*,陈晓鸣,刘 平,唐翊峰
(中国林业科学研究院资源昆虫研究所,国家林业局资源昆虫培育与利用重点实验室,昆明 650224)
通过温室栽培和接种实验,以接种角倍蚜形成虫瘿的盐肤木和未接种角倍蚜的盐肤木为实验材料,测定和分析虫瘿对盐肤木光合特性和不同组织氮含量的影响。结果表明虫瘿对盐肤木的光合作用形成扰动,与对照植株相比较:(1)有虫瘿复叶的最大净光合速率升高,其中虫瘿初期、中期和后期分别升高14.49%、32.17%和42.01%;虫瘿还引起无虫瘿复叶最大净光合速率升高,但中期以后下降到正常水平;(2)虫瘿中期有虫瘿复叶的光饱和点升高、无虫瘿复叶光饱合点下降;虫瘿初期和中期有虫瘿复叶的光补偿点升高、无虫瘿复叶光补偿点下降;(3)虫瘿初期引起有虫瘿复叶及邻近无虫瘿复叶暗呼吸速率升高,但中期和后期影响不显著。虫瘿对盐肤木光合作用的扰动程度与小叶的位置和虫瘿生长时期密切相关。同时,虫瘿改变了盐肤木叶片氮含量分布,其中虫瘿外壁、有虫瘿复叶和无虫瘿复叶的氮含量分别为1.13%、1.98%和2.14%,这可能是营养物质从无虫瘿复叶流向有虫瘿复叶,并最终流向虫瘿,满足虫瘿和瘿内蚜虫生长需求的原因。
角倍蚜;盐肤木;五倍子虫瘿;光合特征;总氮含量
五倍子是角倍蚜(Schlechtendaliachinensis(Bell))寄生在漆树科盐肤木(RhuschinensisMill.)的复叶上,刺激叶组织细胞增生膨大而形成的虫瘿(角倍)[1],该虫瘿含有丰富的单宁,是提取单宁酸、没食子酸和焦性没食子酸等化工产品的原料,在医药、化工、矿冶、农业、食品、环保、轻工和机械等行业中广泛应用。中国五倍子产量占世界总产量的95%以上,以单宁含量高、质优、量大而著名,被称为“中国五倍子(Chinensis gallnut)”,其中角倍是五倍子的主要生产种,产量约占五倍子总产量的75%[2]。
光合作用是植物利用光能,利用二氧化碳和水制造有机物并释放氧气的生化过程,是地球上最重要的化学反应之一[3]。光合作用是表征植物或作物品种的重要生理指标[4]。虫瘿形成对植物光合作用的影响已有较多报道,一些研究表明虫瘿形成引起寄主植物光合作用降低[5- 7],Katherine认为虫瘿形成干扰了植物营养的正常流动,导致植物光合作用降低,但虫瘿的形成不会干扰植物的水势状况一些研究表明虫瘿形成引起寄主植物光合作用降低[6];Florentine认为,虫瘿形成阻碍了水分的运输,导致植物光合作用降低[7]。另一些研究表明虫瘿形成导致寄主植物的光合作用升高[8- 10],原因是虫瘿形成后植物补偿性的生长以及虫瘿改变了植物正常的库-源关系,进一步研究表明,簇状虫瘿对植物光合作用的提高更为显著[10],因为库强度的增加可以增强寄主植物的光合作用能力。但虫瘿形成对寄主植物光合作用的影响是升高还是降低,目前还没有定论。
虫瘿是昆虫与植物互动的联合产物,是昆虫与植物在长期进化过程中相互适应的结果[11]。研究虫瘿对寄主植物光合生理的影响有助于弄清昆虫与寄主植物在虫瘿形成过程中的相互适应机制。本研究以角倍蚜及其寄主植物盐肤木为研究对象,系统测定和分析虫瘿形成前后及虫瘿形成过程中盐肤木叶片光响应曲线特征参数的变化规律,旨在弄清角倍蚜虫瘿对盐肤木光合作用的影响特征,为五倍子寄主树的管理和倍林的合理营建提供科学依据。
1 材料与方法
1.1 试验材料
盐肤木:从角倍自然分布地峨眉引种,种植于云南昆明资源昆虫所内温室内,树龄为4a,冬季对样本植株进行枝条修剪,控制树高为2 m左右,常规管理。
角倍蚜:秋季在峨眉以侧枝匐灯藓(Plagiomniummaximoiczii(Lindb)T.kop)制成藓盘,将成熟角倍内的秋迁蚜转移到藓上培育越冬。翌年3月中旬收集藓上的春迁蚜,装入虫袋内备用。
1.2 试验方法
1.2.1 蚜虫接种
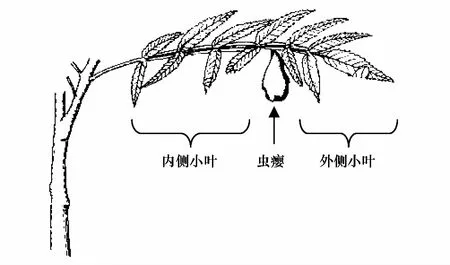
图1 虫瘿着生位置及内外侧小叶划分示意图 Fig.1 The gall inducing position and leaf-lets which inboard and outboard the gall
定期检查虫袋内蚜虫的发育情况,当有干母出现时,在虫袋外侧划口,将虫袋固定到盐肤木树干下部,划口朝向树干,让干母从开口处爬出,沿树干爬到嫩叶上取食形成虫瘿。虫瘿一般形成于复叶总轴两侧的叶翅上(图1)。
以不接种角倍蚜的盐肤木植株作为对照,对照植株与接种处理的植株的树龄、长势和管理方法尽可能一致。选择3株处理和2株对照进行测定。
1.2.2 试验材料选择及测定时期
(1)试验材料选择
在已经形成虫瘿的植株上分别选取有虫瘿复叶和无虫瘿复叶进行光合作用测定。
①有虫瘿复叶 以虫瘿所在位置为中心将小叶划分为内侧小叶和外侧小叶,从虫瘿到复叶基部的小叶为内侧小叶,虫瘿到复叶端部的小叶为外侧小叶(图1)。
②无虫瘿复叶 在虫瘿复叶邻近枝条上选择大小、位置和朝向相似的无虫瘿复叶,按同样的方法在对应位置将小叶划分内侧小叶和外侧小叶。
对照植株上的复叶选择和内外侧小叶的划分方法同上。
有虫瘿复叶上仅保留一个虫瘿,以降低由于虫瘿数量不同带来的差异。测定的内侧小叶和外侧小叶均为紧靠虫瘿的两片小叶(图1)。
(2)测定时期
根据虫瘿的大小和生长发育情况分3个时期分别进行测定:
①初期 测定时间为6月1日—6月15日,虫瘿大小为3—5 mm,已封口,瘿内有1只干母及2—3只干雌。
②中期 测定时间为 7月1日—7月15日,虫瘿大小为20—30 mm,角状突起开始出现,瘿内干雌数量约为100只左右。
③后期 测定时间为9月1日—9月15日,虫瘿大小为50—80 mm,角状突起明显,呈分叉状,瘿内干雌数为2000—3000只,但没有自然裂口。
1.2.3 光合光响应曲线测定
在晴朗天气下的08:30—11:30测定。CO2浓度为大气自然浓度,约为(400±20) μmol/mol,叶面温度为(26±3)℃(由Li- 6400温度控制器控制),光强以光合光量子通量密度(PPFD)设置,分别为2000、1800、1600、1400、1200、1000、800、600、400、200、150、100、80、50、20、0 μmol m-2s-1,(用Li- 6400 GB- 20红蓝光源调节),测定叶片的光合速率,由仪器自动记录。分别对有虫瘿叶片、无虫瘿叶片和对照进行交叉测定,以减少环境条件变化的误差。每个叶片重复5次,取平均值。
1.2.4 光合数据的分析
利用经典的非直角双曲线模型[12- 13],求出最大净光合速率(Amax)、曲角(K)和暗呼吸速率(Rd)。
模型公式:
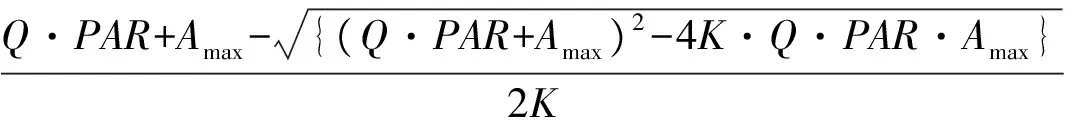
式中,Pn为净光合速率;Q为表观量子效率;Amax为最大净光合速率;K为曲角;Rd为暗呼吸速率;PAR为光强。
当PPFDlt;200 μmol m-2s-1时,对PAR-Pn进行直线回归,可计算出光饱和点和光补偿点。
1.2.5 盐肤木叶片总氮含量测定
在虫瘿生长期(8月1日—10日)分别采集虫瘿、有虫瘿复叶、无虫瘿复叶和对照复叶,按清水→洗涤剂→清水→1%盐酸→3次去离子水顺序冲洗后,立即在105℃下杀青30min,随后在80℃下烘干,不锈钢电磨粉碎后过60目筛,装袋备用。其中,虫瘿样品在处理前先剖开虫瘿,去除瘿内的蚜虫,仅测定虫瘿外壁的总氮含量。测定方法为凯氏定氮法,委托上海化工研究院采用MRK半自动定氮仪分析和测定。
1.2.6 统计分析
采用Excel和SPSS 13进行统计分析。两个样本间的比较采用独立样本t检验分析,多样本间的比较采用单因素方差分析(One-way ANOVA)及S-N-K与Scheffe多重比较(Plt;0.05)。
2 结果与分析
2.1虫瘿对盐肤木最大净光合速率(Amax)的影响
最大净光合速率是植物的最大光合速率与呼吸速率的净值,它代表了植物的实际光合能力[14]。角倍蚜虫瘿的形成和生长对盐肤木叶片最大净光合速率影响显著。在虫瘿初期,有虫瘿复叶、无虫瘿复叶和对照的最大净光合速率分别为(21.02±0.82) μmol m-2s-1、(20.14±1.36) μmol m-2s-1和(18.36±0.52) μmol m-2s-1,有虫瘿复叶和无虫瘿复叶差异不显著,比对照高14.49%;在虫瘿中期,有虫瘿复叶的最大净光合速率为(20.79±4.01) μmol m-2s-1,继续维持较高水平,而无虫瘿复叶和对照的最大净光合速率分别为(16.16±1.23) μmol m-2s-1和(15.73±1.74) μmol m-2s-1,与初期相比明显下降,有虫瘿复叶比对照高32.17%;在虫瘿后期,有虫瘿复叶、无虫瘿复叶和对照的最大净光合速率与初期和中期相比均显著下降,但有虫瘿复叶仍比对照高42.01%(图2)。表明虫瘿能使有虫瘿复叶的光合作用升高,并长时间维持在较高的光合水平,虫瘿还引起邻近无虫瘿复叶的光合作用升高,但持续时间较短,中期后开始下降。有虫瘿复叶和邻近无虫瘿复叶的光合作用升高并长时间维持较高的光合水平,有利于光合产物的积累,为虫瘿生长的提供了营养物质来源。
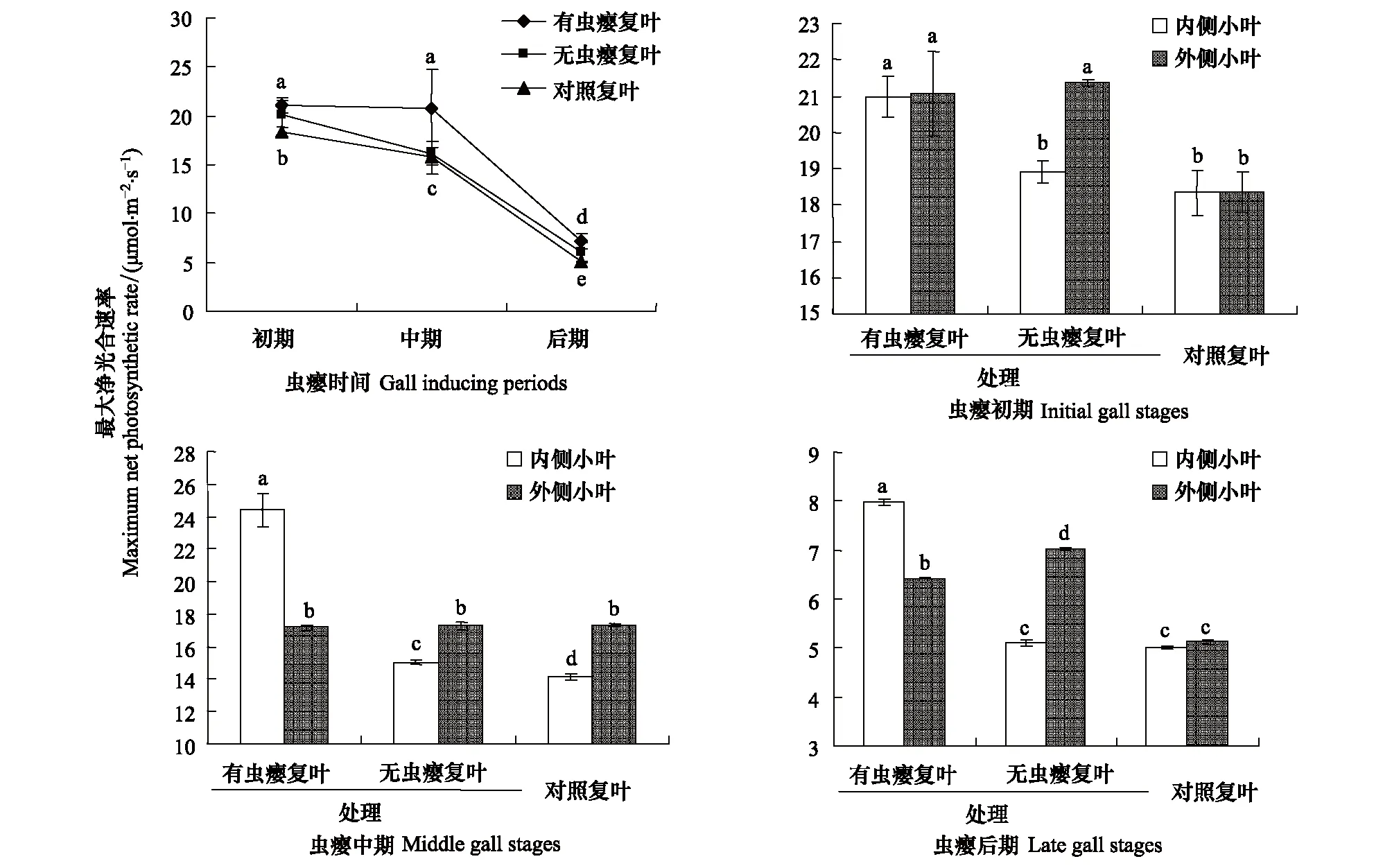
图2 虫瘿对盐肤木复叶最大净光合速率(Amax)的影响Fig.2 Effects of gall on maximum net photosynthetic rate of Rhus chinensis图中小写字母的异同表示数值差异是否显著(Plt;0.05)
在虫瘿初期,有虫瘿复叶的内侧和外侧小叶的最大净光合速率分别为(20.98±0.57) μmol m-2s-1和(21.06±1.16) μmol m-2s-1,差异不显著,而无虫瘿复叶的内侧小叶显著低于外侧小叶,对照的内外侧小叶分别为(18.35±0.62) μmol m-2s-1和(18.36±0.55) μmol m-2s-1,比有虫瘿复叶低(图2)。在虫瘿中期,有虫瘿复叶内外侧小叶最大净光合速率分别为(24.40±1.00) μmol m-2s-1和(17.18±0.11) μmol m-2s-1, 内侧小叶比外侧小叶高42.03%,而无虫瘿复叶和对照均为内侧小叶低于外侧小叶(图2)。在虫瘿后期,有虫瘿复叶内侧小叶的最大净光合速率仍高于外侧小叶,但无虫瘿复叶相反,内侧小叶低于外侧小叶,对照内外侧小叶差异不显著(图2)。
表明虫瘿对整个植株的光合作用造成扰动,并且扰动与小叶位置有关。自然状态下,盐肤木复叶的光合能力为内侧小叶低于外侧小叶,但叶片初期和后期内外侧小叶差异不显著。当复叶叶翅上生长虫瘿后,有虫瘿复叶和邻近无虫瘿复叶的内外侧小叶的光合能力均显著升高,其中外侧小叶升高更为显著。但当虫瘿体积较大时(虫瘿中期和后期),有虫瘿复叶的外侧小叶的光合能力低于内侧小叶,出现这种差异的原因可能是由于虫瘿的生长,阻碍了有虫瘿复叶的水分传输[7],导致外侧小叶光合能力下降,无虫瘿复叶没有虫瘿的阻碍,因此外侧小叶光合能力较强。同时,虫瘿对无虫瘿复叶光合能力的影响,可能是由于虫瘿改变了植株内部的源-库关系[10],使邻近复叶的营养物质流向虫瘿,导致邻近无虫瘿复叶的光合速率发生变化。
2.2 虫瘿对盐肤木光饱和点(LSP)的影响
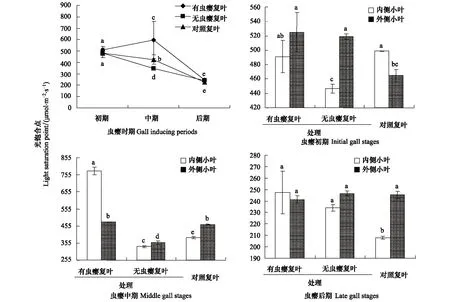
图3 虫瘿对盐肤木光饱和点(LSP)的影响Fig.3 Effects of gall on light saturation point of Rhus chinensis图中小写字母的异同表示同一时期数值差异是否显著(Plt;0.05)
光饱和点是指植物光合速率达到最大值时的光照强度,反映了植物对强光的利用能力[15]。在虫瘿初期,有虫瘿复叶、无虫瘿复叶和对照的光饱合点分别为(508.02±29.02) μmol m-2s-1、(482.73±39.70) μmol m-2s-1和(481.77±19.65) μmol m-2s-1,差异不显著。在虫瘿中期,有虫瘿复叶的光饱合点显著升高,为(598.49±164.19) μmol m-2s-1,比无虫瘿复叶的(346.05±14.05) μmol m-2s-1高72.95%,也比对照复叶的(425.19±41.98) μmol m-2s-1高了40.76%,而无虫瘿复叶和对照显著下降,分别为(346.05±14.05) μmol m-2s-1和(425.19±41.98) μmol m-2s-1。在虫瘿后期,有虫瘿复叶、无虫瘿复叶和对照的光饱合点均显著降低,三者的差异不显著(图3)。表明初期和后期虫瘿对盐肤木复叶的强光利用能力无明显影响,但中期使有虫瘿复叶对强光利用能力增强,并使邻近无虫瘿复叶对强光利用能力减弱。中期是虫瘿生长最快、生物量迅速增加的时期,复叶对强光的利用能力增强可能与虫瘿营养物质的快速积累有关。
在虫瘿初期,有虫瘿复叶的内外侧小叶的光饱合点分别为(491.05±22.38) μmol m-2s-1和(524.99±27.20) μmol m-2s-1,差异不显著,邻近无虫瘿复叶内外侧小叶的光饱合点分别为(446.72±5.99) μmol m-2s-1和(518.74±3.77) μmol m-2s-1,内侧小叶显著低于外侧小叶(图3)。在虫瘿中期,有虫瘿复叶内侧小叶的光饱合点升高到(777.88±23.64) μmol m-2s-1,外侧小叶降低为(478.90±1.60) μmol m-2s-1,内侧比外侧小叶高62.43%,而无虫瘿复叶和对照均为内侧小叶比外侧小叶低(图3)。在虫瘿后期,有虫瘿复叶和无虫瘿复叶的内外侧小叶光饱合点均下降到约245 μmol m-2s-1,且差异均不显著(图3)。表明自然状态下,盐肤木复叶的内侧小叶对强光的利用能力较外外侧复叶弱(叶片较小时除外),这与外侧小叶能接受更多的太阳直射光一致,当复叶上有虫瘿时,小叶对强光的利用能力发生变化,内侧小叶对强光的利用能力增强,在虫瘿生长最快的中期更为明显。
2.3 虫瘿对盐肤木光补偿点(LCP)的影响

图4 虫瘿对盐肤木光补偿点(LCP)的影响Fig.4 Effects of gall on light compensation point of Rhus chinensis图中小写字母的异同表示同一时期数值差异是否显著(Plt;0.05)
植物光补偿点是植物的光合强度和呼吸强度相等时的光照强度。当光强在光补偿点以上,植物的光合作用超过呼吸作用,可以积累有机物质;光补偿点以下,植物的呼吸作用超过光合作用,不能积累有机物质,而且还要消耗贮存的有机物质[3]。在虫瘿初期,有虫瘿复叶、无虫瘿复叶和对照的光补偿点分别为(15.79±2.11) μmol m-2s-1、(11.00±5.14) μmol m-2s-1和(5.77±2.56) μmol m-2s-1,有虫瘿复叶分别比无虫瘿复叶及对照分别高173.66%和58.40%。在虫瘿中期,有虫瘿复叶和无虫瘿复叶基本保持不变,分别为(18.47±3.12) μmol m-2s-1和(10.28±1.79) μmol m-2s-1,对照升高到(11.66±1.02) μmol m-2s-1,但有虫瘿复叶仍比对照高58.40%。在虫瘿后期,有虫瘿复叶的光补偿点下降到(6.85±4.27) μmol m-2s-1,显著低于无虫瘿复叶和对照(图4)。表明虫瘿使有虫瘿复叶的光补偿点升高,且从虫瘿初期到中期均持续较高水平,虫瘿后期迅速下降,这与虫瘿初期和中期的快速生长和有机物质的积累过程相一致。虫瘿还能提高邻近无虫瘿复叶的呼吸作用,但持续时间较短,到虫瘿生长中期降低到正常水平。说明虫瘿的存在使得叶片的消耗增加,寄主植物只有通过提高光补偿点来补偿呼吸作用的消耗以利于虫瘿营养物质的积累。同时,虫瘿使得复叶利用弱光的能力降低及利用强光能力的增强,与光饱和点升高的结论一致。
在虫瘿初期,有虫瘿复叶、无虫瘿复叶和对照的内侧小叶的光补偿点均比外侧小叶低(图4);在虫瘿中期,有虫瘿复叶的内侧小叶光补偿点高于外侧小叶,但无虫瘿复叶的内侧小叶则低于外侧小叶;在虫瘿后期,有虫瘿复叶和对照一致,均为内侧小叶光补偿点低于外侧小叶,而无虫瘿复叶相反,内侧小叶光补偿点高于外侧小叶(图4)。表明在自然状态下,盐肤木外侧小叶的光需求量较内侧小叶高,这与外侧小叶能接受更多的阳光一致,当虫瘿存在时,导致内侧小叶对强光的利用能力升高,在虫瘿中期和后期更为显著,这可能是由于虫瘿的生长和瘿内蚜虫数量增长对营养物质需求增加所引起。
2.4 虫瘿对盐肤木暗呼吸速率(Rd)的影响
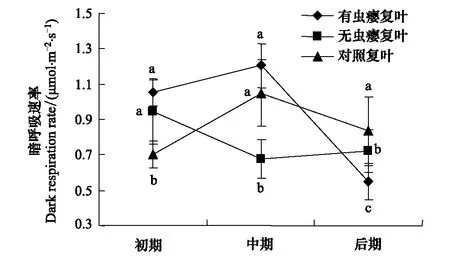
图5 虫瘿对盐肤木暗呼吸速率(Rd)的影响Fig.5 Effects of gall on dark respiration rate of Rhus chinensis初期Initial stage; 中期Middle stage; 后期Late stage; 图中小写字母的异同表示数值差异是否显著(Plt;0.05)
植物的暗呼吸速率(Rd)是指植物在无光照的情况下,植物需要消耗的干物质放出CO2的量[16]。暗呼吸对于植物的光合产物的积累至关重要,暗呼吸速率高,表明植物的消耗大,光合产物很大一部分被呼吸消耗[17]。但是,由于光合产物的合成与运输都需要由呼吸来提供能量[18],因此,暗呼吸速率越大表明植物的生理活性越高。在虫瘿初期,有虫瘿复叶、无虫瘿复叶的暗呼吸速率分别较对照复叶高50.00%、34.29%;虫瘿中期,有虫瘿复叶暗呼吸速率比无虫瘿复叶高76.47%,与对照复叶相比差异不显著;虫瘿后期,有虫瘿复叶暗呼吸速率比对照低50.91%,与无虫瘿复叶差异不显著(图5)。表明盐肤木复叶暗呼吸速率的变化与虫瘿的生长发育过程密切相关,虫瘿初期和中期使有虫瘿复叶呼吸作用加强,生理活性升高,且长时间维持较高水平,与这个时期虫瘿的生长和蚜虫数量的增加一致;到虫瘿后期,复叶的呼吸作用降低,生理活性下降。虫瘿初期还能引起邻近无虫瘿复叶的呼吸作用加强及生理活性升高,但中期以后显著下降。
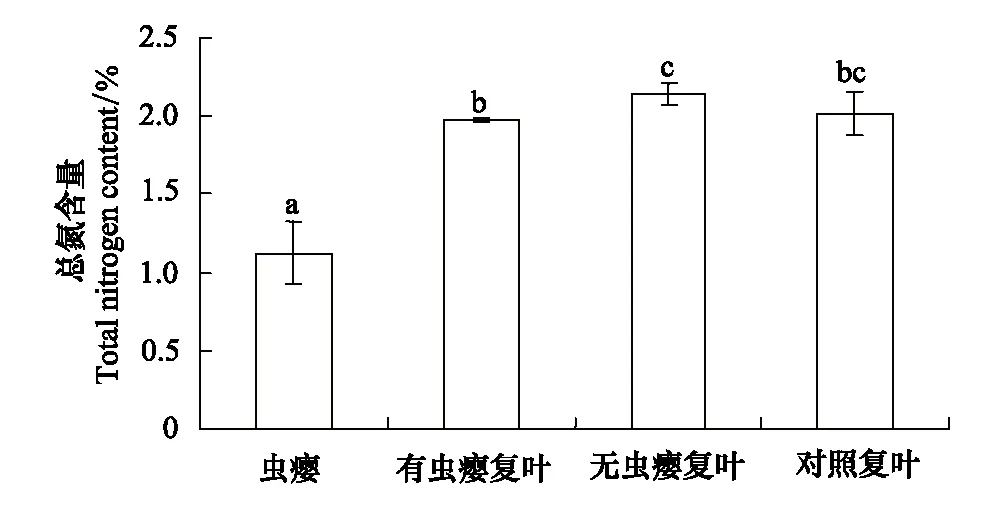
图6 盐肤木虫瘿和不同类型复叶的总氮含量 Fig.6 Total nitrogen content of horned gall and different leaves of Rhus chinensis虫瘿Galls;有虫瘿复叶Leaflets with galls;无虫瘿复叶Leaflets without galls;对照复叶Control;图中小写字母的异同表示数值差异是否显著(Plt;0.05)
2.5 虫瘿对植物不同组织总氮分布的影响
氮作为蛋白质和叶绿素的必要组分,是植物光合作用中重要的营养元素。氮可以通过对叶绿体发育、叶绿素生物合成及光合作用酶活性对光合作用进行调节[19- 20]。虫瘿的形成对植物中不同组织中的总氮含量有较大的影响。虫瘿、有虫瘿复叶、无虫瘿复叶和对照复叶的总氮含量分别为:(1.13±0.21)%、(1.98±0.01)%、(2.14±0.07)%和(2.02±0.14)%(图6),其中虫瘿的总氮含量最低,其次为有虫瘿复叶,无虫瘿复叶含氮量最高。表明虫瘿的形成导致盐肤木复叶氮含量分布的差异,改变了盐肤木营养物质的库-源关系,这可能会导致营养物质从无虫瘿复叶流向有虫瘿复叶,最终流向虫瘿,以满足虫瘿的生长和瘿内蚜虫的营养需求。
3 讨论
虫瘿是昆虫刺激寄主植物组织局部增生而形成的囊状物。虫瘿的形成是致瘿昆虫与寄主植物关系密切的反映,致瘿昆虫对寄主植物的操控是昆虫与植物相互作用中最显著、复杂的关系之一,是昆虫与寄主植物长期协同进化的结果[21- 22]。化石证据显示:倍蚜与寄主植物的寄生关系至少在4800万年前就已经建立[23]。在漫长的进化历程中,倍蚜与寄主植物相互适应、共同进化,形成了“完美”的寄生关系。本研究结果表明:角倍蚜虫瘿对寄主植物光合作用的影响是一种以虫瘿为主导的系统性影响。虫瘿不仅引起有虫瘿复叶的最大净光合速率、光饱和点、光补偿点和暗呼吸速率显著升高,还能调控邻近无虫瘿复叶的光合指标升高或降低,而且,叶片光合指标的差异还与虫瘿与小叶的相对位置和虫瘿生长阶段密切相关。同时,虫瘿还导致盐肤木不同位置叶片总氮含量的差异,使虫瘿组织的氮含量低于有虫瘿复叶,有虫瘿复叶低于邻近无虫瘿复叶,形成有利于虫瘿营养物质积累的源-库关系,因此,角倍蚜虫瘿的这种调控机制使寄主植物能够合成和积累更多的营养物质,对虫瘿的生长有利。这些特点反映了角倍蚜与盐肤木在长期进化中的相互适应关系。
虫瘿的生长引起有虫瘿复叶及邻近无虫瘿复叶光饱和点、光补偿点和暗呼吸速率显著升高,表明虫瘿复叶的呼吸作用增强,此时需要给虫瘿复叶提供较强的光照,才能补偿呼吸作用的营养物质消耗,使植物积累更多的营养物质,因此在虫瘿生长发育初期和中期,要采取适时修剪和合理整形等管理措施,使虫瘿叶片能接受更多的光照,促进营养物质积累,满足虫瘿的生长需求,提高五倍子产量。
虫瘿对寄主植物光合作用的影响是一个复杂的生理过程,叶片的光合生理指标不仅与叶片和虫瘿的相对位置有关,还随着虫瘿生长期的不同而变化。以最大净光合速率为例,在虫瘿初期,有虫瘿复叶内外侧小叶差异不显著,而无虫瘿复叶外侧小叶高于内侧小叶,在虫瘿中期和后期,有虫瘿复叶内侧小叶高于外侧小叶,而无虫瘿复叶的内侧小叶低于外侧小叶,对其他光合指标的影响也有相似的特点。前人研究结果表明虫瘿的形成引起寄主植物光合作用降低[5- 7],而另一些研究认为虫瘿的形成导致寄主植物的光合作用升高[8- 10]。本研究结果表明虫瘿对植物光合指标的影响与虫瘿和叶片的位置有关,并随着虫瘿的生长而变化,因此前人的研究可能是对叶片取样的位置不同或虫瘿生长期不同造成的差异。在测定和分析虫瘿对寄主植物光合生理的影响时,需要考虑虫瘿与叶片的位置和虫瘿的生长期,否则可能得到片面的结果。
[1] Zhang G X, Zhong T S. Ecomomic insect fauna of China. Fasc. 25 Homoptera, Part I. Beijing: Science Press, 1983: 78- 80.
[2] Zhang Z H. The processing and utilization of Chinese gallnut. Beijing: China Forestry Press, 1987: 1- 21.
[3] Wu WH. Plant physiology. Beijing: Science Press, 2008: 168- 170.
[4] Chen G Y, Yu G L, Chen Y, Xu D Q. Exploring the observation methods of photosynthetic responses to light and carbon dioxide. Journal of plant physiology and molecular biology, 2006, 32(6): 691- 696.
[5] Andersen P C, Mizell R F. Physiological effects of galls induced byPhylloxeranotabilis(Homoptera: Phylloxeridae) on pecan foliage. Environmental Entomology, 1987, 16: 264- 268.
[6] Katherine C L. The impact of two gall-forming arthropods on the photosynthetic rates of their hosts. Oecologia, 1998, 115: 161- 166.
[7] Florentine S K, Raman A, Dhileepan K. Effects of gall induction byEpiblemastrenuanaon gas exchange, nutrients, and energetics inPartheniumhysterophorus. BioControl, 2005, 50(5): 787- 801.
[8] Fay P A, Hartnett D C, Knapp A K. Increased photosynthesis and water potentials inSilphiumintegrifoliumgalled by cynipid wasps. Oecologia, 1993, 93(1): 114- 120.
[9] Bagatto G, Paquette L C, Shorthouse J D. Influence of galls ofPhanacistaraxacion carbon partitioning within common dandelion,Taraxacumofficinale. Entomologia Experimentalis et Applicata, 1996, 79(1): 111- 117.
[10] Dorchin N, Cramer M D, Hoffmann J H. Photosynthesis and sink activity of wasp-induced galls inAcaciapycnantha. Ecology, 2006, 87(7): 1781- 1791.
[11] Shorthouse J D, Rohfritsch O. Biology of insect-induced galls. Oxford: Oxford University Press, 1992: 1- 285.
[12] Prioul J L, Chartier P. Partitioning of transfer and carboxylation components of intracellular resistance to photosynthetic CO2fixation: A critical analysis of the methods used. Annals of Botany, 1977, 41: 789- 800.
[13] Liu Y F, Xiao L T, Tong J H, Li X B. Primary application on the non-rectangular hyperbola model photosynthetic light reponse curve. Chinese Agricultural Science Bulletin, 2005, 21(8): 76- 79.
[14] Wang A M, Zu Y G. Photosynthetic characteristics of Birch during different succession stages in great Xingan mountain. Journal of Jilin Agricultural University, 2005, 27(2): 190- 193.
[15] Yang X H, Zou Q, Zhao S J. Photosynthetic characteristics and chlorophyll fluorescence in leaves of cotton plants grown in full light and 40% sunlight. Acta Phytoecologica Sinica, 2005, 29(1): 8- 15.
[16] Coley P D. Herbivory and defensive characteristics of tree species in a lowland tropical forest. Ecological Monographs, 1983, 53(2): 209- 233.
[17] Song J H, Bai L P, Xin T, Fu Y P. Effects of windrow composting sewage sludge on photosynthesis and light response characteristics in poplar seedlings. Journal of Northeast Forestry University, 2011, 39(12): 39- 46.
[18] Dong Z X, Han Q F, Jia Z K, Ren G X. Photosynthesis rate in response to light intensity and CO2concentration in different alfalfa varieties. Acta Ecologica Sinica, 2007, 27(6): 2272- 2278.
[19] Hu M J,Guo Y P, Shen Y G, Zhang L C. Environmental regulation ofCitrusphotosynthesis. Chinese Journal of Applied Ecology, 2006, 17(3): 535- 540.
[20] Jia R F, Yin G T, Yang J C, Lin R S, Zou W T. Effects of Nitrogen application on the the growth and photosynthetic characteristics ofCalophylluminophyllumseedlings. Forest Research, 2012, 25(1): 23- 29.
[21] Nyman T, Julkunen-Tiitto R. Manipulation of the phenolic chemistry of willows by gall-inducing sawflies. PNAS, 2000, 97(24): 13184- 13187.
[22] Martinez J-J I. 2010. Anti-insect effects of the gall wall ofBaizongiapistaciae[L.], a gall-inducing aphid onPistaciapalaestinaBoiss. Arthropod-Plant Interactions, 2010, 4(1): 29- 34.
[23] Moran N A. A 48-million-year-old aphid-host plant association and complex life cycle: biogeographic evidence. Science, 1989, 245:173- 175.
参考文献:
[1] 张广学,钟铁森. 中国经济昆虫志,第25册,同翅目,蚜虫类(一). 北京:科学出版社,1983:78- 80.
[2] 张宗和. 五倍子加工及利用. 北京:中国林业出版社,1987:1- 21.
[3] 武维华. 植物生理学. 北京:科学出版社,2008:168- 170.
[4] 陈根云,俞冠路,陈悦,许大全. 光合作用对光和二氧化碳响应的观测方法探讨. 植物生理与分子生物学学报,2006,32(6):691- 696.
[13] 刘宇锋,萧浪涛,童建华,李晓波. 非直线双曲线模型在光合光响应曲线数据分析中的应用. 中国农学通报,2005,21(8):76- 79.
[14] 王爱民,祖元刚. 大兴安岭不同演替阶段白桦种群光合生理生态特征. 吉林农业大学学报,2005,27(2):190- 193.
[15] 杨兴洪,邹琦,赵世杰.遮荫和全光下生长的棉花光合作用和叶绿素荧光特征.植物生态学报,2005,29(1):8- 15.
[17] 宋金洪,白莉萍,辛涛, 伏亚萍. 条垛式堆肥污泥对杨树幼苗光合光响应特性的影响. 东北林业大学学报,2011,39(12): 39- 46.
[18] 董志新,韩清芳,贾志宽,任广鑫. 不同苜蓿(MedicagosativaL.)品种光合速率对光和CO2浓度的响应特征. 生态学报,2007,27(6):2272- 2278.
[19] 胡美君,郭延平,沈允钢,张良诚. 柑橘属光合作用的环境调节. 应用生态学报,2006,17(3):535- 540.
[20] 贾瑞丰,尹光天,杨锦昌,李荣生,邹文涛. 不同氮素水平对红厚壳幼苗生长及光合特性的影响. 林业科学研究,2012,25(1):23- 29.
EffectsofChinesegallnutonphotosyntheticcharacteristicsandtotalnitrogencontentofRhuschinensis
LI Yang, YANG Zixiang*, CHEN Xiaoming,LIU Ping, TANG Yifeng
TheResearchInstituteofResourceInsects,ChineseAcademyofForestry;KeyLaboratoryofCultivationandUtilizationofResourceInsectsofStateForestryAdministration,Kunming650224,China
Chinese gallnut which formed by some aphids is a special local product of China and valued as a commercial product for export.Schlechtendaliachinensisis the main commercial species which induces horned gall onRhuschinensisand its shares about 75% more Chinese gallnut yield of the world. Effects of horned gall on photosynthetic characteristics and total nitrogen content ofR.chinensiswere analysed in Kunming, Yunnan province. The result indicated that photosynthetic characteristics ofR.chinensiswere disturbed by the horned gall. Compared to the control plants, (1) maximum photosynthesis rates (Amax) of the leaves induced gall of treatment plant rose to 14.49%, 32.17%, and 42.01% by horned galls in the initial, middle and late gall stages, respectively. Maximum photosynthesis rates of the nearby leaves without gall were also raised but declined after middle gall stage. (2) light-compensation points (Lcp) of the leaves induced gall were raised, but the Lcp of the leaves without gall were declined in middle gall stages. Light-saturation points (Lsp) of the leaves induced gall were raised, but the Lsp of the leaves without gall were declined in initial and middle gall stages. (3) dark respiration rate (Rd) of the leaves both induced gall and without gall were raised in the initial gall stages, but no significant influences in the middle and late gall stages. Effects of horned gall on photosynthetic characteristics ofR.chinensisleaves were correlated to the leaflet positions and the gall growth stages. At the same time, the total nitrogen content distribution ofR.chinensisleaves had been changed by the horned gall. Total nitrogen contents of gall, leaves induced gall and leaves without gall were 1.13%, 1.98%, and 2.14%, respectively. It is the possible reasons that nutrition flows to the leaves which induced gall and finally to the galls from leaves without gall, and supplied to the gall and galling aphids need.
Rhuschinensis;Schlechtendaliachinensis; Chinese gallnut; photosynthetic characteristics; total nitrogen content
国家林业公益性行业专项(201204602);国家自然科学基金项目(31372266,31370651)
2012- 07- 04;
2012- 11- 19
*通讯作者Corresponding author.E-mail: yzx1019@163.com
10.5846/stxb201207040931
李杨,杨子祥,陈晓鸣,刘平,唐翊峰.角倍蚜虫瘿对盐肤木光合特性和总氮含量的影响.生态学报,2013,33(21):6876- 6884.
Li Y, Yang Z X, Chen X M,Liu P, Tang Y F.Effects of Chinese gallnut on photosynthetic characteristics and total nitrogen content ofRhuschinensis.Acta Ecologica Sinica,2013,33(21):6876- 6884.
