Mdogg1基因参与家蝇体内氧化还原平衡的维持
2021-03-10张玉明邵梦华李亚静魏丽亚柳峰松
张玉明,邵梦华,李亚静,冯 琴,魏丽亚,*,柳峰松,*
(1.河北大学生命科学学院,河北保定 071002;2.河北大学生命科学与绿色发展研究院,河北保定 071002)
线粒体是细胞进行氧化磷酸化的场所,是细胞的能量和代谢调控中心。同时,氧化呼吸代谢旺盛的线粒体也是细胞内活性氧(reactive oxygen species,ROS)自由基生成的主要场所(Chakrabartyetal.,2018)。DNA分子中鸟嘌呤对ROS特别敏感,易受到氧化损伤而转化为8-羟基鸟嘌呤(8-oxoguanine,8-oxoG)。8-羟基鸟嘌呤与胞嘧啶和腺嘌呤均可配对结合,会使DNA发生G:C到T:A的颠换突变,可能导致多种严重的疾病(Vlahopoulosetal.,2019)。因此,8-羟基鸟嘌呤是一种公认的DNA氧化损伤的标志物(Ba and Boldogh,2018)。线粒体DNA (mtDNA)结构中没有组蛋白结合,裸露存在于线粒体基质中,比核基因组更易受ROS攻击破坏。有报道称,8-羟基鸟嘌呤在线粒体中的浓度可达到细胞核中3~16倍(Radyuketal.,2006)。
大肠杆菌Escherichiacoli中DNA糖苷酶MutM是最早发现具有切除8-羟基鸟嘌呤的酶(Michaelsetal.,1991)。随后,研究证实酿酒酵母Saccaromycescerevisiae中8-羟基鸟嘌呤糖苷酶1(8-hydroxyguanine glycosylase 1,OGG1,EC 3.2.2.23)也具有相同功能(Nashetal.,1996;Sandigurskyetal.,1997)。然后,碱基剪切修复(base excision repair,BER)机制和OGG1功能才开始在哺乳动物中得到普遍关注,证实了OGG1对于mtDNA和核基因组DNA均具有重要的保护作用。OGG1酶兼具DNA糖基化酶和脱嘌呤/嘧啶(apurinic/apyrimidinic,AP)裂解酶的活性,可特异性识别和切除8-羟基鸟嘌呤,从而恢复基因组中正常的G:C配对(陈黎媛等,2014)。在昆虫中,黑腹果蝇Drosophilamelanogaster的ogg1研究最为深入,研究内容涉及基因克隆、结构分析和功能验证(Dherinetal.,2000;Yasukawaetal.,2015;Okumuraetal.,2019)。
家蝇Muscadomestica是一种分布广泛的双翅目昆虫,具有生活周期短、繁殖能力强和易于饲养等优点(刘键柏等,2020)。研究者所在实验室对家蝇中参与氧化应激和免疫调控的多种基因进行了功能鉴定,已经将家蝇开发为研究氧化应激、先天性免疫和线粒体功能的理想模型生物(顾冀海等,2017;蔺冬冬等,2019;Zhangetal.,2020)。前期研究发现,细菌刺激后的家蝇转录组中ogg1基因(Mdogg1)显著上调(Tangetal.,2014),暗示该基因在家蝇中具有参与氧化应激调控的功能。本研究旨在克隆鉴定家蝇Mdogg1基因,验证其参与氧化应激调控的功能作用。
1 材料与方法
1.1 试虫来源及饲养
家蝇种蝇为中国科学院动物研究所何凤琴老师惠赠,已由本实验室饲养繁殖多代。饲养条件为:温度25℃,相对湿度50%~70%,光周期12L∶12D。家蝇幼虫饲料由70 g麸皮和100 mL水组成;家蝇成虫饲料为0.5 g白糖,1 g奶粉和10 mL水。
1.2 Mdogg1的克隆和原核表达
用RNAiso Plus试剂[大连宝生物(TaKaRa)有限公司]提取5头家蝇幼虫总RNA。提取获得的RNA经琼脂糖凝胶电泳检测其完整性,并利用核酸定量仪测定其浓度和纯度后,以2 μg总RNA为模版,用Oligo (dT)18为引物反转录合成cDNA。
根据本实验室家蝇转录组中序列信息(Tangetal.,2014),设计Mdogg1基因开放阅读框(ORF)扩增引物Ogg-F1(5′-ATGCTTTCAGTTTCATTCAAGT-3′)和Ogg-R1(5′-TCACTTCTTTCGTTTCTTGTTG-3′)。以获得的家蝇cDNA为模板进行PCR扩增。PCR反应体系(25 μL):cDNA模板(300 ng/μL) 1 μL,正反向引物(10 mmol/L)各1 μL,Taq PCR Master Mix 12.5 μL,ddH2O 9.5 μL。PCR条件:94℃预变性4 min;94℃变性30 s,58℃退火40 s,72℃延伸1 min,30个循环。扩增产物经琼脂糖凝胶电泳分离纯化后连接pMD18-T载体,重组载体转化大肠杆菌EscherichiacoliDH5α宿主菌。PCR筛选阳性克隆后,测序验证。
1.3 家蝇Mdogg1的生物信息学分析
使用ExPASy-Protparam (https:∥web.expasy.org/protparam/)预测蛋白质的理化性质;使用NCBI-CDD (https:∥www.ncbi.nlm.nih.gov/cdd/)和SMART (http:∥smart.embl-heidelberg.de)数据库分析蛋白质保守结构域;利用NCBI数据库中BLASTp程序分析蛋白质序列相似性,使用Clustal W (http:∥www.clustal.org/clustal2/) 软件进行多重比对,并利用MEGA软件(http:∥www.megasoftware.net/)构建分子系统进化树,然后使用ITOL网站(https:∥itol.embl.de/tree/)进行作图分析。
1.4 家蝇不同发育阶段和幼虫组织中Mdogg1的表达水平分析
取家蝇卵、1龄和2龄幼虫各15头以及3龄幼虫、蛹和成虫各3头为一个生物学重复,设置3个生物学重复。收集120头家蝇3龄幼虫血细胞以及5头3龄幼虫肌肉、肠道和脂肪体为一个生物学重复,设置3个生物学重复。采用1.2的方法合成cDNA,根据家蝇Mdogg1基因序列设计qRT-PCR定量引物Ogg-F2(5′-TCAACAAAACTAAAGGCGG-3′)和Ogg-R2(5′-AAGGACTCAAGGGACGGAA-3′),检测Mdogg1在家蝇不同发育时期和3龄幼虫不同组织中的表达量。以家蝇组成型表达的β-actin基因作为内参基因,其正向引物actin-F(5′-GAGAAATCCTATGAA CTTCCCGACG-3′)和反向引物actin-R(5′-GGATA CCGCAAGATTCCATACCCAA-3′)。qRT-PCR反应体系(25 μL):cDNA(300 ng/μL) 2.5 μL,正反向引物(10 mmol/L)各1.25 μL,2×SYBR Premix Ex Taq 12.5 μL,ddH2O 7.5 μL。qRT-PCR反应条件:95℃预变性1 min;95℃变性20 s,60℃退火10 s,40次循环。目的基因相对定量用公式2-ΔΔCT计算(Livak and Schmittgen,2001)。
1.5 胁迫刺激后家蝇Mdogg1的表达水平分析
参照Tang等(2019)描述的方法,选取2.5,5,10,20,40,60,80和100 mmol/L的CdCl2水溶液替代家蝇幼虫培养基中的水与麸皮混匀,投喂2龄家蝇幼虫进行持续胁迫处理24 h,以未经CdCl2处理的家蝇2龄幼虫为对照组,对照组和实验组均设置3组平行实验,每组处理30头家蝇幼虫,取样检测Mdogg1表达水平,同时使用基于酶联免疫吸附法的8-羟基鸟嘌呤DNA糖苷酶检测试剂盒(上海羽朵生物技术有限公司,产品编号001)测定8-羟基鸟嘌呤含量。根据本实验室前期研究结果(Fengetal.,2020),使用0.1 g/L的盐酸阿霉素(doxorubicin hydrochloride,DOX)溶液浸泡30头家蝇2龄幼虫30 min,然后恢复培养6,12和24 h后检测Mdogg1基因的表达水平,以未经DOX处理的家蝇2龄幼虫为对照组。将30头家蝇2龄幼虫置于紫外灯(波长280~315 nm,强度5 J/cm2)下分别照射5,10,20和30 min进行紫外线(ultraviolet,UV)胁迫,然后取样检测Mdogg1基因的表达水平,以未经紫外线处理的家蝇2龄幼虫为对照组。上述胁迫刺激实验的生物学重复和技术重复均为3次,利用qRT-PCR分析各实验组与对照组中家蝇幼虫Mdogg1基因表达情况,qRT-PCR的反应体系与条件与1.4节中相同。
1.6 RNAi干扰Mdogg1后家蝇体内Mdogg1表达水平和氧化还原指标测定
按照顾冀海等(2017)报道的方法,制备Mdogg1基因dsRNA,首先根据Mdogg1序列信息设计干扰引物dsOgg-F(5′-CCCAAGCTTAGAGGAAGC AACGATGCCAAT-3′)和dsOgg-R(5′-CCGCTCGAG ACTCAAGGGACGGAAATGTGT-3′),以1.2节合成的家蝇2 龄幼虫cDNA为模板进行PCR扩增,PCR反应体系和反应条件与方法1.2节相同。将获得的扩增产物经切胶回收、酶切后连接L4440载体,转化大肠杆菌DH5α感受态细胞,挑选阳性克隆并测序验证,得到L4440-Mdogg1干扰载体,提取质粒转化大肠杆菌HT115感受态细胞,诱导dsRNA表达,纯化dsRNA并测定其浓度。同时设计绿色荧光蛋白(green fluorescent protein,GFP) dsRNA引物dsGFP-F(5′-CCGGAATTCATGGTGAGCAAGGGCGAGGA-3′)和dsGFP-R(5′-CCGCTCGAGTTACTTGTACAGCTCG TCCATG-3′),以dsGFP作为对照。通过显微注射分别将0.5 ng dsMdogg1和dsGFP注射到家蝇2龄幼虫体内。
将RNAi处理24 h的家蝇2龄幼虫取样。各实验组与对照组中家蝇幼虫Mdogg1基因表达水平的检测方法、qRT-PCR的反应体系和条件与1.4节中描述相同。并且,按照Zhang等(2020)描述的方法提取家蝇2龄幼虫总蛋白,采用Bradford法(Bradford,1976)测定蛋白浓度。使用丙二醛(malondialdehyde,MDA)检测试剂盒(南京建城生物工程研究所,货号A003-1-2)测定MDA含量,使用活性氧检测试剂盒(上海碧云天生物技术有限公司,产品编号S0033)测定ROS水平,使用总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(南京建城生物工程研究所,产品编号A001-3-2)测定SOD活性,使用基于酶联免疫吸附法的8-羟基鸟嘌呤DNA糖苷酶检测试剂盒(上海羽朵生物技术有限公司,产品编号001)测定8-羟基鸟嘌呤含量。各生化指标测定实验的生物学重复和技术重复均为3次,每个生物学重复使用15头家蝇2龄幼虫。
1.7 数据分析
所有数据分析使用Excel和SPSS 20.0软件程序进行,数据结果均以平均值±标准差表示。实验组超过2组时,使用one-way ANOVA方法进行分析处理,并运用Turkey氏显著性检测方法进行多重比较;2组实验数据分析时,使用Student氏t检验进行检验分析。
2 结果
2.1 Mdogg1基因的克隆与序列分析
克隆得到家蝇Mdogg1基因序列(GenBank登录号:AYK27449.1),cDNA长1 062 bp,编码353个氨基酸残基,该蛋白的理论分子量和等电点分别为41.08 kD和9.02。MdOGG1与4种模式生物(人Homosapiens,小鼠Musmusculus,黑腹果蝇Drosophilamelanogaster,斑马鱼Daniorerio)OGG1氨基酸序列一致性分别为38.41%,38.72%,49.02%和36.08%。保守结构域分析显示(图1),尽管MdOGG1与其他模式生物的OGG1蛋白质的氨基酸序列相似性不高,但5种OGG1二级结构保守,分子中均含有螺旋-发夹-螺旋(Helix-hairpin-Helix,HhH)基序和核酸内切酶Ⅲ(endonuclease III)保守结构域ENDO3c。从GenBank数据库中选取膜翅目、鳞翅目、半翅目、鞘翅目和双翅目昆虫OGG1氨基酸序列进行分子进化分析,结果表明这些OGG1家族成员严格地聚为5个类群(图2),与物种的进化关系高度吻合。

图1 家蝇与几种模式生物的OGG1氨基酸序列比对Fig.1 Alignment of amino acid sequences of OGG1 from Musca domestica and other model species蛋白质来源物种及GenBank登录号Origin species of proteins and their GenBank accession numbers:MdOGG1:家蝇Musca domestica,AYK27449.1;HsOGG1:人Homo sapiens,NP_001341580.1;MmOGG1:小鼠Mus musculus,NP_035087.3;DmOGG1:黑腹果蝇Drosophila melanogaster,NP_572499.2;DrOGG1:斑马鱼Danio rerio,NP_001116780.1.HhH基序在框中标出,下划线标识的字母是ENDO3c结构域。Sequence of the HhH motif is marked in the box,and the ENDO3c domain is marked with underline.
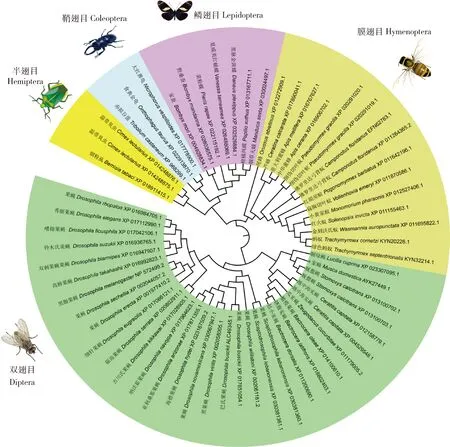
图2 邻接法构建的基于氨基酸序列的OGG1系统进化树(1 000次重复)Fig.2 Phylogenetic tree of OGG1 constructed by using neighbor-joining method based on amino acid sequences (1 000 replicates)
2.2 Mdogg1在家蝇不同发育阶段和3龄幼虫组织中的表达
qRT-PCR结果显示(图3),Mdogg1在家蝇卵中表达量最高,达到其他发育阶段的10倍以上(P<0.05)。Mdogg1基因在家蝇1龄幼虫到成蝇的发育过程中表达量呈现逐步上升趋势,蛹和成虫阶段显著高于幼虫阶段(P<0.05)。对家蝇3龄幼虫不同组织中Mdogg1的表达量分析显示,Mdogg1在脂肪体中表达量最高,血细胞、肌肉和肠道中表达量显著较低(P<0.05)。
2.3 胁迫刺激后家蝇2龄幼虫中Mdogg1的表达水平及8-羟基鸟嘌呤含量变化
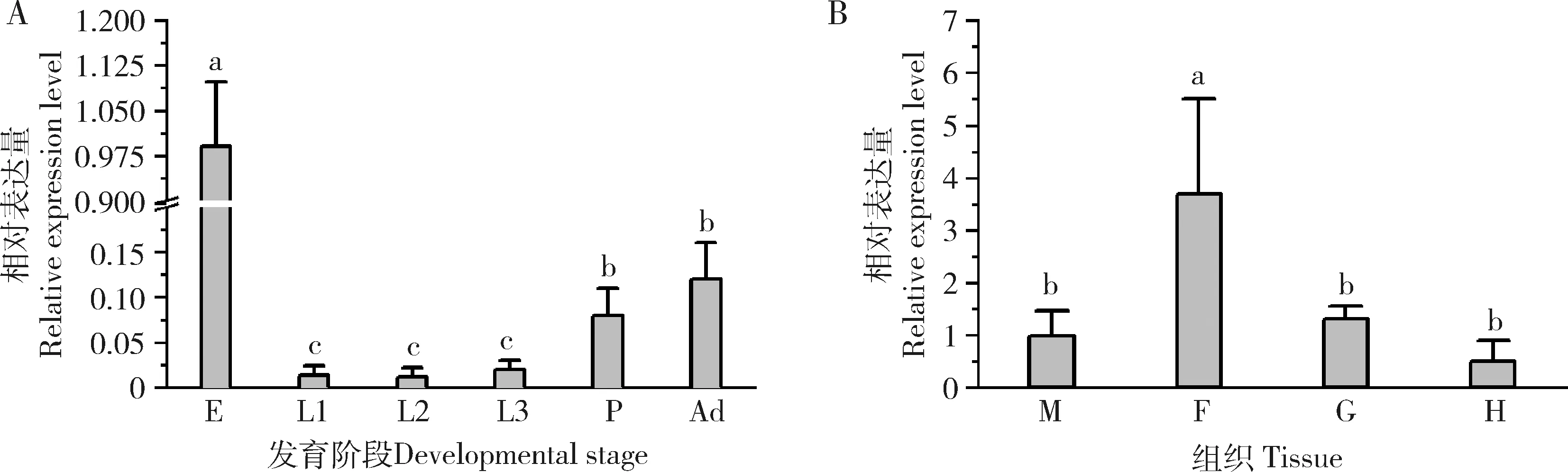
图3 Mdogg1在家蝇不同发育阶段(A)和3龄幼虫组织(B)中的相对表达量Fig.3 Relative expression levels of Mdogg1 in different developmental stages (A) and tissues of the 3rd instar larvae (B) of Musca domesticaE:卵Egg;L1-3:分别为1-3龄幼虫1st-3rd instar larva,respectively;P:蛹Pupa;Ad:成虫Adult;M:肌肉Muscle;F:脂肪体Fat body;G:肠道Gut;H:血细胞Hemocyte.不同发育时期的基因表达量使用卵的表达量进行均一化处理;不同组织中的表达量使用肌肉中的表达量进行均一化处理。图中数据为平均值±标准差;柱上不同字母表示不同发育阶段或组织间基因表达量存在显著性差异(P<0.05,one-way ANOVA,Turkey氏多重比较)。The expression levels of Mdogg1 in different developmental stages were normalized to that in the egg.The expression levels of Mdogg1 in different tissues were normalized to that in the muscles.Data in the figure are mean±SD.Different letters above bars indicate significant differences in the expression level between different developmental stages and tissues (P<0.05,one-way ANOVA,Turkey’s multiple comparison).
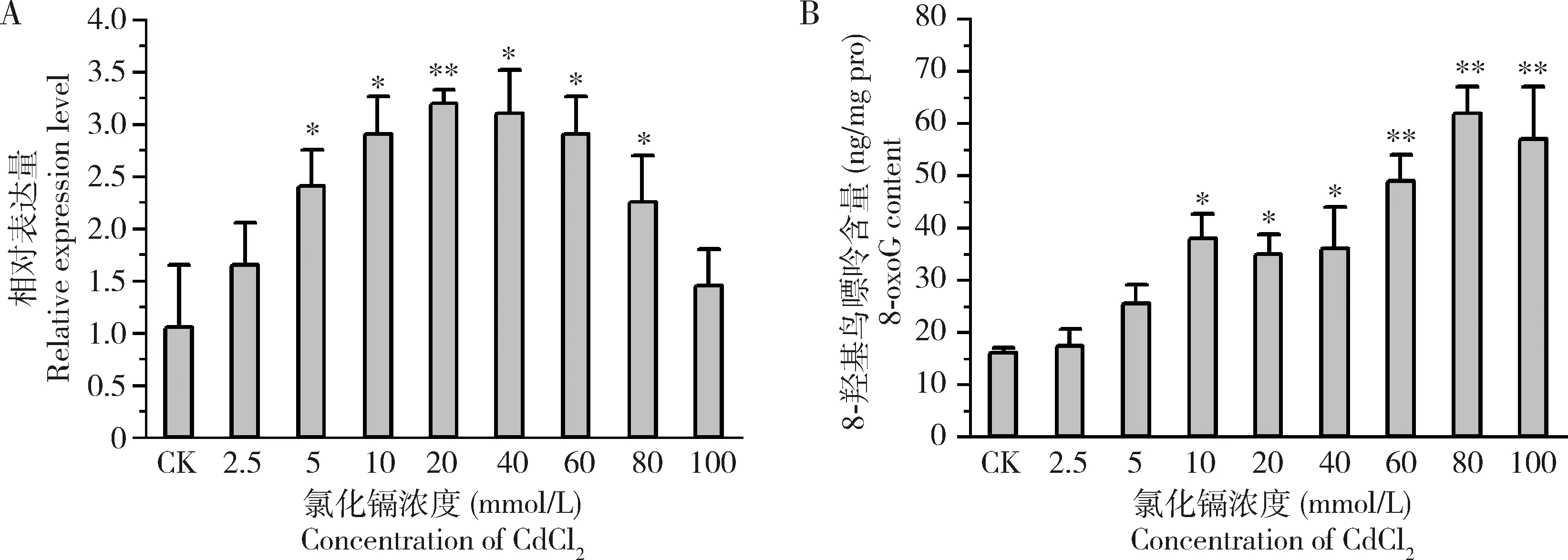
图4 CdCl2胁迫24 h后家蝇2龄幼虫体内的Mdogg1表达量(A)和8-羟基鸟嘌呤含量(B)Fig.4 Expression levels of Mdogg1 (A) and 8-oxoG contents (B) in the 2nd instar larvae of Musca domestica after exposure to CdCl2 for 24 hCK:H2O.图中数据为平均值±标准差;柱上星号和双星号分别表示与对照组相比差异显著(P<0.05)和差异极显著(P<0.01)(Student氏t检验)。Data in the figure are mean±SD.Asterisk and double asterisk above bars denote significant difference (P<0.05) and extremely significant difference (P<0.01) (Student’s t-test),respectively,from the control group.图5-6同The same for Figs.5 and 6.
如图4(A)所示,在2.5~100 mmol/L CdCl2胁迫下,家蝇2龄幼虫Mdogg1基因表达量随着CdCl2浓度的升高呈现先上升再下降的趋势。当CdCl2浓度为20 mmol/L时,Mdogg1基因的表达量达到最大。当CdCl2浓度从20 mmol/L提高到100 mmol/L,Mdogg1基因的表达量出现逐步回落的现象,但其表达量均显著高于对照组(P<0.05)。同时,家蝇幼虫体内DNA损伤标志物8-羟基鸟嘌呤含量随着CdCl2浓度的提高逐渐增加,尤其是当CdCl2浓度超过10 mmol/L时,8-羟基鸟嘌呤含量上升更为迅速,显著高于对照组(P<0.05)(图4:B)。
家蝇2龄幼虫浸泡于0.1 g/L DOX 30 min,并恢复培养12和24 h后Mdogg1的表达量较未处理对照显著升高(P<0.05) (图5:A)。家蝇幼虫中Mdogg1的表达量随着UV处理时间的延长而升高(图5:B),其中,紫外线照射30 min时Mdogg1表达量较未处理对照呈现极显著增高(P<0.01)。
2.4 敲低Mdogg1对家蝇2龄幼虫体内氧化还原状态的影响
dsMdogg1注射家蝇 2龄幼虫处理24 h后,实验组家蝇幼虫中Mdogg1的表达量显著低于注射dsGFP的对照组(P<0.05) (图6:A)。Mdogg1敲低表达后,家蝇幼虫中DNA损伤标志物8-羟基鸟嘌呤含量较对照组显著增高(P<0.05) (图6:B),氧化应激标志物ROS水平和MDA含量显著升高(P<0.05)(图6:C,D)。同时,家蝇幼虫体内SOD酶活性极显著降低(P<0.01) (图6:E)。结果说明,Mdogg1基因表达水平敲低后,家蝇幼虫体内氧化还原水平失衡,发生氧化损伤。
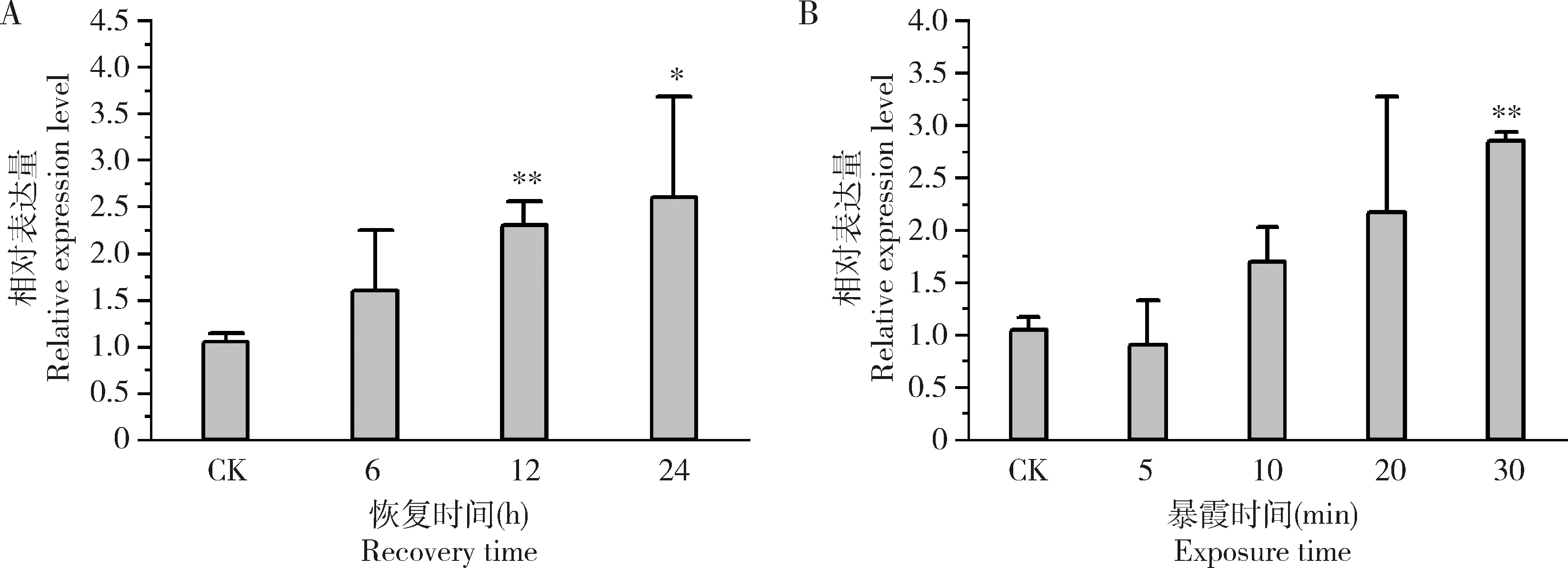
图5 家蝇2龄幼虫受到盐酸阿霉素(A)和紫外线(B)胁迫处理后Mdogg1的表达量Fig.5 Expression levels of Mdogg1 in the 2nd instar larvae of Musca domestica after exposed to doxorubicin hydrochloride (A) and ultraviolet (B)CK:未经任何处理的对照组Control group without treatment.2龄幼虫浸泡于0.1 g/L DOX溶液中30 min并恢复6,12和24 h后,或在280-315 nm紫外线(强度5 J/cm2)下分别照射5,10,20和30 min后检测基因表达量。The gene expression level was detected after the 2nd instar larvae were soaked in 0.1 g/L DOX solution for 30 min and then recovered for 6,12 and 24 h,or exposed to UV (280-315 nm) at the dose of 5 J/cm2 for 5,10,20 and 30 min,respectively.
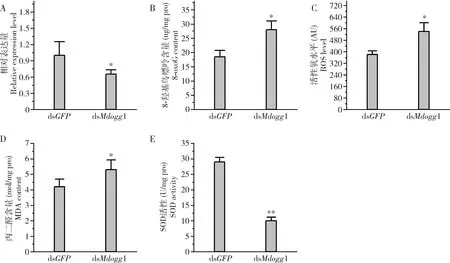
图6 敲低Mdogg1表达对家蝇2龄幼虫体内氧化应激的影响Fig.6 Effect of knock-down of Mdogg1 on the oxidative stress in the 2nd instar larvae of Musca domesticaA:Mdogg1基因相对表达量Relative expression level of Mdogg1;B:8-羟基鸟嘌呤含量8-oxoG content;C:活性氧水平ROS level;D:丙二醛含量MDA content;E:SOD活性SOD activity.注射dsGFP为对照组。Injection with dsGFP as the control group.
3 讨论
DNA损伤修复是生物体生长发育过程中的重要事件,修复基因的表达紊乱可导致多种代谢疾病的发生。ogg1基因在哺乳动物中的功能已经得到充分关注,然而昆虫中该基因的功能研究相对较少。本研究对家蝇Mdogg1基因进行了克隆与生物信息学分析。MdOGG1蛋白结构中含有与DNA结合相关的HhH结构域,还具有核酸内切酶Ⅲ保守结构域(ENDO3c)(图1),这2个结构域是MdOGG1发挥核酸内切酶功能的结构基础,也是具有DNA糖基化酶/AP裂解酶活性的修复蛋白的共同结构特征(Kimetal.,2012)。对MdOGG1与几种模式生物OGG1的氨基酸序列分析显示,HhH和ENDO3c结构域在不同物种间均存在,这说明OGG1在不同物种间结构保守。选择昆虫中OGG1同源蛋白氨基酸序列,分析OGG1在不同物种间聚类分析,结果显示昆虫的OGG1家族成员聚类方式与系统分类地位严格一致(图2),说明OGG1在物种间保守而重要。
在不同生长发育阶段中,家蝇卵中的Mdogg1的表达量最高(图3:A)。卵中细胞发育分化最为迅速,我们推测Mdogg1基因具有调控生长发育和能量代谢的作用。有报道称蜜蜂中ogg1基因在个体发育过程中均呈现稳定表达状态,该基因对于维持西方蜜蜂Apismellifera线粒体功能十分重要(Aamodt,2009)。人体ogg1基因在胚胎组织和睾丸组织中显著高表达,具有维持遗传物质稳定和参与胚胎发育的重要作用(Audebertetal.,2002)。脂肪体是家蝇中重要的代谢调控中枢和免疫调节器官(Wangetal.,2020)。本研究显示,Mdogg1基因在家蝇幼虫脂肪体中表达量最高(图3:B),暗示该基因具有参与机体能量代谢和免疫调控的功能。对生物体进行外源胁迫因子处理,引发机体氧化应激,可以触发体内氧化还原基因的表达变化,这是研究基因功能的有效手段(Kimetal.,2011;Wonetal.,2012;Tangetal.,2019)。因此,我们进一步对家蝇分别进行CdCl2、DOX和UV胁迫处理,研究Mdogg1基因的表达变化规律。
镉能够引起细胞内金属离子失衡,破坏含有金属离子的蛋白质结构和活性,导致机体发生氧化损伤(Kumar and Sharma,2019)。本研究显示,CdCl2处理导致家蝇幼虫中8-羟基鸟嘌呤含量出现显著上升现象(图4:B),且与CdCl2暴露剂量呈现典型的浓度依赖效应。值得指出的是,2.5-20 mmol/L浓度范围内CdCl2刺激会逐渐上调家蝇幼虫Mdogg1基因转录(图4:A)。我们推测Mdogg1在抗逆过程中表达量升高与是其响应细胞内氧化水平的直接体现,即机体通过调高Mdogg1基因转录表达,修复受损伤的DNA,并发挥维持家蝇体内氧化还原平衡状态的作用。DOX是一种对包括白血病在内的多种恶性肿瘤具有抑制作用的蒽环类药物,该药物发挥作用过程中会诱发机体产生氧化应激(Mortonetal.,2019)。紫外线辐射可引发人和动物皮肤光老化,造成DNA、脂质产生明显的氧化应激损伤(Cadet and Wagner,2013)。我们实验室前期研究显示,0.1 g/L的DOX处理家蝇2龄幼虫30 min后,会诱导其发生氧化应激反应(Tangetal.,2019;Fengetal.,2020);并且,5 J/cm2的紫外线照射也会引发家蝇2龄幼虫体内MDA和ROS水平显著增加(蔺冬冬等,2019)。本研究表明,Mdogg1基因转录水平也会受到相同剂量DOX和紫外线的胁迫处理而上调(图5),这说明该基因具有响应家蝇体内氧化应激水平的功能。
ogg1基因功能在人和哺乳动物中的研究较为深入。例如,溃疡性结肠炎患者体内ogg1表达水平与氧化应激水平呈现正相关(Kumagaeetal.,2018)。Kim等(2016)发现,内毒素诱导小鼠Musmusculus发生炎症反应后,与氧化应激信号通路密切相关的信号分子STAT1(signal transducer and activator of transcription 1)会结合到ogg1基因启动子区域以调控该基因转录表达。并且,当细胞受到严重的氧化胁迫时,OGG1会与受损DNA结合形成中间物,进而激活DNA损伤信号物PARP1[poly(ADP-ribose) polymerase 1]的活性,从而启动受损细胞凋亡途径,以保护机体免于更为严重的损害(Wangetal.,2018)。近些年,ogg1基因在无脊椎动物中的研究也开始获得关注。Kim等(2012)使用紫外线和重金属处理剑水溞Tigriopusjaponicus,发现ogg1基因表达呈现先上升再下降的趋势,推测该基因具有保护机体免于环境污染物损伤的作用。Alaraby等(2017)等使用重铬酸钾饲喂黑腹果蝇,发现ogg1基因表达发生下调;他们进一步对黑腹果蝇饲喂纳米氧化铜颗粒(一种抗肿瘤潜在药物),ogg1基因又呈现上调表达趋势。另一项黑腹果蝇相关研究显示,20 mmol/L百草枯处理12 h可引发线粒体功能损伤和黑腹果蝇OGG1酶活性下降(Sandersetal.,2017)。Yasukawa等(2015)研究也显示10 mmol/L百草枯处理的黑腹果蝇会抑制ogg1基因表达,并伴随8-羟基鸟嘌呤水平的显著上升。
本研究显示,家蝇Mdogg1表达水平与CdCl2处理剂量密切相关,并伴随家蝇中DNA氧化损伤产物8-羟基鸟嘌呤水平持续增加(图4)。我们分析,低剂量的胁迫剂量会激发Mdogg1基因表达,以修复体内DNA损伤;随着处理剂量的增大,机体的抗氧化系统崩溃,Mdogg1会发生下调表达趋势。据此,我们认为Mdogg1基因具有维持家蝇体内氧化还原平衡的作用。为了验证该推测,我们使用RNAi技术敲低家蝇幼虫中Mdogg1表达。我们进行RNAi干扰实验时,首先验证了dsRNA注射家蝇幼虫后4个时间点(6,12,24和48 h)的Mdogg1表达量变化,结果显示Mdogg1的表达量在RNAi干扰24 h和48 h时均发生显著降低(数据未呈现),且24 h时干扰效果最好(图6:A)。因此,本研究随后针对干扰24 h后的家蝇幼虫进行体内氧化还原指标测定,我们发现,家蝇幼虫不仅表现出ROS水平升高,而且8-羟基鸟嘌呤和MDA的含量均出现显著上升,伴随SOD活性显著降低(图6:B~E)。细胞内氧化失衡会导致ROS暴发,并攻击细胞膜上不饱和脂肪酸的双键,导致脂质过氧化损伤而积累MDA。因此,细胞中ROS和MDA水平升高是机体发生氧化应激反应的标志。本研究对Mdogg1基因的敲低表达后,家蝇幼虫体内发生氧化还原平衡紊乱。基于此,我们认为Mdogg1具有维持细胞内氧化还原平衡的功能。再结合Mdogg1对于CdCl2、DOX和UV胁迫处理的转录响应结果,我们认为该基因直接参与了家蝇氧化还原平衡的调控,具有保护机体抵抗氧化损伤的生物学效应。最新研究显示,ogg1不仅具有DNA修复功能,还可以调控多种细胞代谢通路,维持机体代谢平衡。例如,Simon等(2020)发现,ogg1基因敲除的小鼠会易发生肠道炎症和肥胖,并导致肠道微生物菌群变化;ogg1基因敲除的小鼠受到缺氧胁迫处理后,其脑和肺部组织中多种与炎症调控的基因发生表达紊乱(Rognlienetal.,2018)。在本研究中,我们通过外源刺激物胁迫处理和RNAi技术研究了Mdogg1的生理功能,发现该基因具有维持家蝇体内氧化还原平衡的作用。当然,Mdogg1发挥调控作用的分子机制还需要在后续工作中深入研究。
