家蚕抗真菌因子BmSPI39对球孢白僵菌入侵的表达响应
2021-03-10李游山路庆君罗竹星夏庆友
李游山,路庆君,杨 玺,张 杰,罗竹星,夏庆友,赵 萍,*
(1.陕西理工大学生物科学与工程学院,陕西汉中 723001;2.陕西理工大学,陕南秦巴山区生物资源综合开发协同创新中心,陕西汉中 723001;3.西南大学前沿交叉学科研究院,生物学研究中心,重庆 400715)
家蚕Bombyxmori是一种具有重要价值的绢丝昆虫,也是鳞翅目昆虫的典型代表,具有深厚的基础研究积淀。有研究报道,真菌等病原物在入侵宿主过程中会产生丰富的胞外蛋白酶,这些蛋白酶在病原物入侵中发挥着关键作用(St Leger,1995;Travisetal.,1995)。体壁降解蛋白酶是致病性真菌重要的毒力因子,通常在孢子萌发时分泌于宿主体壁,参与宿主表皮的穿透过程(St Leger,1995;Charnley,2003)。过表达这些毒力蛋白酶可以显著增强致病性真菌的毒力(St Legeretal.,1996;Yangetal.,2005,2011;Zhangetal.,2008)。
尽管昆虫体内没有类似于哺乳动物的淋巴细胞、免疫球蛋白和完整的补体系统,但是昆虫在长期进化过程中形成了复杂的天然免疫系统,其中丝氨酸蛋白酶抑制剂就是在昆虫免疫中发挥着重要作用。蛋白酶抑制剂可通过调节内源蛋白酶活性参与昆虫凝血、酚氧化酶激活或细胞因子激活等过程(Kanost,1999;Cereniusetal.,2010;Fullaondoetal.,2011)。昆虫还会响应表达高丰度的蛋白酶抑制剂,用于抑制微生物侵入宿主的毒力蛋白酶的活性,以应对病原微生物的入侵(Fröbiusetal.,2000;Vilcinskas,2010;Lietal.,2016b)。笔者前期的研究对免疫相关的家蚕蛋白酶抑制剂进行了系统鉴定,发现多个TIL(trypsin inhibitor-like cysteine-rich domain)家族蛋白酶抑制剂在微生物添食感染家蚕后上调表达,暗示这些蛋白酶抑制剂可能参与家蚕的免疫过程(Zhaoetal.,2012)。在已发现的这些TIL家族蛋白酶抑制剂中,BmSPI38和BmSPI39不仅能够抑制球孢白僵菌产生的体壁降解蛋白酶CDEP-1活性,还可以抑制CDEP-1诱导的有害黑化和白僵菌的分生孢子萌发,从而增强家蚕的抗真菌能力(Lietal.,2012,2015)。另有研究显示,以BmSPI39为代表的TIL类蛋白酶抑制剂能够随家蚕泌丝过程进入茧层中,并通过抑制病原微生物分泌的毒力蛋白酶活性为茧内的蛹提供保护(Dongetal.,2013;Zhangetal.,2015;Guoetal.,2016;Lietal.,2016b)。家蚕是由野生桑蚕驯化而来,经过长期的驯化和选育,家蚕茧的重量已达到野生蚕茧的10倍以上。定量蛋白质组学研究结果表明,在野生蚕茧中,包括TIL家族蛋白酶抑制剂BmSPI39在内的众多蛋白酶抑制剂的表达量都显著高于家蚕茧(Daietal.,2019)。野生桑蚕、家蚕的丝腺组织的定量PCR和转录组数据进一步验证了这一结果。进一步研究证实野生蚕茧中的微生物蛋白酶抑制剂活性明显强于家蚕茧,暗示野生蚕茧中高丰度的蛋白酶抑制剂可能在抵御病原物入侵中发挥着保护作用,推测与其生活的较为恶劣的自然环境有关(Daietal.,2019)。
蛹是从幼虫到成虫的变态过渡阶段,也是蚕生命周期中最脆弱的阶段,基本上不能对威胁作出反应。迄今为止,人们对昆虫先天性免疫进行了广泛的研究,但对蛹期昆虫应对病原物感染的基本策略知之甚少。受限于蛋白检测手段,人们对抗真菌因子BmSPI39在家蚕体内生理功能和作用机制的认识还十分有限。蛹期家蚕体壁中BmSP39的表达能否响应球孢白僵菌Beauveriabassiana入侵过程尚不清楚。因此,获得廉价、高效、特异的BmSP39抗体对研究家蚕TIL家族蛋白酶抑制剂体内功能尤为重要。本研究拟制备兔抗家蚕BmSPI39的多克隆抗体,并对球孢白僵菌诱导下的游走期之后家蚕体壁中的BmSPI39的表达特征进行分析,对深入研究BmSPI39在家蚕体内的生理功能和深化对家蚕蛹期抗真菌机制的认识有重要意义。
1 材料与方法
1.1 供试生物和抗体
供试家蚕“大造”品系、球孢白僵菌B.bassianaBb1菌株和重组表达载体BmSPI39-p28均由西南大学家蚕基因组生物学国家重点实验室提供。在自然光照周期下以新鲜桑叶饲养家蚕,饲养温度为25℃,相对湿度为75%±5%。成年新西兰雄兔购自重庆辛创生物技术有限公司。小鼠抗α-tubulin抗体、HRP标记山羊抗兔IgG(H+L)、HRP标记山羊抗小鼠IgG(H+L)均购自碧云天公司。
1.2 BmSPI39的诱导表达和纯化
BmSPI39蛋白的表达与纯化可参照笔者先期报道的方法(Lietal.,2015),略有调整。将构建好的重组表达载体BmSPI39-p28转化入大肠杆菌EscherichiacoliBL21(DE3)感受态细胞中,待OD600=0.6~1.0时,加入IPTG至终浓度为0.2 mmol/L,在37℃下继续培养5 h。融合表达的BmSPI39的蛋白N末端连有一个的多聚组氨酸标签(MGHHHHHHM)。收集菌体,用结合缓冲液(20 mmol/L Tris-HCl,500 mmol/L NaCl,pH 7.9)重悬菌体,超声波破碎后,4℃ 16 000×g离心30 min,分别收集上清和沉淀部分。利用Ni2+-NTA亲和层析柱(Merck)纯化BmSPI39重组蛋白。最后将纯化后的BmSPI39重组蛋白透析至0.9% NaCl溶液中,用作免疫用抗原蛋白。
1.3 BmSPI39重组蛋白胶内蛋白酶抑制剂活性染色检测
将1.2节诱导表达的蛋白样品与4×Native PAGE加样缓冲液(40 mmol/L Tris-HCl,40%甘油,0.032%溴酚蓝,pH 8.0)混合,并利用10% Native PAGE(pH 8.3)对纯化前后不同稀释度的蛋白样品进行分离。另外,将蛋白样品与不含还原剂的SDS-PAGE上样缓冲液混匀后,不进行加热处理,直接利用15% SDS-PAGE进行分离。蛋白样品经10% Native PAGE(pH 8.3)或非还原SDS-PAGE分离后,参照笔者先前报道的方法(Lietal.,2012b)进行胶内活性染色。将电泳后蛋白胶置于0.07%的枯草杆菌Bacillussubtilis蛋白酶A溶液(0.1 mol/L Tris-HCl,10 mmol/L CaCl2,pH 7.5)中,37℃避光条件下,45 r/min振荡孵育15 min。回收蛋白酶溶液,并利用ddH2O清洗胶2次,每次10 s,然后37℃条件下静置15 min。按照1∶10的体积比加入底物[20 mg N-乙酰基-D,L-苯丙氨酸-β-萘酯(N-acetyl-D,L-phenylalanine-β-naphthylester,APNE)溶于10 mL N,N′-二甲基甲酰胺(N,N′-dimethylformamide)]和染色液[100 mg固蓝B盐(Fast Blue B Salt)溶于100 mL 0.1 mol/L pH 8.0的Tris-HCl缓冲液]的混合溶液,37℃ 45 r/min条件下避光孵育20 min。最后,弃除染色液,加入ddH2O清洗胶面以终止反应。染色原理如下:凝胶上的蛋白酶可分解生色底物APNE,生成的β-萘酚通过重氮偶合反应将胶染成紫红色。胶内蛋白酶抑制剂若能抑制相应的蛋白酶活性,其所在位置将不会被染色,而呈现为白色条带。
1.4 BmSPI39的多克隆抗体制备
购买的新西兰大白兔在本实验室动物房中饲养1周后,通过耳动脉采集少量免疫前血液,室温静置1 h,然后置于4℃过夜,4℃ 4 000 r/min离心10 min分离血清,用作阴性对照。将1.2节纯化的1 mg BmSPI39重组蛋白与弗氏完全佐剂(BBI)等体积充分混匀乳化,背部皮下多点免疫大白兔。间隔2周后,将500 μg BmSPI39重组蛋白与弗氏不完全佐剂(BBI)等体积混匀乳化后,加强免疫大白兔。10 d之后,再加强免疫一次。7 d之后,从耳缘静脉采集少量血液,分离血清,检测抗血清效价。待抗血清效价达到预期水平时,经心脏采血,分离血清,置于-80℃冰箱保存。
采用间接ELISA法对His6-BmSPI39的抗血清进行测定。利用包被液(0.15% Na2CO3,0.293% NaHCO3,pH 9.6)将抗原His6-BmSPI39稀释至5 ng/mL,以100 μL/孔加入酶标板中,4℃包被过夜。经PBST液[0.8% NaCl,0.02% KH2PO4,0.29% Na2HPO4·12H2O,0.02% KCl,0.05%(v/v)Tween-20]洗涤3次后,加入350 μL 1%脱脂奶粉,于37℃封闭2 h。PBST洗涤3次后,加入100 μL倍比稀释(1∶1 000,1∶2 000,1∶4 000,1∶8 000,1∶16 000,1∶32 000,1∶64 000,1∶128 000)的免疫血清及免疫前血清,37℃孵育1 h,每个浓度设置3个重复。接着,依次进行洗涤、HRP标记的二抗中37℃孵育1 h(1∶2 000,100 μL/孔)、洗涤、TMB显色液中室温显色15 min(100 μL/孔),最后加入100 μL 2 mol/L H2SO4终止反应。采用BioTek Epoch全波长酶标仪测定492 nm的吸光值,评估抗体效价。
1.5 BmSPI39的多克隆抗体的纯化
依次利用硫酸铵分级沉淀法和HiTrap rProtein A亲和层析柱(GE Healthcare)对1.4节制备的BmSPI39多克隆抗体进行纯化。取10 mL血清,加入等体积的0.9% NaCl溶液,再逐滴加入5 mL饱和(NH4)2SO4溶液,使之成为20%的(NH4)2SO4溶液,室温静置30 min。3 000 r/min离心20 min,弃去沉淀后,逐滴加入15 mL饱和(NH4)2SO4溶液,使之成为50% (NH4)2SO4溶液,室温静置30 min。离心,弃上清。利用10 mL 0.9% NaCl溶液重新溶解沉淀后,逐滴加入5 mL饱和(NH4)2SO4溶液,使之成为33%的(NH4)2SO4溶液,室温静置30 min,离心弃上清,重复此步骤3次。然后,加入5 mL 0.02 mol/L PBS(pH 7.4)重新溶解沉淀,于4℃ PBS(0.02 mol/L,pH 7.4)中透析24 h,每8 h更换一次缓冲液。用PBS平衡HiTrap rProtein A亲和层析柱后,取5 mL透析后的多克隆抗体上样,待PBS漂洗至基线平稳后,采用0.1 mol/L柠檬酸三钠溶液(pH 3.5)进行洗脱,并于每毫升洗脱液中加入100 μL 1 mol/L Tris-HCl(pH 9.0)以中和pH值,置于-80℃保存。最后,利用15%的SDS-PAGE和硝酸银染色对纯化后的多克隆抗体进行检测。
1.6 基于转录组数据的BmSPI39的时空表达分析
前期研究显示,重组BmSPI39能够抑制球孢白僵菌的孢子萌发,体表浸润法包被BmSPI39蛋白能够显著提高家蚕的抗白僵菌能力(Lietal.,2015)。为了分析BmSPI39在家蚕免疫相关的组织和器官中的时空表达情况,由家蚕开放性数据库SilkDB 3.0(Luetal.,2020),获取BmSPI39(Gene ID:BMSK0001557)在4龄第3天至化蛹后1 d家蚕的体壁、中肠和脂肪体中表达数据,并利用Heml1.0软件进行热图分析。
1.7 球孢白僵菌体表接触接种家蚕
球孢白僵菌体表接触接种家蚕按照笔者前期报道的方法(李游山等,2018)进行。首先,利用灭菌ddH2O配制2×106孢子/mL和2×107孢子/mL的球孢白僵菌分生孢子悬液。然后,将单层无菌纱布包裹的游走期(即家蚕“熟蚕”期)家蚕幼虫于不同浓度的孢子悬液中浸泡10 s,取出置于塑料盒中的无菌簇具上,于28℃感染家蚕幼虫体表。就“大造”品系而言,在正常饲养条件下,游走期一般为1~2 d,上蔟吐丝结束进入预蛹,再经1~2 d左右蛹皮形成,进入蛹期。ddH2O处理组作为空白对照。收集接种球孢白僵菌后36 h(吐丝期),60 h(预蛹期),84 h(化蛹后1 d),108 h(化蛹后2 d)和120 h(化蛹后3 d)的家蚕体壁,液氮中速冻后,置于-80℃保存,用于进一步研究家蚕幼虫在上蔟吐丝至化蛹阶段BmSPI39蛋白是否在体壁中表达,其表达能否响应球孢白僵菌入侵。
1.8 Western blot球孢白僵菌侵染后家蚕体壁中BmSPI39的表达
为了进一步研究在上蔟吐丝至化蛹阶段BmSPI39蛋白是否在家蚕体壁中表达,其表达能否响应球孢白僵菌入侵,利用不同浓度的球孢白僵菌接种起始上蔟吐丝的家蚕,并对接种后不同时间点(也即幼虫上蔟吐丝起始后的不同时间点)的幼虫和蛹期体壁中的BmSPI39进行Western blot分析。采用组织裂解液(8 mol/L尿素,2% CHAPS,0.4% DTT)提取1.7节中接种球白僵菌后不同时间点的家蚕体壁蛋白质,并利用Bradford法(Bradford,1976)测定蛋白质浓度。蛋白样品经15%的还原性SDS-PAGE分离后,电转印记至PVDF膜上。将膜置于5%脱脂奶粉中,4℃条件下封闭过夜。使用针对BmSPI39的多克隆抗体作为第一抗体(1∶2 500)和HRP标记山羊抗兔IgG(1∶40 000)作为二抗。以α-tubulin作为内参。使用ECL检测试剂盒(Roche)显色,检测其化学发光信号。运用Quantity One软件对Western blot的条带进行灰度分析。首先将目的蛋白条带的灰度值除以内参蛋白条带的灰度值,进行归一化处理。然后以空白对照组归一化后的灰度值为基数,实验组归一化后的灰度值与其比值为相对灰度值,也即蛋白的相对表达量。
2 结果
2.1 BmSPI39原核表达
原核表达结果表明,在0.2 mmol/L IPTG诱导培养5 h条件下,BmSPI39在BL21(DE3)菌株上清中高量表达(图1:A),经镍柱亲和纯化后获得一个约18 kD的高纯度蛋白质(图1:B),其表观分子量与BmSPI39重组蛋白的二聚体大小一致。鉴于BmSPI39能够抑制枯草杆菌蛋白酶等微生物物源的蛋白酶活性(Lietal.,2015),利用10% Native PAGE(pH 8.3)对纯化前后不同稀释度的蛋白样品进行分离和进行蛋白酶抑制剂胶内活性染色检测,结果显示纯化后的重组BmSPI39蛋白能够强烈抑制枯草杆菌蛋白酶A的活性(图1:C),证实该纯化蛋白为有生物学活性的His6-BmSPI39重组蛋白。
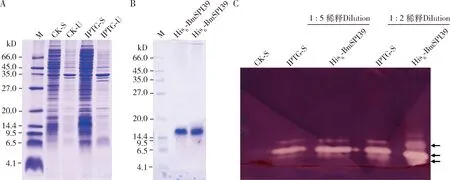
图1 家蚕BmSPI39的重组表达 (A)、纯化(B)及其对枯草杆菌蛋白酶A的胶内活性染色检测(C)Fig.1 Expression (A),purification (B) of the recombinant BmSPI39 of Bombyx mori and its activity to the subtilisin A detected by in-gel activity staining (C)CK-S和CK-U分别表示对照组的菌体上清和不可溶成分;IPTG-S和IPTG-U分别表示IPTG诱导组中的菌体上清和不可溶成分。His6- BmSPI39表示含组氨酸标签的BmSPI39重组蛋白;箭头所示为BmSPI39重组蛋白条带及其活性染色带;C图中白色条表示带胶内BmSPI39具有能抑制枯草杆菌蛋白酶A的蛋白酶活性。CK-S and CK-U indicate the supernatant and insoluble components of the E.coli cells in the control group,respectively.IPTG-S and IPTG-U indicate the supernatant and insoluble components of the IPTG-induced E.coli cells,respectively.His6-BmSPI39 denotes the hexahistidine-tagged recombinant BmSPI39.The arrowheads show the protein bands and activity-stained bands of the recombinant BmSPI39.The white band in figure C indicates that BmSPI39 in the gel can inhibit the protease activity of subtilisin A.下同The same below.
2.2 BmSPI39多克隆抗体的制备、纯化及Western blot分析
间接ELISA法测定结果表明,BmSPI39抗血清的效价达1∶128 000(图2:A)。亲和层析结果显示,在多克隆抗体的洗脱峰出现在洗脱体积30~35 mL之间,且峰值较高(图2:B)。SDS-PAGE结果显示,在表观分子质量约55和28 kD处检测到清晰的抗体重链和轻链条带(图2:C),获得了较高纯度的BmSPI39多克隆抗体。
Western blot结果显示,在BmSPI39重组蛋白二聚体和三聚体分子量大小处皆出现清晰的蛋白条带,且BmSPI39重组蛋白主要以二聚体形式存在,少量以三聚体形式存在(图3:D)。为排除样品中杂蛋白非特异结合对Western blot结果的干扰,我们利用非还原SDS-PAGE对BmSPI39重组蛋白进行分离后,采用胶内活性染色法检测其对枯草杆菌蛋白酶的抑制活性。结果显示,IPTG诱导后的菌体上清中只检测到BmSPI39蛋白的二聚体的活性条带,纯化后的BmSPI39重组蛋白中除检测到很强的二聚体活性条带外,还能检测到微弱的三聚体活性条带(图2:E)。上述结果表明,制备的多克隆抗体能够识别BmSPI39重组蛋白的各种形式,可用于BmSPI39生理功能的相关研究。
2.3 基于转录组数据的BmSPI39的时空表达分析
基于转录组数据的BmSPI39时空表达热图分析表明,BmSPI39在游走期和预蛹期的家蚕体壁中皆有表达,但在4龄第3天-5龄第3天之间及化蛹第1天的家蚕体壁中都不表达;BmSPI39在预蛹期的脂肪体中的表达量较高,但在各时期的中肠中均未检测到表达(图3)。
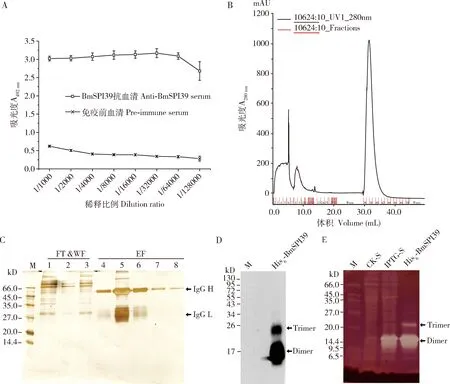
图2 家蚕BmSPI39多克隆抗体的纯化及Western blot分析Fig.2 Purification and Western blot analysis of anti-BmSPI39 polyclonal antibody of Bombyx moriA:BmSPI39抗血清的效价测定Titer determination of BmSPI39 antiserum;B:BmSPI39多克隆抗体的亲和纯化Affinity purification of anti-BmSPI39 polyclonal antibody;C:纯化的BmSPI39多克隆抗体的SDS-PAGE分析SDS-PAGE analysis of the purified anti-BmSPI39 polyclonal antibody;D:基于Western blot技术的纯化的BmSPI39多克隆抗体的抗原结合特性分析Analysis of antigen-binding properties of the purified anti-BmSPI39 polyclonal antibody by Western blot;E:经非还原SDS-PAGE分离后BmSPI39重组蛋白的胶内活性分析In-gel activity analysis of BmSPI39 recombinant protein after separation by non-reducing SDS-PAGE.Trimer:三聚体;Dimer:二聚体.FT&WF:流穿和漂洗部分Flow-through and washing fractions;EF:洗脱部分Elution fraction.
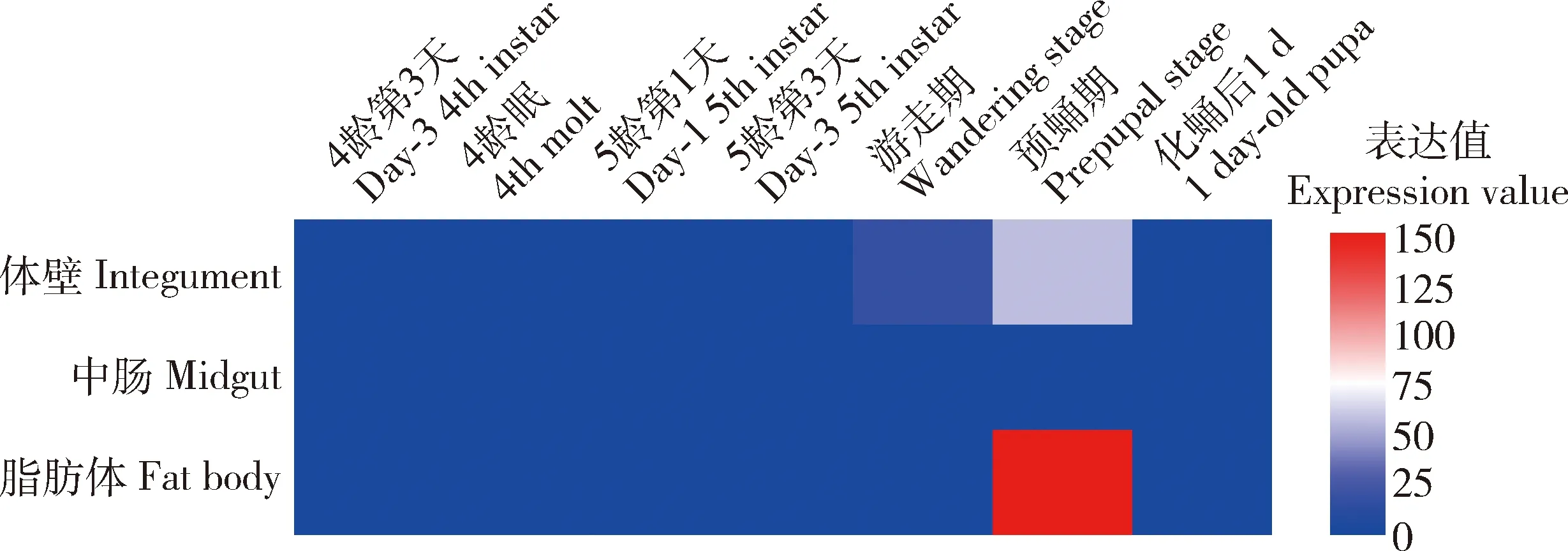
图3 基于家蚕开放性数据库SilkDB 3.0利用Heml1.0对BmSPI39在家蚕免疫相关的组织中的时空表达热图分析Fig.3 Heat map analysis of the spatiotemporal expression of BmSPI39 gene in immune-related tissues of Bombyx mori based on the open database SilkDB 3.0 using Heml 1.0
2.4 球孢白僵菌感染后家蚕体壁中BmSPI39蛋白的表达特征
接种后不同时间点幼虫体壁中BmSPI39 的Western blot分析结果表明,接种白僵菌后36 h(吐丝期)和60 h(预蛹期),对照组及2×106和 2×107孢子/mL孢子悬浮液处理组中的家蚕体壁中皆未检测到BmSPI39的表达(图4:A,D);接种后84 h(化蛹第1天),BmSPI39的蛋白前体以同源四聚体和三聚体的形式表达于家蚕体壁中(图4:B),随着家蚕的发育进程其N端信号肽被切除,形成成熟体蛋白的同源四聚体和三聚体(图4:B,C)。与对照组相比,2×106和 2×107孢子/mL分生孢子孢子悬浮液接种家蚕后84 h时BmSPI39的表达量分别上调至2.29和1.45倍,108 h(化蛹第2天)时的表达量分别下调至0.39和0.54倍(图4:E)。2×107孢子/mL分生孢子孢子悬浮液接种家蚕后120 h(化蛹第3天)时BmSPI39的表达量进一步下调至对照组的0.10倍(图4:F)。上述结果提示,家蚕体壁中的BmSPI39蛋白的表达能够响应球孢白僵菌的入侵过程,且在接种后84 h(化蛹第1天)表达响应至高峰,后下调低于未接种球孢白僵菌的对照组。
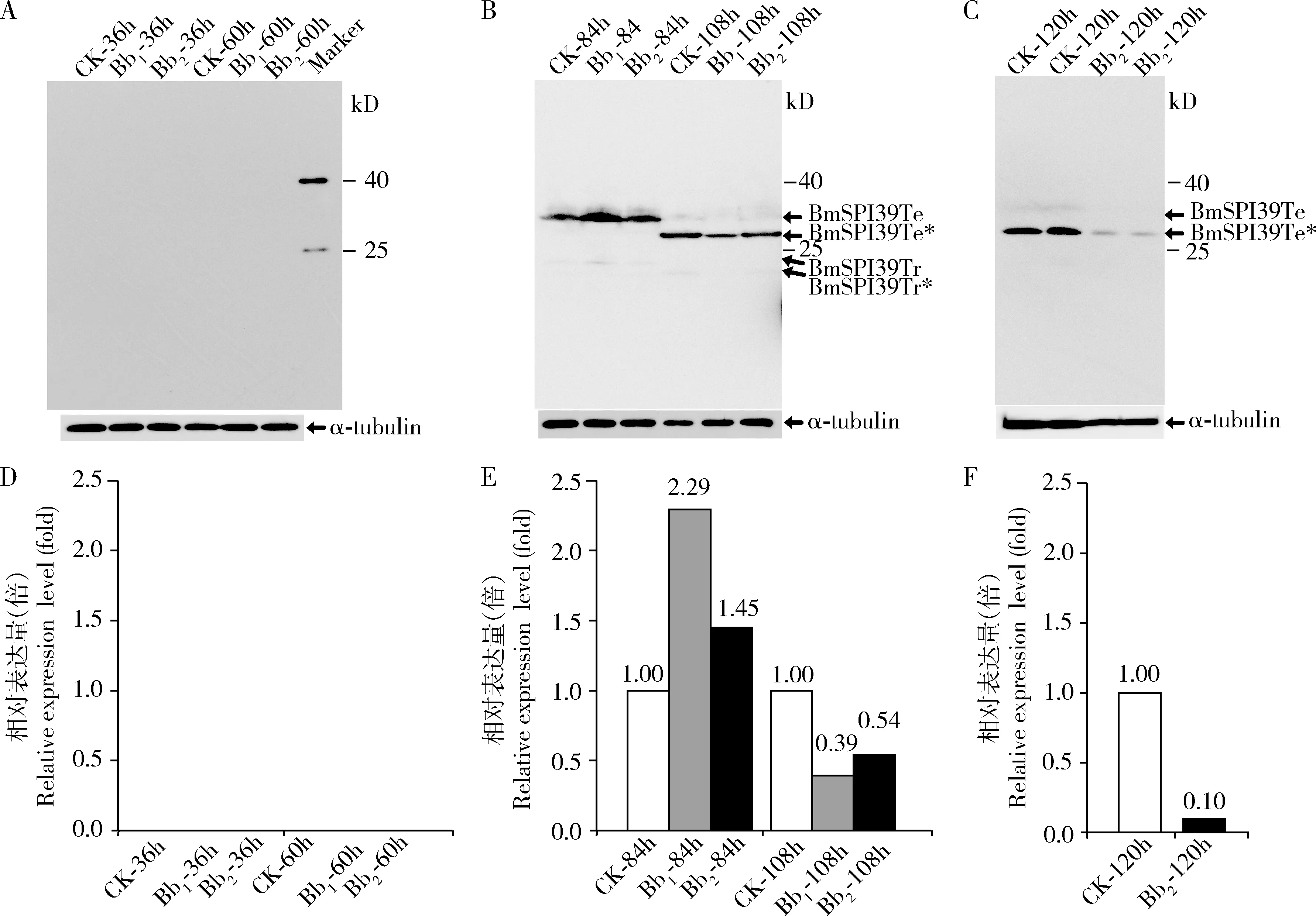
图4 Western blot检测感染孢白僵菌不同时间后家蚕幼虫和蛹体壁中BmSPI39的表达量Fig.4 Expression levels of BmSPI39 in the integument of Bombyx mori larvae and pupae at different time after infection of Beauveria bassiana detected by Western blot幼虫感染后时间Time post infection to larvae:A,D:36,60 h;B,E:84,108 h;C,F:120 h.α-tubulin:内参蛋白Reference protein;CK:空白对照组Blank control group;Bb1,Bb2:分别表示2×106和2×107孢子/mL分生孢子悬浮液处理组Groups treated with 2×106 and 2×107 conidia/mL of conidial suspension,respectively;Tr:蛋白三聚体Trimeric protein;Te:蛋白四聚体Tetrameric protein.Tr*:成熟体蛋白三聚体Trimeric mature protein;Te*:成熟体蛋白四聚体Tetrameric mature protein.图D,E,F分别为图A,B,C的相对表达量分析。Figures D,E and F are the relative expression level analysis of figures A,B and C,respectively.
3 讨论
本研究成功制备了家蚕中TIL家族蛋白酶抑制剂BmSPI39的多克隆抗体,并基于该抗体蛋白发现家蚕体壁中的BmSPI39蛋白的表达能够响应球孢白僵菌的入侵。
镍柱亲和纯化后的BmSPI39重组蛋白经还原性SDS-PAGE分离后,在相对分子质量约为18 kD的位置出现一条丰度较高的单一条带,其表观分子量与BmSPI39重组蛋白的二聚体大小一致(图1:B)。然而,纯化后的蛋白有3条活性抑制活性带,提示有多种活性存在形式(图1:C),这与我们前期的研究报道一致。我们的前期研究表明,家蚕TIL家族的BmSPI38和BmSPI39重组蛋白非还原条件下都倾向形成多聚体(Lietal.,2016a),且多聚体化对这两个抑制剂的活性至关重要(Lietal.,2018)。在还原剂和SDS存在条件下,BmSPI39重组蛋白的四聚体可转换为更加稳定的二聚体形式,其三聚体含量又低于考马斯亮蓝染色的检测下限,因此在SDS-PAGE分析中只检测到一条均一的二聚体条带。截止目前文献报道,这种多聚体化现象在典型TIL家族蛋白酶抑制剂中未见报道。Western blot分析和非还原SDS-PAGE分离后的胶内活性染色结果表明(图2:D,E),纯化的BmSPI39重组蛋白主要以二聚体形式存在,少量以三聚体形式存在,制备的多克隆抗体能够有效结合各种多聚体化状态下的BmSPI39蛋白,可用于BmSPI39的检测。需要指出的是,重组BmSPI39蛋白经非还原SDS-PAGE电泳分离后仍能保持活性可能与其特殊的高级结构有关。三维结构建模显示,BmSPI39中只含有2个反平行的β折叠片以及一个小α螺旋,其余区域都是柔性的loop区域。其TIL结构域中含有4对二硫键(Cys29-Cys62,Cys40-Cys54,Cys44-Cys92和Cys64-Cys76),这4对二硫键维持着蛋白刚性结构的稳定,使大片的柔性loop区域形成一个相对紧凑而又具有一定柔性的稳定结构(Lietal.,2016a)。因而,在SDS存在下仍能保持生物学活性。
体壁是蚕体最外的组织,在防止病原体入侵中发挥着重要作用。脂肪体是重要的中间代谢组织,也是抗菌肽合成的重要场所。有研究显示,BmSPI39在5龄第5天家蚕幼虫的前中部丝腺中高量特异表达,但在体壁和脂肪体中不表达(Lietal.,2016b)。为分析抗真菌因子BmSPI39是否在家蚕体壁和脂肪体中表达,基于SilkDB 3.0转录组数据,我们对BmSPI39在家蚕免疫相关组织中的表达特征进行分析。结果显示BmSPI39在游走期和预蛹期的体壁及预蛹期的脂肪体中转录表达,而于上蔟前的家蚕幼虫体壁和脂肪体中不表达(图3)。
家蚕中有很多TIL家族的蛋白酶抑制剂参与家蚕对真菌入侵的免疫应答。我们前期运用基因芯片、半定量RT-PCR、qPCR等技术对添食感染球孢白僵菌后的家蚕幼虫中的蛋白酶抑制剂基因表达进行分析,结果发现BmSPI37(BGIBMGA009073),BmSPI38(BGIBMGA009094),BmSPI39(BGIBMGA009092),BmSPI46(BGIBMGA004727),BmSPI48(BGIBMGA010892)等TIL家族蛋白酶抑制剂基因显著上调表达(李游山等,2012;Zhaoetal.,2012)。邢东旭等利用体表接触感染法接种“抗8”品系家蚕5龄第1天幼虫,并采用RNA-Seq对接种球孢白僵菌后96 h的差异表达基因进行分析,结果显示,与对照组相比,接种白僵菌的家蚕幼虫中的BmSPI38,BmSPI39和BmSPI41(BGIBMGA009073)基因表达量显著上调(Xingetal.,2017)。非标定量蛋白质组学分析显示,接种球孢白僵菌36 h后的5龄幼虫中的BmSPI35(GenBank登录:XP_004924403)和BmSPI36(GenBank登录:XP_004924401)皆下调表达(Luetal.,2019)。这些结果显示,包括BmSPI39在内的多个TIL家族的蛋白酶抑制剂对家蚕幼虫不同时期接种的球孢白僵菌都有一个显著上调表达的响应,后表达响应下调,即存在一个对病原真菌入侵刺激的响应表达高峰。本研究Western blot检测结果(图4)也表明,对家蚕5龄末的游走期幼虫(即上蔟吐丝期幼虫)接种球孢白僵菌后,幼虫体壁中的BmSPI39表达响应高峰在接种后84 h(化蛹第1天),后表达响应下调,进一步证实了家蚕BmSPI39响应病原真菌入侵的表达特征。
笔者前期研究中利用不同浓度的球孢白僵菌接种刚进入游走期的家蚕幼虫(即起始上蔟吐丝的家蚕幼虫),并对接种后不同时间点的幼虫血淋巴中的蛋白酶抑制剂的活性表达特征进行分析。胶内活性染色结果显示,家蚕蛹期血淋巴中存在一种真菌诱导型蛋白酶抑制剂SI-3,该抑制剂仅在球孢白僵菌接种组表达,且在接种后84 h(化蛹第1天)、108 h(化蛹第2天)和120 h(化蛹第3天)时表现出对枯草杆菌蛋白酶的抑制活性,其活性高峰在接种后84 h(李游山等,2018)。本研究发现,BmSPI39蛋白也在接种白僵菌后84 h(化蛹第1天)、108 h(化蛹第2天)和120 h(化蛹第3天)时的家蚕中表达,其表达响应高峰也出现在接种白僵菌后84 h(图4)。鉴于BmSPI39与SI-3都能抑制剂枯草杆菌蛋白酶A活性,且对响应白僵菌入侵的表达特征基本一致,不排除它们为同一种蛋白的可能性。由于胶内活性染色法的局限性和血淋巴中蛋白的复杂性,尚无法通过质谱鉴定等方法对SI-3蛋白进行鉴定。本研究仅对上蔟后家蚕体壁中的BmSPI39蛋白对白僵菌入侵的响应表达进行了分析,BmSPI39蛋白在蛹期家蚕中的抗真菌机制尚需进一步探究。
