不同工艺对黄芩总黄酮提取率及其提取物性能的影响
2021-03-05朱溶月李博莉王文苹
朱溶月, 陈 媛, 李博莉, 解 甜, 王文苹
(1.宁夏医科大学药学院,银川 750004; 2.宁夏少数民族医药现代化教育部重点实验室,银川 750004)
低共熔溶剂(deep eutectic solvents,DES)是由一定摩尔比的氢键受体和氢键供体组成的,熔点显著低于其纯组分的二元或多元混合物[1]。DES 被称为“离子液体类似物”,但比离子液体性能更优越,不仅合成方法简单,且低毒、价廉、生物相容性较佳。因此近年来DES 常作为新型“绿色溶剂”用于分离、合成、功能材料和电化学领域[2],而其用于中药有效成分提取和分离的研究正在兴起[3]。
黄芩属于常用大宗中药材之一,其有效成分主要是以黄芩苷为代表的黄酮类成分,但这类成分水溶性差,因此,目前多采用乙醇回流提取[4]。黄芩提取物中黄酮类成分通常溶出缓慢、口服生物利用度较低[5],对制剂研究提出了较高要求。本文采用最常见的DES 体系——氯化胆碱和乳酸提取黄芩黄酮类成分,并利用反溶剂沉淀法在分离溶剂的同时获得提取物微粉,以期达到提高提取效率、改善提取物制剂特性的双重目的。
1 试剂与仪器
1.1 试剂与药品
黄芩饮片(1712151,宁夏明德中药有限公司,经宁夏医科大学药学院教授鉴定)、黄芩苷(98%,141208,南京景竹生物科技有限公司)、氯化胆碱(20140810,上海瑞永生物科技有限公司)。二缩三乙二醇、十二烷基硫酸钠、甘露醇、羟丙基甲基纤维素、泊洛沙姆188、聚乙烯吡咯酮、亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇等试剂均为分析纯,所用水为纯化水。
1.2 仪器
FW135 中草药粉碎机(天津市泰斯特仪器有限公司)、DF-101S 集热式恒温加热磁力搅拌器(巩义市矛华仪器有限责任公司)、756PC 紫外分光光度计(上海光谱仪器有限公司)、Nano ZS90激光粒度仪(英国)、LSRH500 高速剪切机(常州励岸宝机械设备科技有限公司)、FD-1C 冷冻干燥机(北京德天佑科技发展有限公司)、C715RE 台式微量冷冻离心机(日本日立)、RCZ-8M 自动取样溶出仪(天津市天大天发科技)、THZ-100 恒温培养摇床(上海一恒科技仪器有限公司)、PL203 电子分析天平(梅特勒-托利多仪器有限公司)、YS100 显微镜(南京凯尔仪器有限公司)、Milli-Q 型超纯水处理系统(美国Millipore公司)。
2 方法和结果
2.1 黄芩总黄酮的含量测定
以芦丁为对照品,用NaNO2-Al(NO3)3-NaOH为显色体系,采用紫外-可见分光光度法于510 nm处测定吸光度,并依据标准曲线A=0.0133C~0.0207(r2=0.9989)计算浓度及含量[6]。
2.2 黄芩提取液的制备
2.2.1 DES 温浸提取 将黄芩饮片粉碎过80 目筛,称取50 g 黄芩粉末,加入500 mL 含20%水的DES(氯化胆碱与乳酸摩尔质量比为1∶2)[7],70 ℃水浴恒温搅拌30 min 后,经高速离心(12000 r·min-1,10 min),取上清液备用。
2.2.2 乙醇回流提取 取黄芩粉末10 g,加65%乙醇170 mL,70 ℃加热回流2 h[8],提取液高速离心(12000 r·min-1,10 min),取上清液保存备用。采用2.1 方法测定提取液中总黄酮含量,提取液呈棕黄色且DES 所得提取液色泽较深,DES温浸和乙醇回流法测定计算得黄芩总黄酮提取率分别为(12.64±0.86)mg·g-1和(0.19±0.07)mg·g-1,二者相差约67 倍,表明DES 温浸法对黄芩总黄酮提取效率优于乙醇回流法。见图1。
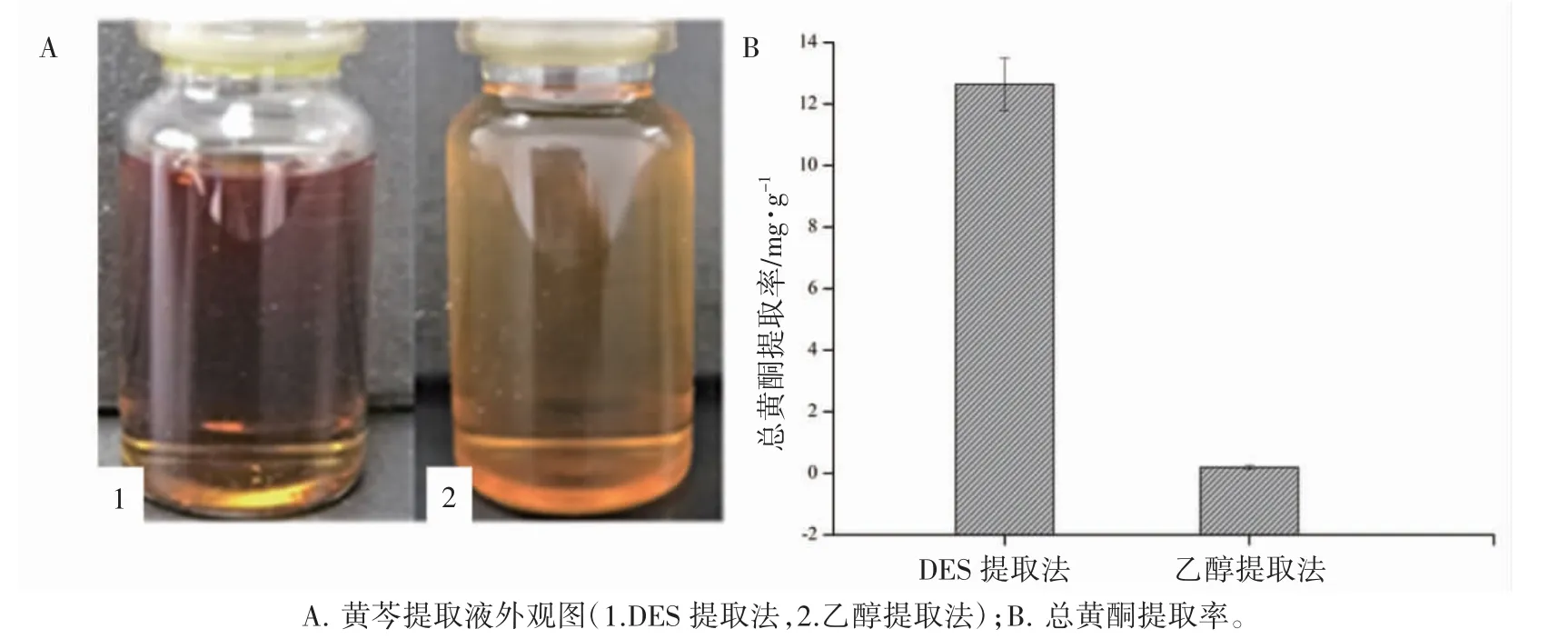
图1 不同方法所得黄芩提取液的外观及总黄酮提取率
2.3 黄芩提取物纳米混悬液及冻干粉的制备
采用反溶剂沉淀法,取10 mL 上述提取液,在高速剪切条件下(12000 r·min-1)加至100 mL 的HPMC 水溶液(5.3 mg·mL-1)中并持续剪切2 min,得到纳米混悬液;高速离心(8000 r·min-1,5 min)后取沉淀,加少量水洗涤2 次,再加入适量水混悬,添加乳糖(5%,w/v)作为冻干保护剂混匀;先置于-80 ℃冰箱中预冻6 h,再经冷冻干燥48 h得冻干粉,密封保存备用。所得混悬液及冻干粉外观均匀,其中DES 温浸法所得样品色黄,而乙醇回流法所得样品色较浅。见图2。
2.4 黄芩提取物冻干粉的初步评价
2.4.1 平均粒径与粒径分布 冻干粉(10 mg·mL-1)加适量水分散后,直接采用激光粒度仪分别测定样品混悬液平均粒径和多分散指数(polydispersity index,PDI)。经t 检验,乙醇回流提取物制得混悬液的平均粒径远低于DES 温浸法(P 均<0.05)。冻干粉复溶后平均粒径和PDI 值较混悬液均增大(P 均<0.05),但粉体平均粒径仍小于1 μm。见表1。

图2 不同方法制备黄芩提取物纳米混悬液及冻干粉外观
2.4.2 总黄酮含量 采用2.1 方法,分别取两种提取物冻干粉10 mg 加30 mL 水复溶并测定总黄酮含量,结果DES 温浸法和乙醇回流法所得样品中总黄酮含量分别为(8.97±0.55)mg·g-1和(0.69±0.07)mg·g-1。
2.4.3 总黄酮饱和溶解度 分别称取过量黄芩苷原料药、黄芩提取物冻干粉置5 mL 离心管中,加水3 mL,在37 ℃、100 r·min-1条件下连续振荡72 h,立即取出并高速离心(12000 r·min-1,5 min),取上清液加水适当稀释,采用2.1 方法测定总黄酮含量并计算饱和溶解度。两种提取物冻干粉中总黄酮溶解度均优于黄芩苷原料药(P 均<0.05),乙醇回流提取物高于DES 提取物(P<0.05)。见图3。
表1 黄芩提取物纳米混悬液及其冻干粉的粒径测定(±s)
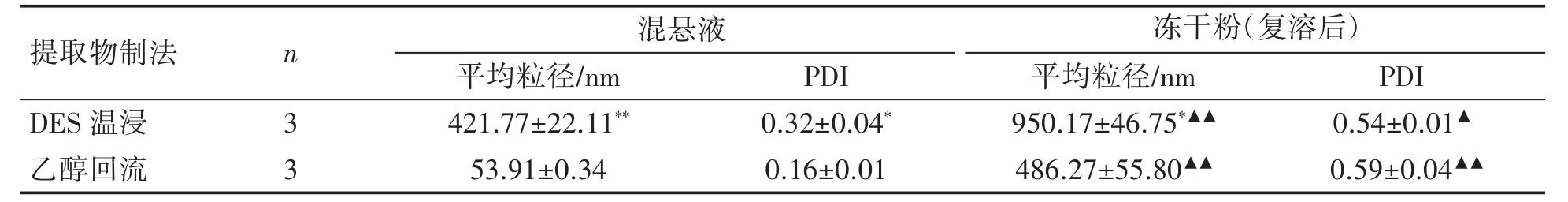
表1 黄芩提取物纳米混悬液及其冻干粉的粒径测定(±s)
与同液体乙醇回流法比较*P<0.05,**P<0.01;与同方法混悬液比较▲P<0.05,▲▲P<0.01。
提取物制法 n 混悬液 冻干粉(复溶后)平均粒径/nm PDI 平均粒径/nm PDI DES 温浸 3 421.77±22.11** 0.32±0.04* 950.17±46.75*▲▲ 0.54±0.01▲乙醇回流 3 53.91±0.34 0.16±0.01 486.27±55.80▲▲ 0.59±0.04▲▲?
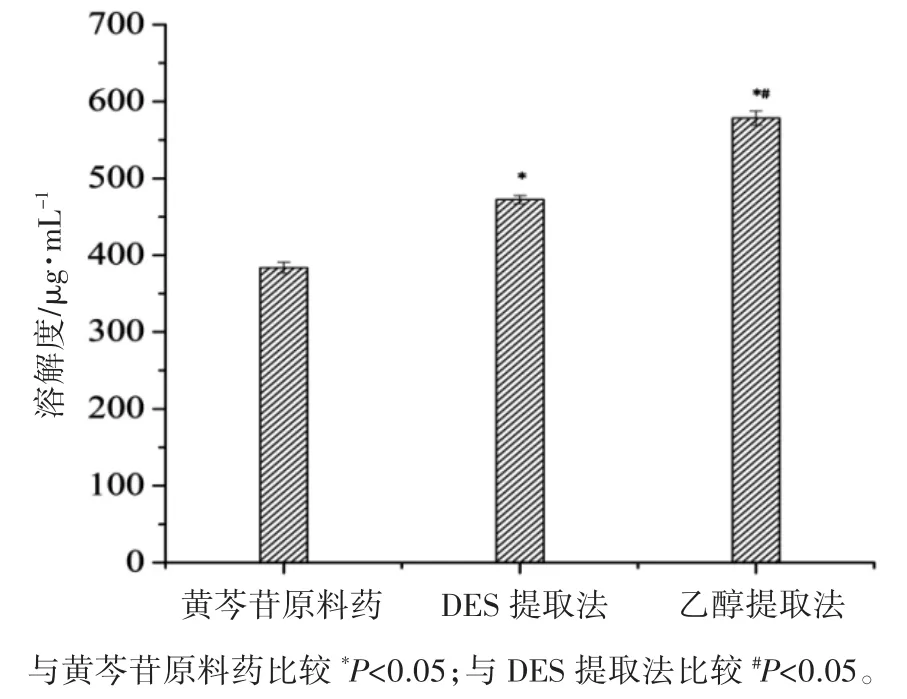
图3 黄芩苷及黄芩提取物冻干粉的饱和溶解度(n=3)
2.4.4 总黄酮体外溶出度 采用桨法进行体外溶出度实验,分别称取0.05 g 冻干粉及黄芩苷原料药,加500 mL 水作为溶出介质,固定搅拌浆转速为100 r·min-1、温度为37 ℃。分别在1、3、5、10、20、30、45、60、90、120 min 取样2.5 mL,迅速补充等量温水,样液经0.22 μm 微孔滤膜过滤,采用2.1 方法测定总黄酮含量并计算累积溶出度。如图4 所示,黄芩苷原料药2 h 时的累积溶出度不足30%;而两种冻干粉中总黄酮则立即溶出超过50%,且在45 min 时累积溶出达90%以上。
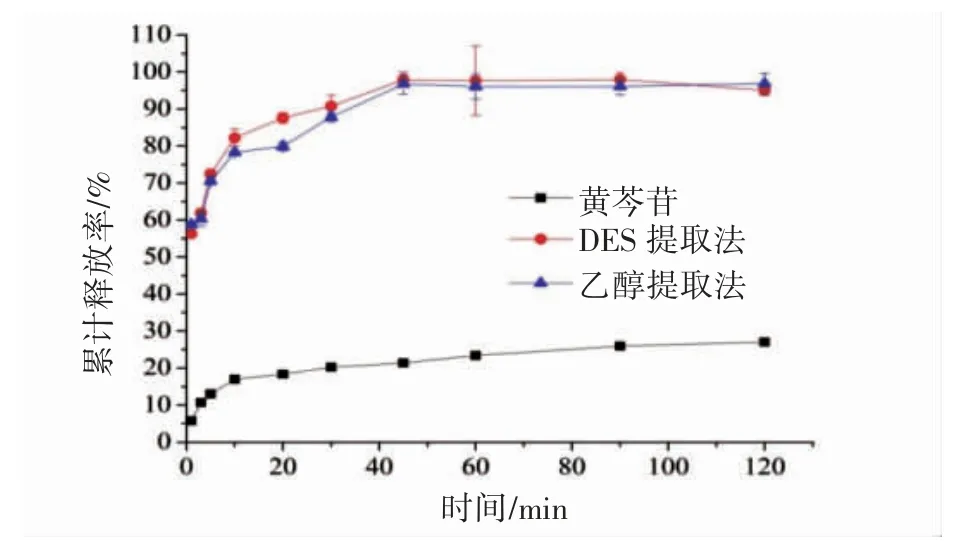
图4 黄芩苷原料及黄芩提取物冻干粉中总黄酮的体外溶出曲线
3 讨论与结论
本文分别采用DES 温浸和乙醇回流两种方法提取黄芩中的总黄酮类成分,可观察到所得提取液的外观色泽差异显著,并与总黄酮含量测定结果直接相关。由于提取物粒径较小,属亚微米级,因此两种黄芩提取物中总黄酮的溶解度均显著提高[9]。本文研究发现,乙醇提取物的溶解度稍高于DES 提取物,原因可能与其粒径显著较小有关。此外,两种冻干粉的体外溶出行为差异很小,但两种冻干粉中有效成分的溶出均优于黄芩苷原料药,这与冻干粉粒径小、有效成分溶解度高的特性直接相关[10]。
DES 可分为亲水性和疏水性两类[11],目前常见的是以季铵盐(如氯化胆碱)和羧酸(如乳酸)为代表的亲水性DES,这类DES 能与水混溶、合成工艺简便、生物相容性好,有利于对所得提取液进行后继处理。现有研究[12-13]显示,将亲水性DES 用于提取植物中的黄酮、皂苷、多糖、蛋白质等多种成分,与传统水、乙醇等溶剂相比,其有效成分提取率显著提高。
黄芩中黄酮类成分的提取以水煎煮和乙醇(60%~70%)回流提取为主,间或辅以超声、微波、红外、酶解等技术改善提取效率[14-15];其分离则以大孔吸附树脂为主。李婷婷[7]以含水20%的氯化胆碱-乳酸(摩尔比1∶2)为溶剂,采用微波辅助提取黄芩中的4 种主要黄酮成分,并进一步通过ME-2 大孔树脂进行富集。本文借鉴其优化后的提取工艺条件,并进一步将所得提取液直接与水混合,使得DES 与水混溶的同时难溶性黄酮类有效成分析出沉淀。DES 不仅提取效率优于传统乙醇回流工艺,且所得提取物粉末溶解、溶出性能均较佳,有利于进一步制剂加工。
综上所述,本研究采用DES 提取黄芩总黄酮并进一步经反溶剂沉淀法和冷冻干燥法制得黄芩提取物混悬液及其冻干粉,其粒径小且较均匀。不仅提高了总黄酮提取率,也提高了在水中的饱和溶解度和溶出性能,优于传统乙醇回流工艺。所得提取物可作为制剂中间体,便于进一步成型。本文为新型绿色溶剂用于中药提取物的创新研究提供参考。
