丛毛红曲菌固态发酵山药产莫纳可林K的影响因素研究
2021-03-04覃学领吴佩芝余伊鑫冯艳丽
覃学领,吴佩芝,余伊鑫,余 翔,冯艳丽*
(1.特色野菜良种繁育与综合利用技术湖北省工程研究中心,湖北黄石 435002;2.湖北师范大学食用野生植物保育与利用湖北省重点实验室,湖北黄石 435002;3.湖北师范大学生命科学学院,湖北黄石 435002;4.湖北师范大学生物学国家级实验教学示范中心,湖北黄石 435002)
山药(Dioscorea opposite)是我国药食同源材料的杰出代表,可根据口感、形状、产地及含水量等将其分为水山药、长山药、铁棍山药、普通山药等[1]。铁棍山药呈圆柱形,表皮有紫斑和疙瘩且毛须分布稠密,口感绵软,质地细腻。铁棍山药又分为沙土铁棍山药和垆土铁棍山药。垆土铁棍山药外形弯而细、粗细不均,而沙土铁棍山药外形直而粗、粗细均匀。普通山药又叫菜山药,形状不规则,具有表皮光滑、毛孔稀疏、含水量高、纤维粗糙、易折断及易腐败的特点[2]。
山药中淀粉含量丰富,然而产地和生长环境可影响山药的基因型和表型,其淀粉特性也差异较大[3]。干山药的淀粉含量范围为66.21%~68.88%[4-5]。新鲜垆土铁棍山药和新鲜沙土铁棍山药淀粉含量分别为19.29%和15.31%[2]。除淀粉外,山药还富含多种营养及功效成分,如蛋白质、氨基酸、多糖、皂甙、糖蛋白等[6]。另外,山药中含有的18种氨基酸包含人体必需的8种[6],具有抗糖尿病、调理脾胃、保护肝脏等功效[3]。目前,山药多用于生产初级加工产品,如山药果脯、山药挂面、山药脆片、山药饮料等,其附加值仍有待提升[7-8]。山药的精深加工及新产品开发,可大幅提升山药附加值,是该行业亟待解决的关键问题之一。
红曲在我国有2 000多年的应用历史,为充分利用山药的营养及功效成分如淀粉、多糖及氨基酸等,可考虑将其作为红曲菌(Monascusspp.)的发酵基质生产功能性红曲。功能性红曲一般是指红曲菌发酵淀粉质原料所得的可调节血脂功效成分莫纳可林K(monacolin K,MK)含量≥0.4%的红曲产品[9]。除MK外,红曲菌可代谢产生天然着色剂红曲色素(Monascuspigments)、可改善睡眠并降低血压的抑制性神经递质γ-氨基丁酸等[10]。山药中淀粉多为直链淀粉,易被微生物利用,有利于红曲菌生长[11]。目前,已有文献报道红曲发酵山药的相关研究,红曲山药不仅安全性高,还对小鼠酒精诱导的肝损伤具有保护作用[12-13]。然而,山药红曲中MK的产量仍有待进一步提升。
本研究以新鲜山药为发酵基质,以丛毛红曲菌(Monascus pilosus)MS-1为实验菌株,采用固态发酵山药,探究了新鲜山药和干山药、山药品种、蔗糖、山药块茎大小、乳酸等因素对发酵山药中MK产量的影响因素。以期为提升山药的附加值,开发新型功能性红曲产品提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与材料
丛毛红曲菌(Monascuspilosus)MS-1(CCTCCM2013295):从市售红曲米中分离的可高产MK、不产生桔霉素的红曲菌株,于中国典型培养物保藏中心保藏。
新鲜沙土铁棍山药及新鲜垆土铁棍山药:均产自河南焦作;新鲜普通山药a和新鲜普通山药b:购于湖北黄石菜市场;干山药:产自河南焦作。
1.1.2 试剂
葡萄糖、蔗糖(均为分析纯)、蛋白胨、琼脂(均为生化试剂)、乙腈(色谱纯):国药集团化学试剂有限公司;MK标准品(纯度>98%):上海阿拉丁生化科技股份有限公司。
1.1.3 培养基
种子液培养基[14]:葡萄糖、蛋白胨、磷酸二氢铵、七水硫酸镁和无水氯化钙含量分别为80 g/L、10 g/L、2 g/L、0.5 g/L和0.1 g/L。将土豆去皮后称取200 g,切块后放入蒸馏水中,加热并维持微沸20 min。纱布过滤后所得的滤液代替蒸馏水与上述试剂混匀,定容至1 000 mL。pH自然,1×105Pa灭菌20 min。
马铃薯葡萄糖琼脂培养基(potatodextroseagar,PDA)[15]:将土豆削皮后称量200 g,将其切成约2 cm3的方块后放入适量蒸馏水中。加热至煮沸后维持微沸状态20 min。用纱布过滤后取滤液,量取适量的蒸馏水补足至1 000 mL。加入葡萄糖及琼脂粉各20 g,加热直至葡萄糖和琼脂粉完全溶解。在1×105Pa的条件下灭菌20 min。
1.2 仪器与设备
LRH-80型生化培养箱、DHG-9070A型电热恒温鼓风干燥机:武汉一恒苏净科学仪器有限公司;UV-5100B型紫外分光光度计:上海元析仪器有限公司;KQ-250DE型数控超声波清洗器:昆山市超声仪器有限公司;安捷伦1260高效液相色谱(high performance liquid chromatography,HPLC):安捷伦科技有限公司;InertsilODS-3色谱柱(4.6mm×250mm,5 μm):日本岛津公司。
1.3 方法
1.3.1 山药形状对新鲜山药含水量的影响
将普通新鲜山药a分别切成薄片(1 cm×1 cm×0.2 cm)和方块状(1 cm×1 cm×1 cm),测定水分含量。
1.3.2 山药红曲固态发酵
丛毛红曲菌种子液的制备参照文献[15]进行。将培养好的丛毛红曲菌种子液以13%的接种量接种于装有50 g山药的250 mL锥形瓶中,先在30 ℃培养60 h,再转入25 ℃继续培养至14 d。将发酵14 d的山药红曲在55 ℃烘干12 h,粉碎至80目备用[16]。
1.3.3 丛毛红曲菌发酵山药产MK的影响因素研究
(1)新鲜山药和干山药对菌株MS-1固态发酵山药产MK的影响
以普通新鲜山药a和普通干山药a为基质,将普通新鲜山药和普通干山药均切成1 cm3的方块,调整上述基质含水量为33%[15]。装料量为50 g/250 mL,在1×105Pa灭菌20 min并趁热打散,将菌株MS-1分别接种于上述培养基中。按照方法1.3.2进行固态发酵。采用高效液相色谱(HPLC)法测定发酵产物中MK的含量。
(2)新鲜山药品种对菌株MS-1固态发酵山药产MK的影响
分别以新鲜的沙土铁棍山药、垆土铁棍山药、普通山药a和普通山药b作为发酵基质,山药切成1 cm3的方块。调整水分含量为33%,装料量为50 g/250 mL,在1×105Pa灭菌20 min并趁热打散,将红曲菌MS-1分别接种于上述培养基中。按照方法1.3.2进行固态发酵,采用HPLC法测定发酵产物中MK的含量。
(3)蔗糖添加量对菌株MS-1固态发酵山药产MK的影响
选取山药品种为沙土铁棍山药,水分含量调整为33%,山药切成1 cm3的方块,装料量为50 g/250 mL,在1×105Pa灭菌20 min并趁热打散,将菌株MS-1分别接种于上述培养基中。分别调整培养基中蔗糖添加量分别为3%、6%、9%、12%、15%,以不添加蔗糖的处理为对照(CK)。按照方法1.3.2进行固态发酵,采用HPLC法测定发酵产物中MK的含量。
(4)山药块茎大小对菌株MS-1固态发酵山药产MK的影响
选取山药品种为沙土铁棍山药,水分含量调整为33%,蔗糖添加量为3%,调整山药体积分别为0.25 cm×0.25 cm×0.25 cm、0.5 cm×0.5 cm×0.5 cm、1 cm×1 cm×1 cm、2 cm×1 cm×1 cm、3 cm×1 cm×1 cm。装料量为50 g/250 mL,在1×105Pa灭菌20 min并趁热打散,将菌株MS-1分别接种于上述培养基中。按照方法1.3.2进行固态发酵,采用HPLC法测定发酵产物中MK的含量。
(5)乳酸添加量对菌株MS-1发酵山药产MK的影响
选取山药品种为沙土铁棍山药,水分含量调整为33%,蔗糖添加量为3%,调整山药体积为0.5 cm×0.5 cm×0.5 cm,调整培养基中乳酸添加量分别为0.1%、0.3%、0.6%、0.9%、1.2%,以不添加乳酸的处理为对照(CK)。装料量为50g/250mL,在1×105Pa灭菌20 min并趁热打散,将菌株MS-1分别接种于上述培养基中。按照方法1.3.2进行固态发酵,采用HPLC法测定发酵产物中MK的含量。
1.3.4 分析检测
(1)水分含量的测定
新鲜山药水分含量测定参考国标GB 5009.3—2016《食品安全国家标准食品中水分的测定》中的直接干燥法。
(2)MK含量的测定
采用前期优化的HPLC法检测山药红曲中MK的产量[16]。准确称取0.30 g山药红曲粉末,加入体积分数75%乙醇10 mL,轻微振荡使其混合。室温条件下超声提取1 h(功率为40 W),取出放置冷却至室温。取提取液在8 000 r/min离心10 min,取上清液于波长505 nm处测吸光度值(OD505nm值)。取离心后上清液过0.22 μm滤膜,用于HPLC法检测MK的含量。采用的流动相为乙腈∶水∶0.5%磷酸(60∶37∶3,V/V),流速为1 mL/min。色谱柱为InertsilODS-3(4.6 mm×250 mm,5 μm),柱温为25 ℃,进样量为20 μL,检测波长为238 nm。
定性与定量分析:结合QB/T 2847—2007《功能性红曲米(粉)》及课题组前期建立的方法[16],通过MK在HPLC检测过程中的保留时间对酸式及内酯式MK进行定性,再利用其峰面积对其定量。MK含量的计算公式如下:

1.3.5 数据处理
数据处理和图表绘制采用SPSS 19.0和Origin 9.0。
2 结果与分析
2.1 山药形状对含水量的影响
薄片状新鲜普通山药水分含量为(73.786±1.074)%,方块状新鲜普通山药水分含量为(80.659±0.317)%。由测定结果可知,方块状的新鲜山药水分挥发更彻底,对新鲜山药中水分含量的测定更为准确。其原因可能是相比于方块状山药,在干燥过程中薄片状山药容易发生黏连,水分不易挥发。因此,新鲜山药的水分含量为(80.659±0.317)%,与已有研究结果基本相符[17]。
2.2 丛毛红曲菌固态发酵山药产MK的影响因素研究
2.2.1 普通新鲜山药和普通干山药对菌株MS-1固态发酵
山药产MK的影响
普通新鲜山药和普通干山药对菌株MS-1固态发酵山药中MK产量的结果见图1。
由图1可知,菌株MS-1发酵普通干山药a和普通新鲜山药a所得山药红曲中MK含量较低,均未达到功能性红曲对MK含量的基本要求[9]。分析其原因是该配方不利于红曲菌的生长及MK的产生。与普通干山药a相比,菌株MS-1发酵普通新鲜山药a所得山药红曲中MK含量较高,这可能与山药干燥过程中营养成分的部分损失有关[18]。因此,选取新鲜山药为发酵基质,在后续实验中将进一步优化培养基基质,提升山药红曲中MK的产量。
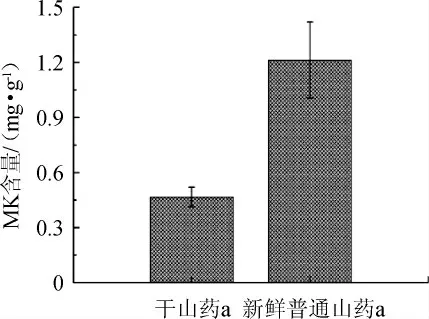
图1 新鲜普通山药a和干山药a对莫纳可林K产量的影响Fig. 1 Effects of fresh yam a and dry yam a on monacolin K production
2.2.2 新鲜山药品种对菌株MS-1固态发酵产MK的影响
新鲜山药品种对菌株MS-1固态发酵山药中MK产量的结果见图2。

图2 新鲜山药品种对莫纳可林K产量的影响Fig. 2 Effects of fresh yam varieties on monacolin K production
由图2可知,菌株MS-1发酵沙土铁棍山药和垆土铁棍山药产MK的量显著高于两种普通山药(P<0.05)。相比普通山药,铁棍山药水分含量及粘液质相对较少,发酵过程中可保持较高的溶氧量,更利于丛毛红曲菌的生长及代谢产物的产生[19-21]。菌株MS-1发酵沙土铁棍山药和垆土铁棍山药所得发酵产物中MK的产量无显著性差异(P>0.05)。因此,选择营养价值相对较低、含水量较高且较为不易贮藏的沙土铁棍山药[2]为发酵基质,开展后续的实验,以最大限度降低生产成本并提高其附加值。
2.2.3 蔗糖添加量对菌株MS-1固态发酵山药产MK的影响
结合前期研究结果,与葡萄糖相比,在培养基中添加少量蔗糖可促进红曲菌产生MK[16]。蔗糖添加量对从毛红曲菌固态发酵山药中MK产量的结果见图3。
葡萄糖对丛毛红曲菌固态发酵山药中MK产量具有一定促进作用。由图3可知,以不添加蔗糖的发酵基质为对照,当蔗糖添加量为3%时,MK产量达到最高,为9.93 mg/g,随着蔗糖添加量增加至15%,山药红曲中MK产量逐渐下降。在丛毛红曲菌发酵过程中添加少量外源碳源,可以促使菌株MS-1在发酵初期快速生长,减少污染杂菌几率。当外源碳源过多时,可能造成菌株MS-1生物量增加,MK产量逐渐下降,其原因是MK等次级代谢产物常在丛毛红曲菌处于逆境胁迫(如碳饥饿等)条件下产生和积累[22-24]。因此,选择蔗糖添加量3%为宜。

图3 蔗糖添加量对莫纳可林K产量的影响Fig. 3 Effects of sucrose addition on monacolin K production
2.2.4 山药块茎大小对菌株MS-1固态发酵山药产MK的影响
山药块茎的大小可影响菌株MS-1生长的表面积以及发酵过程中的通氧量,山药块茎大小对菌株MS-1固态发酵山药中MK产量的结果见图4。

图4 山药块茎大小对莫纳可林K产量的影响Fig. 4 Effects of yam tuber size on monacolin K production
由图4可知,当山药体积分别为0.25cm×0.25cm×0.25cm、0.5 cm×0.5 cm×0.5 cm时,MK产量逐渐增加,当山药体积大小为0.5 cm×0.5 cm×0.5 cm时,MK产量达到最高,为7.42 mg/g,随着山药块茎体积的继续增加,MK产量下降。其原因是若山药体积过小则易造成山药块体之间的黏连,不利于发酵。而山药体积(0.5 cm×0.5 cm×0.5 cm)时,山药块茎表面积适中,菌株MS-1可以附着生长的基质表面相对较多,更利于菌株MS-1利用基质内部的碳源及氮源等营养物质,因此更利于菌株MS-1固态发酵山药产MK。山药体积为3 cm×1 cm×1 cm和2 cm×1 cm×1 cm所得发酵产物中MK的产量无显著性差异(P>0.05)。当山药体积增加,山药内部通氧量不足,因为菌株MS-1主要在表面生长,导致MK产量整体偏低。因此,选择山药块茎大小0.5 cm×0.5 cm×0.5 cm为宜。
2.2.5 乳酸添加量对菌株MS-1固态发酵山药产MK的影响红曲菌嗜酸,添加乳酸可使基质在发酵初期减少杂菌污染的同时,促进红曲菌生长[23]。乳酸添加量对菌株MS-1固态发酵发酵山药中的MK产量的结果见图5。

图5 乳酸添加量对莫纳可林K产量的影响Fig. 5 Effects of lactic acid addition on monacolin K production
由图5可知,与对照组(CK)相比,随着乳酸添加量在0~0.3%范围内的增加,MK产量呈上升趋势,当乳酸添加量为0.3%时,MK的产量达到最高值,最高值为8.10 mg/g,高于紫色红曲菌(Monascus purpureus)NTU301发酵山药所得MK产量2.58 mg/g[26]。继续增加乳酸添加量至1.2%,MK产量呈下降趋势。乳酸添加量为0.9%和1.2%所得发酵产物中MK的产量无显著性差异(P>0.05)。由于丛毛红曲菌嗜好乳酸,添加乳酸有利于丛毛红曲菌生长及次级代谢产物的产生[25]。然而,添加过多的乳酸会造成培养基pH偏离丛毛红曲菌发酵山药产MK的最适条件[15]。因此,选择添加0.3%的乳酸为宜。
3 结论
本研究采用山药作为发酵基质,以丛毛红曲菌MS-1为菌种,探究丛毛红曲菌固态发酵山药中MK产量的影响。结果表明,块状山药优于片状山药,新鲜山药优于干山药。当发酵基质为新鲜沙土铁棍山药、蔗糖添加量3%、山药块茎大小(0.5cm×0.5 cm×0.5 cm)、乳酸添加量0.3%时,丛毛红曲菌固态发酵山药中MK产量可达8.10 mg/g。本研究可为提高山药产品的附加值,丰富功能性红曲产品类型提供参考。
