基于高通量测序技术分析汉中地区泡菜水细菌多样性
2021-03-04翟彩宁
陈 佩,刘 莹,翟彩宁,党 辉*
(1.陕西开放大学中瑞旅游与酒店管理学院,陕西 西安 710119;2.陕西开放大学信息与智能技术学院,陕西 西安 710119;3.陕西师范大学食品工程与营养科学学院,陕西 西安 710119)
泡菜作为我国传统发酵食品之一,广泛分布于我国的华中、华北和东北等地区,因其味道酸甜、色泽鲜亮且口感脆生而深受广大人民的喜爱[1]。陕西泡菜又称为“陕西浸菜”,其制作工艺也相对简单,主要以当地的辣椒、豇豆和萝卜等蔬菜为原料,并辅以食盐、生姜、八角和花椒等香辛料混合发酵而成[2]。汉中地处秦岭山地和大巴山地的过渡地带,位于陕西省西南部,陕甘川三省交汇处。因其独特的地理环境和文化背景赋予了发酵食品特殊的风味。一项针对陕西省安康市泡菜水中细菌多样性的研究发现其包含独特的微生物群落[3]。蔬菜发酵不仅能有效延长其贮藏期,赋予其独特的口感和风味[4-5],还能有效提升其产品价值[6]。相关报道显示,发酵期间微生物的生长代谢直接影响着泡菜的品质[7]。泡菜开始发酵之前,通常会加入老卤作为“引子”加速泡菜的发酵进程[8],且长时间循环使用的老卤能赋予泡菜特殊的风味品质[9]。近年来,科研人员系统的解析了不同地区泡菜中微生物的多样性[10],结果显示,乳酸菌为泡菜发酵过程中的优势菌,对于泡菜的滋味具有重要的贡献[11]。值得注意的是,泡菜水作为泡菜发酵的主要场所,含有大量的乳酸菌,直接或间接影响着泡菜的品质[12],但目前关于泡菜的研究大多基于泡菜本身,而忽略了泡菜水在发酵过程中的重要作用。因此,针对泡菜水中微生物多样性的研究是十分必要的。
近年来,随着分子生物学技术的迅速发展和大数据分析的普及,以Illumina MiSeq为代表的第二代测速技术凭借其通量高、精度高和速度快等优点,广泛应用于环境中微生物多样性的解析[13-14]。相较于传统微生物手段,高通量测序技术能不依赖于微生物的纯培养,对环境中微生物的构成和多样性进行全面的解析。目前,其已广泛应用于泡菜[15]、白酒[16]和乳制品[17]等传统发酵食品的微生物解析中。
本研究采用Illumina MiSeq高通量测序对汉中泡菜水中的细菌菌群结构进行解析,并采用生物信息学方法对其多样性进行分析,同时结合多元统计学等手段探讨了汉中泡菜水中微生物结构的差异,以期为后续泡菜工艺的改良和相关标准的制定提供一定的理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
泡菜水样本均采集自陕西省汉中市(33°04′03″N,107°01′24″E)下辖的农户家中,共计30份,编号分别为P1~P30。泡菜水的制作时间均在2020年九月中旬到十月中旬左右,所有农户在制作泡菜时,均添加了“老卤”作为引子进行发酵,且所有的泡菜原料均为豇豆和辣椒。
1.1.2 试剂
QIAGEN DNeasy mericon Food Kit脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;TransStartTMFastPfuBuffer、FastPfuFlyDNAPolymerase和脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)Mix:北京全式金生物技术有限公司;引物338F/806R:武汉天一辉远生物科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Illumina MiSeq高通量测序平台:美国Illumina公司;ND-2000C微量紫外分光光度计:美国Nano Drop公司;R920机架式服务器:美国Dell公司;Veriti FAST梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;UVPCDS8000凝胶成像分析系统:美国ProteinSimple公司。
1.3 方法
1.3.1 样品采集
使用无菌采样勺从搅拌均匀的泡菜坛中取400 mL汉中泡菜水于无菌采样瓶中,分别对样品进行编号后,低温运回实验室于-80 ℃冰箱中保存。
1.3.2 宏基因组DNA提取和Illumina MiSeq测序
参照基因组试剂盒中提供的方法对汉中泡菜水中的宏基因组DNA进行提取,并依照王玉荣等[18]的方法进行16S rRNA V3-V4区的PCR扩增。将检验合格的PCR扩增产物送至上海美吉生物医药科技有限公司,使用Illumina MiSeq平台进行高通量测序。
1.3.3 生物信息学分析
依照双端序列的重叠关系对下机序列进行拼接,并依照郭壮等[3]的质控条件对合并序列进行质控,从而获得高质量序列用于后续分析。基于QIIME平台对汉中泡菜水中细菌组成和多样性进行分析,其具体流程参照HOU Q等[19]的方法对细菌多样性进行研究。
1.3.4 多元统计学分析
使用聚类分析对泡菜水进行分组分析;基于非加权和加权Uni-Frac距离对菌群结构进行主坐标分析;使用Wilcoxon检验对不同聚类中泡菜水的α多样性和菌群结构进行差异性分析;使用R软件进行数据分析和可视化;使用Origin 9.0软件进行数据可视化。
2 结果与分析
2.1 泡菜水样品中细菌菌群结构的分析
使用Illumina MiSeq高通量测序技术对汉中泡菜水中细菌菌群的构成进行分析,共产生1 395 532条高质量序列,平均每份泡菜水可获得46 518条序列。划分和删除单序列操作分类单元(operational taxonomic unit,OTU)后,共得到9 172个OTU用于后续分析。泡菜水样品中的细菌菌群主要隶属于24个门的553属。将相对含量>1%的细菌门(属)定义为优势细菌门(属),基于门水平,30份泡菜水样品中细菌菌群结构见图1。

图1 基于门水平汉中地区泡菜水样品中细菌菌群的结构Fig. 1 Structure of bacterial community of Paocai brine samples in Hanzhong area based on phylum level
由图1可知,汉中泡菜水中的优势细菌门有2个,分别为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),其平均相对含量分别为89.12%和7.89%。值得注意的是,变形菌门仅在少量泡菜水样品中相对含量较高,而在大部分泡菜水样品中相对含量较低,甚至不存在。由此可见,泡菜水中的细菌主要隶属于厚壁菌门和变形菌门,且其相对含量存在较大差异。郭壮等[3]对陕西省安康市泡菜水中微生物多样性的解析发现,安康泡菜水中的优势菌门分别为厚壁菌门、变形菌门和放线菌门(Actinobacteria),其结果与本研究存在一定的差异。在此基础上,本研究基于属水平对泡菜水中的细菌菌群结构进行分析,结果见图2。
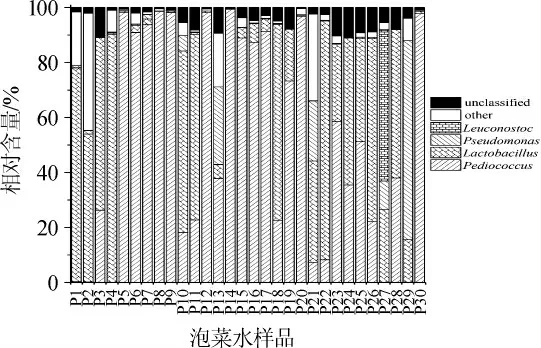
图2 基于属水平汉中地区泡菜水样品中细菌菌群的结构Fig. 2 Structure of bacterial community of Paocai brine samples in Hanzhong area based on genus level
由图2可知,汉中地区泡菜水中优势细菌属有4个,分别为片球菌属(Pediococcus)、乳杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)和明串珠菌属(Leuconostoc),其平均相对含量分别为52.06%、31.40%、4.89%和1.83%。由图2亦可知,汉中泡菜水中的细菌大多隶属于乳酸菌,且乳酸菌的累计平均相对含量>85%。安康市和汉中市两地泡菜水中细菌菌群构成较为相似,但优势菌属的组成和相对含量存在一定的差异。相关报道发现,泡菜的制作工艺和制作环境等均会影响泡菜水中微生物的构成[20-21]。
目前,相关研究已证实了泡菜中的主要细菌构成为乳酸菌,其对于泡菜的发酵和品质具有重要的作用[8]。乳酸菌能利用碳水化合物产乳酸,其可以将泡菜体系中的糖类物质转化为乳酸,并产生乙醇、乙酸和二氧化氮等挥发性物质。其不仅可以赋予泡菜制品独特的口感和风味,还能抑制杂菌和有害菌的生长以确保食品品质的安全[22]。片球菌属和乳杆菌属作为汉中泡菜水中的主要优势菌属对于其品质亦具有重要的作用。相关研究表明,动物和植物来源的片球菌属能利用碳水化合物产生不同的非挥发性和挥发性物质,且非挥发性风味物质与香气具有显著相关性,有助于提升发酵制品的感官特性[23];而乳杆菌属作为发酵制品中最常见的菌属之一,能显著改善发酵制品的口感和风味[24]。
2.2 泡菜水样品中细菌群落结构的比较
通过对泡菜水样品中细菌菌群组成分析发现,汉中泡菜水样品中细菌菌群组成之间存在较大的差异。因此,本研究为探究汉中泡菜水中细菌的整体结构,基于属水平对泡菜水样品中细菌菌群结构进行主坐标分析,结果见图3。
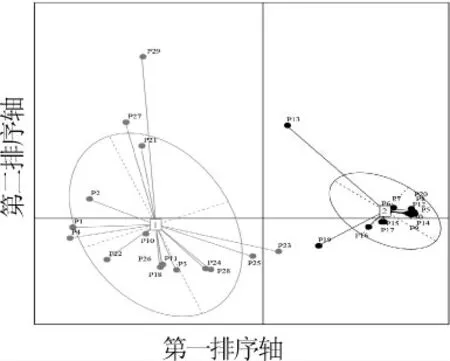
图3 基于属水平汉中地区泡菜水样品的聚类分析结果Fig. 3 Results of cluster analysis of Paocai brine samples in Hanzhong area based on genus level
当K值为2时,聚类效果最好(CH指数为65.8),即全部泡菜水样本可明显划分为2个聚类。由图3可知,30份泡菜水样品可以被划分为两个聚类,其中隶属于聚类Ⅰ的泡菜水样品有16份,而隶属于聚类Ⅱ的泡菜水样品有14份。通过对不同聚类中优势细菌属进行统计发现,隶属于聚类Ⅰ的泡菜水中以乳杆菌属和假单胞菌属为主,而隶属于聚类Ⅱ的泡菜水中以片球菌属和乳杆菌属为主。为进一步对两组泡菜水中细菌菌群的整体结构进行解析,本研究基于加权和非加权的Uni-Frac距离对两组泡菜水样品中的细菌群落结构进行分析,结果见图4。

图4 基于非加权(a)和加权(b)Uni-Frac距离的主坐标分析结果Fig. 4 Principal coordinate analysis results based on unweighted (a)and weighted (b) Uni-Frac distance
由图4可知,基于非加权的主坐标分析中,隶属于不同聚类的泡菜水样品在空间分布上具有明显的分离趋势,其中隶属于聚类Ⅰ的泡菜水样品主要集中在空间的对角线上,而隶属于聚类Ⅱ的泡菜水样品则主要集中在空间的右上角。经多元方差分析发现,隶属于不同聚类的泡菜水样品中的细菌群落结构差异极显著(P<0.01)。由图4亦可知,基于加权的主坐标分析中,隶属于聚类Ⅰ的泡菜水样品广泛分布在空间的各个部分,而隶属于聚类Ⅱ的泡菜水样品具有较高的收敛性,且全部位于聚类Ⅰ的95%置信区间内,经多元方差分析发现两组泡菜水样品细菌群落结构差异不显著(P>0.05)。由此可见,隶属于不同聚类的泡菜水样品可能均各自存在一些相对含量较低,但均为独特的细菌类群。但总体来说,汉中泡菜水样品的主要细菌类群是相同的,且隶属于聚类Ⅰ的泡菜水样品中主要细菌类群较为多元化,而聚类Ⅰ的泡菜水样品中细菌类群较为单一。在对β多样性进行分析的基础上,本研究同时对汉中泡菜水样品的4种α多样性指数进行比较分析,结果见图5。
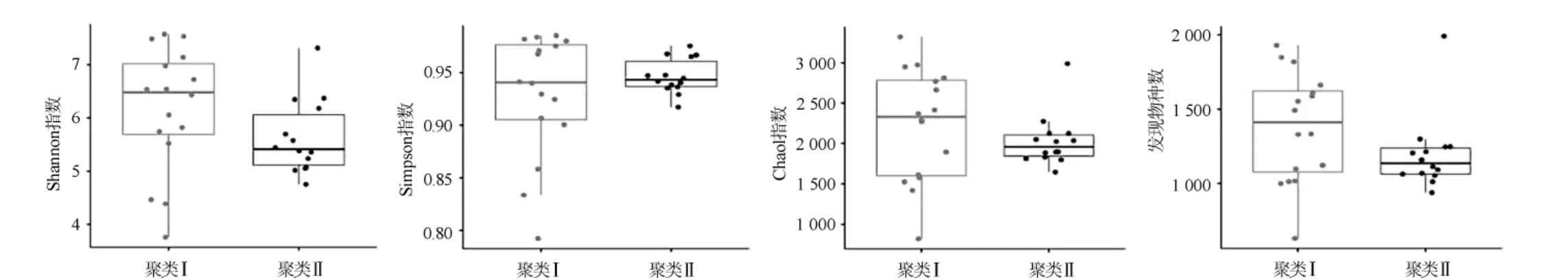
图5 不同聚类的泡菜水样品的α多样性指数比较结果Fig. 5 Comparison results of α diversity index of Paocai brine samples belonging to different clusters
由图5可知,经Wilcoxon检验发现,隶属于不同聚类泡菜水样品中的细菌类群在Shannon指数、Simpson指数、Chao1指数和发现物种数上均不具有显著性差异(P>0.05)。由此可见,汉中地区泡菜水样品中细菌的多样性和丰富度较为均一。在此基础上,本研究对优势细菌属在两聚类泡菜水样品中的相对含量进行Wilcoxon检验,结果见图6。
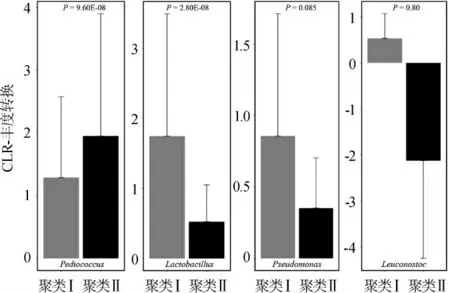
图6 不同聚类的泡菜水样品中优势细菌属相对含量的比较Fig. 6 Comparison of relative content of dominant bacteria genus in Paocai brine samples belonging to different clusters
由图6可知,汉中泡菜水中的4个优势细菌属,有2个优势细菌属在两组之间存在显著性差异(P<0.05),其分别为片球菌属和乳杆菌属。由图6亦可知,片球菌属在聚类Ⅰ中的相对含量显著低于聚类Ⅱ(P<0.05),而乳杆菌属在聚类Ⅰ中的相对含量显著高于聚类Ⅱ(P<0.05)。由此可见,尽管片球菌属和乳杆菌属作为汉中泡菜水中的主要菌属,但其相对含量存在显著差异,这可能也是导致汉中泡菜水隶属于两个聚类的重要原因之一。
近年来,关于发酵食品中微生物多样性的研究发现,不同地区的同一发酵食品中微生物的构成存在一定的差异,且相距越远,差距越大。对照采样信息发现,隶属于聚类Ⅰ的泡菜水样品大多采集自汉中地区的三个农村中,而隶属于聚类Ⅱ的泡菜水样品几乎全部来自于同一个村落中。这可能是导致汉中泡菜水中隶属于两个聚类的主要原因之一。而值得注意的是,聚类Ⅰ中的极个别样品并不属于那三个村落中,而这有可能是由泡菜的种类所导致的。相关研究显示,蔬菜(萝卜、辣椒和豇豆等)表面存在大量的乳酸菌[25],且不同的蔬菜表面存在的乳酸菌种类亦存在一定的差异,而这亦可能影响泡菜水中乳酸菌的种类和含量。
3 结论
本研究采用Illumina MiSeq高通量测序技术对陕西省汉中市泡菜水样品中的细菌多样性进行解析,结果表明,汉中地区泡菜水中的细菌主要隶属于24个细菌门的553个细菌属,其中优势细菌门为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),其平均相对含量分别为89.12%和7.89%;优势细菌属为片球菌属(Pediococcus)、乳杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)和明串珠菌属(Leuconostoc),其平均相对含量分别为52.06%、31.40%、4.89%和1.83%。基于属水平进行主坐标分析发现,所有汉中泡菜水样品可以划分为两个聚类;经Wilcoxon检验发现,隶属于不同聚类泡菜水样品的α多样性指数无显著性差异(P>0.05),但细菌菌群结构存在较大差异(P<0.05),且片球菌属和乳杆菌属的相对含量存在显著差异(P<0.05)。同时,不同聚类的泡菜水样品中均存在一些低丰度物种,且这些低丰度物种均为一些较为独特的细菌类群。
