肝移植术后并发结核性多浆膜腔积液1例报告
2021-03-03韩军伟吴广东
韩军伟 , 吴广东, 汤 睿, 陈 虹, 卢 倩
1 清华大学附属北京清华长庚医院 肝胆胰中心, 清华大学临床医学院, 清华大学精准医学研究院,北京 102218; 2 青海大学附属医院 肝胆胰外科, 西宁 810000
1 病例资料
患者男性,33岁。因“乙型肝炎后肝硬化失代偿期、肝肾综合征”于2018年5月5日在北京清华长庚医院行经典式原位肝移植术,手术顺利。术后病理提示:慢性病毒性肝炎,乙型;大小结节混合型肝硬化,活动期。术后常规给予他克莫司抗排异治疗,病情稳定后出院。2019年1月17日患者无明显诱因出现腹胀、腹痛、乏力,无恶心、呕吐,无腹泻、便秘,偶出现低热,最高37.4 ℃。查体:全身消瘦,贫血貌。腹膨隆,未见胃肠型及蠕动波,上腹部“人”字形切口愈合良好,可见腹壁浅表静脉曲张,血流方向由脐向四周放射。移动性浊音阳性,腹壁张力高,全腹未触及明显压痛、反跳痛及肌紧张。肝肋下未触及,脾肋下5 cm,质韧,边缘圆钝,移动性欠佳,无压痛,肠鸣音3次/min。双下肢凹陷性水肿。血常规:WBC 1.61×109/L,Hb 77 g/L,PLT 42×109/L,中性粒细胞绝对值1.09×109/L;肝功能:ALT 13.7 U/L,AST 12 U/L,ALP 110 U/L,GGT 118 U/L,TBil 7.9 μmol/L,DBil 4.7 μmol/L,白蛋白30.3 g/L,胆碱酯酶3351 U/L;肾功能:血尿素氮(BUN)51 mmol/L,血肌酐(Cre)583.9 μmol/L(术前肾功能BUN 29.76 mmol/L,Cre 161.3 μmol/L)。腹水普通细菌培养、抗酸染色、TB-PCR测定及CA-125测定等均阴性。腹水生化示:总蛋白31.3 g/L,腺苷脱氨酶10.2 U/L,葡萄糖2.09 g/L;腹水常规:浑浊微黄色,比重1.020,红细胞总数4000 μl,白细胞总数106 μl,有核细胞总数110 μl,单核88.7%,Rivalta试验阴性;腹水中未见肿瘤细胞。胸水、心包积液相关检验结果与腹水大致相同。胸腹CT示(图1a~c):(1)大量腹盆腔积液、右侧胸腔积液、心包积液;(2)脾大;(3)腹膜炎。腹部超声提示:(1)移植肝未见明显异常;(2)门静脉及脾静脉增宽(图1d);(3)脾大;(4)腹腔积液。给予抗感染、升高白细胞、利尿及放胸腹水等治疗后,患者症状加重。2019年1月26日患者因“脾大、腹腔感染”行脾切除术、肠黏连松解术,术中见:肠黏连致密,呈“腹茧症”,游离黏连,可见多发包裹性积液,脾脏增大,表面见多发白色梗死灶(免疫组化:CD68-514H12,抗酸染色阴性)。术后给予替加环素+美罗培南抗感染、透析、补充白蛋白、放胸腹水等治疗,并逐渐将他克莫司改为西罗莫司。2019年2月20日后患者反复出现低热,以午后为主,体温波动在36.7 ℃~37.6 ℃,伴夜间大汗淋漓。降钙素原、CRP明显增高。多次复查血γ-干扰素释放试验、胸腹水TB-PCR测定及痰抗酸杆菌培养等结核相关检查均阴性。将抗生素改用亚胺培南和莫西沙星,并加用氟康唑、更昔洛韦治疗后症状稍减轻,胸腹盆腔积液及心包积液仍持续存在(图2)。

注:a,胸部CT可见右侧胸腔少量积液,右下肺部分膨胀不全,心影饱满;b、c,“原位肝移植术后”改变,门静脉宽度3.7 cm,大量腹腔积液,脾大,腹膜增厚;d,超声示脾静脉增宽,约1.9 cm。
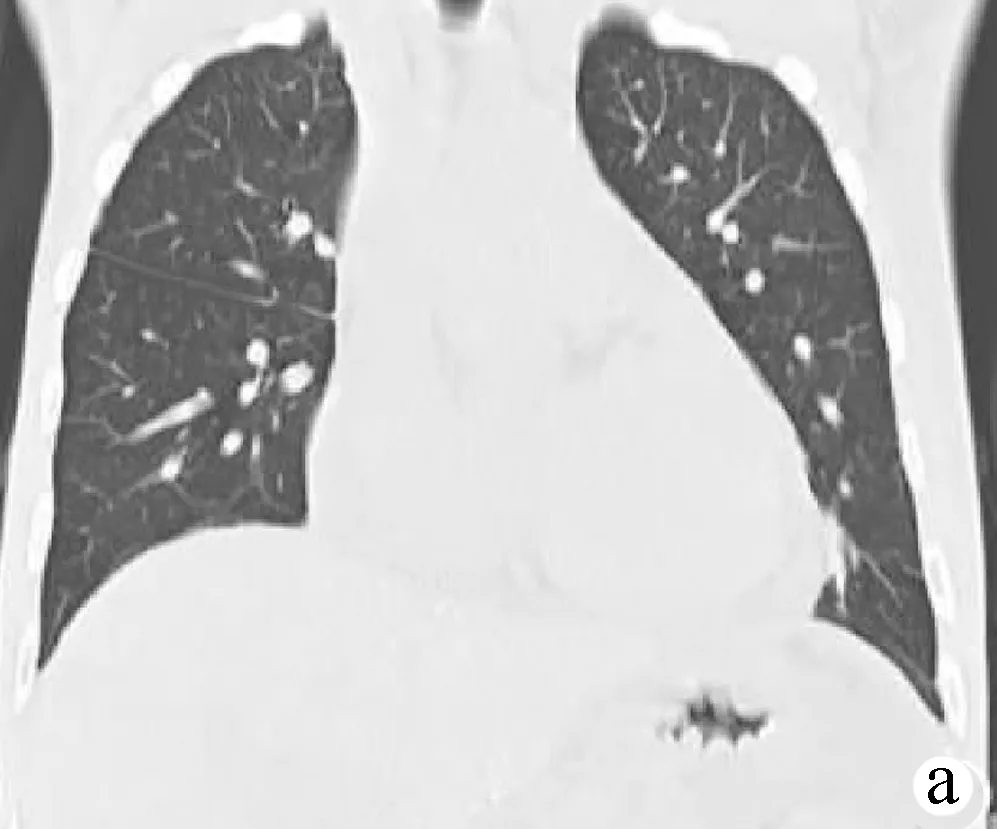
注:a,双侧胸腔引流管置入术后,每日引流液体左侧约200 ml,右侧约150 ml,心包积液较前增多,双肺可见索条影;b,腹腔引流管置入术后,每日引流液体300~500 ml。
于2019年4月18日给予异烟肼片+利福喷丁胶囊+利奈唑胺片+莫西沙星片抗结核治疗,并继续给予放胸腹水、透析、输注白蛋白等治疗。3周后患者发热次数、盗汗症状及胸腹腔引流明显减少,逐渐拔除胸腔及腹腔引流管。2019年5月27日复查胸腹部CT提示双侧胸腔积液及腹腔积液基本消失,心包积液稍减少(图3a、b)。2019年6月18日再次复查胸部CT提示心包积液基本吸收(图3c),同时改异烟肼为帕司烟肼。2019年8月14日停用利奈唑胺及莫西沙星,继续给予利福喷丁胶囊及帕司烟肼。后多次复查胸腹盆腔及心包积液未再出现,发热、盗汗等症状消失,于2020年2月停用抗结核药物,继续行透析治疗,等待行肾移植术。
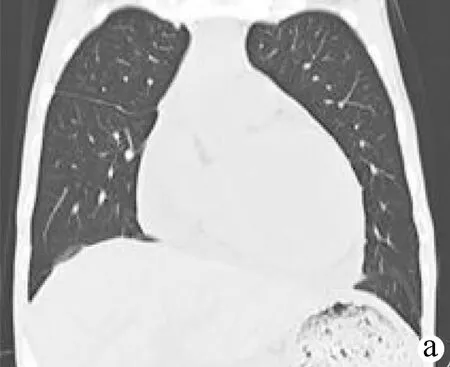
注:a、b,抗结核5周后,双侧胸腔引流管已拔除,双侧胸腔积液基本消失,双肺见少量小片状影,左下肺见索条影,左心室增大,心包积液较前稍减少,腹盆腔积液基本消失;c,抗结核8周后,心包积液基本吸收,双下肺见索条影,左心增大较前减轻。
2 讨论
多浆膜腔积液是指患者同时或相继出现胸腔积液、腹水、心包积液[1],常见的病因为恶性肿瘤、结缔组织疾病、结核等,而结核性多浆膜腔积液为肝移植术后少见的并发症。肝移植受者由于长期服用免疫抑制剂,免疫功能低下[2-4],各种致病菌感染的风险显著增加[5],尤其是结核杆菌感染[2]。有文献[2]报道肝移植术后结核感染发生率明显增高,并发结核感染时间为移植术后4~20个月,大多发生于术后1年内,其中肺部为最常见感染部位[6]。此外,由于免疫抑制剂的使用,患者结核感染后临床症状均不典型[2,4,7],多数仅表现为不明原因发热。若患者出现不明原因发热,尤其是常规抗细菌、真菌治疗无效时需要警惕结核感染可能性,必要时可进行诊断性治疗4~8周[2]。同时,结核菌素试验、γ-干扰素释放试验、结核感染T细胞斑点检测试验、腺苷脱氨酶等常为假阴性[2-3]。若肺部结核感染,移植术后患者的影像学表现也可不典型[2],结节、条索状、粟粒样均可见,空洞性变化较少见。回顾本病例,患者青年男性,肝移植术后6个月持续出现胸腹腔积液,而无心包积液,经积液引流、补充白蛋白、利尿等治疗后基本消失。术后第9个月时出现胸腹盆腔及心包积液,此时可能已经发生肺结核和/或腹膜结核可能,由于结核相关检查指标出现假阴性,且症状不典型,未予行抗结核治疗。随着患者腹痛加重,腹膜刺激征明显,考虑长期消耗及使用免疫抑制剂,患者免疫力低下,并发腹腔感染。脾切除术后胸腹盆积液、痰液及血滤导管末端间断培养出普通细菌或真菌生长,给予敏感广谱抗生素,同时行血液透析、放胸腹水、补充白蛋白等治疗,虽然相关感染指标及患者症状好转,但低热、盗汗及胸腹盆腔、心包积液仍存在。在排除腹腔肿瘤、心源性、肝源性、结缔组织性及内分泌原因等疾病引起的胸腹水后,给予异烟肼、利福喷丁、利奈唑胺、莫西沙星抗结核治疗,2个月后将异烟肼改为肝肾损害较小的帕司烟肼,4个月后停用利奈唑胺及莫西沙星,继续使用帕司烟肼和利福喷丁7个月。在治疗起始阶段,即使在肝功能正常情况下也给予口服保肝药物降低药物的肝毒性[8],密切监测肝功能,及时调整抗排异药物剂量。另外,由于长期多浆膜腔积液反复放胸腹水导致肾血流量不足,免疫抑制剂及抗结核药物的使用加重了肾损害,最终导致肾衰竭。患者抗结核治疗的同时,在肾内科辅助下行血液透析改善肾功能,尽量避免使用具有肾毒性的药物,并动态监测肾功能变化。经抗结核治疗后,除肾功能外,各项指标趋于正常及稳定状态,继续行血液透析,等待肾源,进一步行肾移植治疗。
综上,在肝移植术后使用大量免疫抑制剂,导致患者免疫功能低下,结核引起的机会性感染明显增加,并且症状及影像学表现不典型,各种结核相关检查常为假阴性,因此,应尽早地试用性抗结核治疗,排除结核感染可能。此外,免疫抑制剂及抗结核药物具有肝毒性,可加重肾损害,尤其是对伴有肾功能不全的患者,应密切关注肾功能的变化,避免进一步加重,引起肾功能衰竭。
作者贡献声明:韩军伟、吴广东、汤睿负责课题设计,资料分析,撰写论文;韩军伟、吴广东参与收集数据,修改论文;卢倩、陈虹负责拟定写作思路,指导撰写文章并最后定稿。
