慢性HBV感染免疫耐受期应否治疗?
2021-03-03庄辉
庄 辉
北京大学 基础医学院病原生物学系和感染病研究中心, 北京 100191
据估计,全球慢性HBV感染者约2.92亿人,其中免疫耐受期患者约1.98亿[1]。我国慢性HBV感染者约8600万例,其中免疫耐受期患者约3230万[1]。
目前美国[2]、欧洲[3]和亚太[4]肝病学会发布的慢性乙型肝炎(CHB)诊治指南(以下简称美国指南、欧洲指南和亚太指南)关于免疫耐受期CHB(IT-CHB)患者的定义及治疗的推荐意见不完全一致:美国指南[2]中ALT正常值上限(ULN)男性为30 U/L,女性为25 U/L;欧洲和亚太指南中ALT ULN男女均为40 U/L。关于IT-CHB定义,美国指南:HBV DNA>106IU/ml,ALT正常;欧洲指南:HBV DNA>107IU/ml,ALT持续正常;亚太指南:HBV DNA>20 000 IU/ml,ALT 1~2×ULN。关于IT-CHB治疗的推荐意见,美国和亚太指南均只推荐对肝活检显示中度/重度炎症(A3)或明显纤维化(F2)的IT-CHB患者治疗;欧洲指南则推荐扩大IT-CHB治疗指征:即年龄>30岁,或有肝细胞癌(HCC)/肝硬化家族史,或有肝外表现的IT-CHB患者,即使ALT和肝活检正常,也可以治疗。
2020年5月,Jeng等[5]在“应否扩大CHB治疗指征”一文中提出,对有活动性/进展性肝病证据的灰区(即HBV DNA<106IU/ml)或年龄>40岁的IT-CHB患者进行抗病毒治疗,较美国指南扩大了治疗指征。2020年9月,中国韩国和日本10名专家联合发表关于启动CHB治疗东亚专家意见[6],推荐ALT ULN男性为30 U/L,女性为19 U/L,对ALT≥1×ULN患者,推荐抗病毒治疗。该专家意见扩大了相当一部分IT-CHB患者的抗病毒治疗。
美国、欧洲和亚太指南不推荐对IT-CHB治疗的理由是:(1)IT-CHB是良性疾病期,不发生肝硬化和HCC或发生率很低[7-12];(2)IT-CHB患者的肝组织学无或轻微炎症和/或纤维化[2,9,13-14];(3)治疗效果差,很少发生HBeAg血清学转换或HBsAg消失[5,15-19];可自发免疫控制达到HBeAg血清学转换[8,20-21];(4)IT-CHB患者多为青年人,对长期抗病毒治疗依从性差,易发生耐药[12,22]。
2015年,Bertoletti等[23]对HBV感染免疫耐受期概念提出异议,认为这是老概念,缺乏免疫学证据。2016年,Gastroenterology杂志组织专家对“免疫耐受期概念”进行了讨论[24-28]。Bertoletti等[23-25,28]认为不应称为IT-CHB,建议改为“高复制低炎症期(HRLI)”,理由是:(1)在胎儿早期已存在效应和调节免疫应答;(2)新生儿和婴儿可产生病毒特异性T淋巴细胞应答;(3)新生儿和婴儿的免疫系统本身并无缺陷;(4)儿童在1岁内注射乙型肝炎疫苗有效;(5)不同期乙型肝炎患者(包括免疫耐受期)均有HBV特异性T淋巴细胞应答、HBV DNA整合和克隆肝细胞扩增,说明肝癌发生已经启动。但Milich[26]和Liaw等[27]认为将IT-CHB改名为HRLI的证据尚不充分。2017年欧洲指南首先将IT-CHB正式改名为“HBeAg阳性慢性HBV感染”。
自2018年以来,特别是2020年,多位学者[29-33]提出,应对HBV免疫耐受期患者治疗,以降低其发生肝硬化和HCC的风险,理由如下。
1 IT-CHB不是良性疾病期,如不治疗,可进展为肝硬化和HCC
Mason等[24]检测26例慢性HBV感染者,其中9例IT-CHB患者、10例HBeAg阳性CHB患者、7例HBeAg阴性CHB患者,发现IT-CHB患者与HBeAg阳性和阴性CHB患者一样,也可检测到HBV DNA整合、肝细胞突变、克隆肝细胞扩增、HBV特异性T淋巴细胞应答以及肝脏损伤。Chu等[8]随访240例IT-CHB患者17年,肝硬化累积发生率为12.6%。Chen等[34]随访251例IT-CHB患者13年,HCC累积发生率为5.1%。Beasley等[35]前瞻性随访22 707例40~59岁中国台湾男性,其中15.2%为HBsAg携带者,平均随访3.3年,HBsAg携带者的HCC发病率(1158/10万人年)显著高于非携带者(5/10万人年)。Sun等[36]分析我国161个疾病监测点1990年—2014年的HCC死亡率资料发现,无论是城市还是农村,男性和女性HCC死亡率均随年龄增长而明显升高,特别是在30岁以后(图1)。HCC的发生是一个长期发展致病过程,说明早在30岁以前HCC发生已经启动[35]。
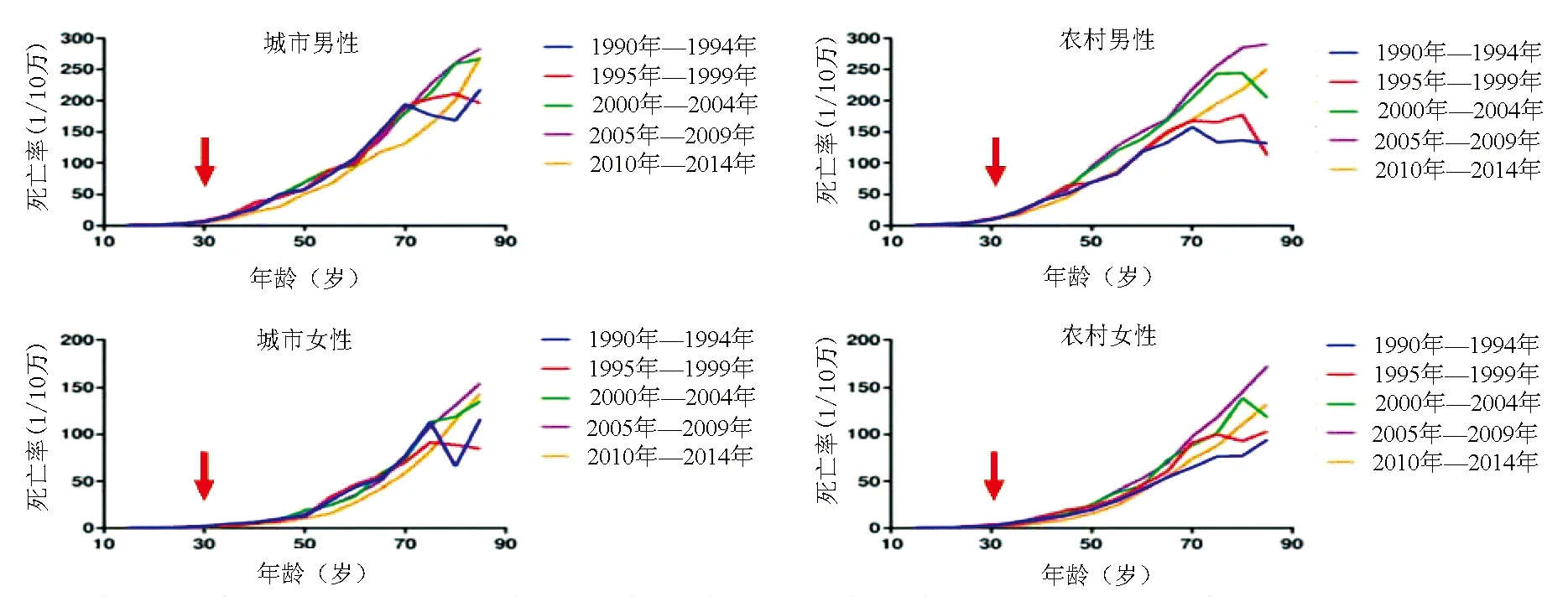
图1 我国1990年—2014年161个疾病监测点城乡男女HCC年龄死亡专率[36]
Kim等[37]分析韩国一所三甲医院2000年—2013年病例队列,其中未治疗的IT-CHB患者413例、核苷(酸)类似物(NAs)治疗的免疫活动期CHB患者1497例,结果显示,未治疗的IT-CHB患者10年累积HCC发病率和死亡/肝移植发生率(分别为12.7%和9.7%)显著高于治疗的免疫活动期CHB患者(分别为6.1%和3.4%)(P值分别为0.001、0.001)。
2 相当一部分IT-CHB患者有明显的肝细胞炎症坏死和肝纤维化病理学改变
既往虽有报道[2,9,13-14],IT-CHB患者的肝组织学无或轻微炎症和/或纤维化,但近年来有多篇报道[9,38-44]表明,28%~49%的IT-CHB患者有明显的肝细胞炎症坏死和肝纤维化(≥G2/S2)病理学改变(表1)。

表1 ALT持续正常的IT-CHB患者有明显肝细胞炎症坏死和肝纤维化病理学改变
3 NAs治疗IT-CHB患者可显著降低血清HBV DNA
既往曾报道[5,15-19],IT-CHB患者接受抗病毒治疗效果较差,很少发生HBeAg血清学转换或HBsAg消失。但近年来有多项研究[45-47]显示,应用NAs治疗IT-CHB患者,虽然HBeAg血清学转换或HBsAg消失率低,但降低血清HBV DNA水平效果显著。Chan等[45]用替诺福韦酯(TDF)或TDF/恩曲他滨(FTC)分别治疗64例和62例IT-CHB患者,平均年龄为33岁,89%为亚洲人,B和C基因型占93%,99%为HBeAg阳性,HBV DNA水平为8.41 log10IU/ml,治疗至192周时,TDF组55%(35/64)、TDF/FTC组76%(47/62) 患者的HBV DNA水平降至<69 IU/ml,与基线比较有显著差异(P=0.016)。Pan等[46]和Jourdain等[47]先后在IT-CHB孕妇中,开展TDF预防HBV母婴传播的随机对照研究,将IT-CHB孕妇随机分为治疗组和对照组,Pan等[46]于孕30~32周至产后4周,Jourdain等[47]于孕28周至产后2周,分别给予各组孕妇TDF或安慰剂,分娩时(即治疗8~12周)检测所有孕妇HBV DNA,结果显示TDF组HBV DNA水平分别下降4.7 log IU/ml和4.0 log IU/ml,而安慰剂组HBV DNA水平无下降,仍维持在基线水平。韩国Chang等[48]开展了一项全国性多中心回顾性研究,分析2006年1月—2016年3月韩国8所大型医院共计484例IT-CHB患者(HBeAg阳性、HBV DNA水平>20 000 IU/ml,ALT水平<40 U/L、无肝硬化),其中87例接受抗病毒治疗,397例未接受抗病毒治疗作为对照,经倾向记分配对分析,10年间治疗组累积HCC及肝硬化发生率显著低于对照组(P值分别为0.046、0.015)(图2)。

图2 韩国多中心IT-CHB患者抗病毒治疗回顾性分析HCC及肝硬化累积发生率[48]
HBV DNA水平是HCC发生的独立危险因素,降低血清HBV DNA水平可显著减少HCC发生风险。Chen等[49]对基于社区1991年—1992年入组的3653例(30~65岁)HBsAg阳性者前瞻性队列,平均随访11.4年,发现其累积HCC发生率与入组时HBV DNA水平有关,入组时HBV DNA水平<300、300~9999、10 000~99 999、100 000~999 999和≥1 000 000 拷贝/ml患者HCC累积发生率分别为1.30%、1.37%、3.57%、12.17%和14.89%,随HBV DNA水平上升而显著升高。
各国指南[2-4,50]指出,治疗CHB的目的是:最大限度地长期抑制HBV复制,减轻肝细胞炎症坏死及肝脏纤维组织增生,延缓和减少肝功能衰竭、肝硬化失代偿、HCC和其他并发症的发生,改善患者生活质量,延长其生存时间,而不仅仅是为了个别HBV标志物的转换或消失。因此,从降低肝硬化和HCC风险来看,NAs治疗IT-CHB患者的效果是显著的。
4 扩大对IT-CHB患者治疗的其他理由
(1)现有乙型肝炎口服抗病毒药物恩替卡韦(ETV)、TDF、富马酸丙酚替诺福韦(TAF)长期治疗安全性好、耐药发生率低[51-59]:ETV 5年累积耐药发生率仅为1.2%[53];TDF 8年未发现耐药[55];TAF 3年无耐药[58-59]。
(2)长期治疗依从性差,不能作为不治疗的理由,因CHB患者和其他慢性疾病患者也需长期治疗,治疗的依从性可通过健康教育等措施提高[31,60-61]。
(3)治疗性价比高。目前乙型肝炎抗病毒药物的治疗费用低于监测费用,且IT-CHB患者对监测依从性差。据报道[19,62],约61%的HCC患者为首次就诊,说明这些患者既往未接受监测。
(4)对IT-CHB患者抗病毒治疗可降低HBV水平传播和母婴传播,并可减少乙型肝炎歧视[46-47,63-64]。
(5)对IT-CHB患者治疗可提高乙型肝炎诊断率和治疗率[30,32,65],实现世界卫生组织提出的到2030年消除乙型肝炎公共卫生威胁的目标[66]。
5 小结
鉴于(1) IT-CHB不是良性疾病期;(2)对IT-CHB患者治疗可降低肝硬化和HCC的发生;(3)一线药物抗病毒能力强,耐药发生率低,长期治疗安全有效;(4)治疗费用低于监测费用,性价比高;(5)可降低HBV水平传播和母婴传播,减少乙型肝炎歧视;(6)可提高乙型肝炎诊断率和治疗率,实现世界卫生组织提出的到2030年消除乙型肝炎公共威胁的目标。因此,应扩大对IT-CHB患者的治疗。同时,应开展对IT-CHB患者治疗的研究,提供更多的循证医学证据,如(1)回顾性前瞻性队列研究:比较IT-CHB治疗组、未治疗组和HBeAg阳性免疫活动性乙型肝炎治疗组累积肝硬化发生率、HCC发病率、肝移植率及死亡率;(2)前瞻性队列研究:比较3组累积肝硬化发生率、HCC发病率、肝移植率及死亡率;(3)随机对照研究:比较2组累积肝硬化发生率、HCC发病率、肝移植率及死亡率等。
