miR-130a-3p靶向TRIM37蛋白缓解H2O2诱导的心肌损伤*
2021-03-02许德星张静怡万发银戴若竹
许德星,王 伟,张静怡,万发银,戴若竹
福建省泉州市第一医院(福建医科大学附属泉州第一医院)心内科,泉州 362000
随着人们生活方式的改变和人口老龄化的加剧,心血管疾病已成为世界范围内威胁人类健康甚至导致死亡的主要原因之一[1]。近年来,我国心血管疾病的患病率和死亡率亦逐年上升且呈年轻化趋势。根据《中国心血管病报告2018》,我国心血管疾病患者人数已达2.9亿,包括高血压、冠心病、脑卒中、心力衰竭以及其他各类心脏病,是目前城乡居民死亡的首要原因[2]。因此,深入研究心血管疾病发病的相关机制并寻找有效的干预方法或治疗靶点具有重要意义。
大量研究表明,氧化应激是心血管疾病的重要致病因素之一。当机体遭受有害刺激时,大量的氧自由基、活性氧(reactive oxygen species,ROS)等在体内堆积,抗氧化系统受损,进而导致心肌细胞损伤,凋亡水平升高[3]。微小RNA(microRNAs,miRNAs)是一类长度约为22个核苷酸的内源性非编码单链RNA分子,可在转录后水平与靶mRNA 3′/5′UTR中的6~8个碱基结合,进而抑制蛋白质翻译,发挥沉默基因表达的效应[4-5]。目前,miRNAs已被证明广泛参与了细胞增殖、凋亡、分化等一系列进程,并且在心血管疾病的进展过程中亦发挥了重要作用[6-7]。已有研究表明,miR-130a-3p具有缓解心肌肥大的作用[8]。此外,miR-130a-3p亦被证实在心肌梗死后的心肌细胞中显著低表达[9],提示其在心血管疾病中可能具有重要作用。
近年来,作为三结构域(tripartite motif,TRIM)蛋白家族的成员之一,TRIM37已被证明在细胞增殖、凋亡、转导等过程中发挥了重要作用[10]。然而,TRIM37在心血管疾病中的研究尚未见报道。本研究通过建立H2O2诱导的心肌细胞氧化应激损伤模型,探讨miR-130a-3p通过靶向调控TRIM37表达进而影响心肌细胞损伤和凋亡的内在机制,以期为临床氧化应激相关心血管疾病的诊断和治疗提供新的靶点。
1 材料与方法
1.1 细胞
小鼠的心肌细胞系HL-1购自中国科学院上海细胞库。
1.2 主要实验材料
DMEM培养液和胎牛血清购自美国Gibco公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自南京建成生物工程研究所有限公司;CCK8试剂盒、RIPA蛋白裂解液、BCA蛋白检测试剂盒、TUNEL细胞凋亡检测试剂盒购于上海碧云天生物技术有限公司;引物购自上海生工生物科技公司;Trizol试剂、LipofectamineTM2000试剂盒购自美国Invitrogen公司;miR-130a-3p模拟物(miR-130a-3p mimics)及其阴性对照(miR-NC)、TRIM37过表达载体(pcDNA-TRIM37)及其阴性对照(pcDNA-NC)均购于上海吉玛基因公司;SYBR Green qPCR试剂盒购自大连TaKaRa公司;双荧光素酶检测试剂盒购自美国Promega公司;抗Bcl-2、Bax、Cleaved Caspase-3、Caspase-3、Cleaved Caspase-9、Caspase-9、GAPDH抗体及对应二抗购于美国Abcam公司。
1.3 细胞培养和建立氧化应激模型
HL-1细胞使用DMEM完全培养液(含10%胎牛血清+1%链霉素-青霉素)于37℃,5%CO2的培养箱中进行常规培养,隔天换液,每3天进行传代1次,选择对数生长期的细胞进行后续实验。
建立氧化应激模型:分别将含有终浓度为0.1 mmol/L H2O2的培养液孵育HL-1细胞3、6、9 h,筛选最佳孵育时间。
1.4 实验分组
胰酶消化收集细胞悬液,细胞计数后按每孔5×105个细胞接种于6孔板,常规培养过夜后,使用LipofectamineTM2000转染试剂并按照对应说明书将miR-130a-3p模拟物(miR-130a-3p mimics)及其阴性对照(miR-NC)或TRIM37过表达载体(pc-TRIM37)及其阴性对照(pcDNA3.1)转染或共转染至细胞内。实验分为6组,①对照组:HL-1细胞常规培养;②H2O2组:HL-1细胞使用H2O2孵育3 h处理;③miR-NC组:HL-1细胞转染miR-130a-3p模拟物阴性对照后使用H2O2孵育3 h;④miR-130a-3p mimics组:HL-1细胞转染miR-130a-3p模拟物后使用H2O2孵育3 h;⑤miR-130a-3p mimics+pcDNA3.1组:HL-1细胞共转染miR-130a-3p模拟物和pcDNA3.1空载体后使用H2O2孵育3 h;⑥miR-130a-3p mimics+pc-TRIM37组:HL-1细胞共转染miR-130a-3p模拟物和TRIM37过表达载体后使用H2O2孵育3 h。
1.5 CCK8法进行细胞活力检测
将HL-1细胞按照5×103个/孔接种于96孔板,按照分组处理后,继续培养24 h,各孔分别加入20 μL CCK8试剂,培养箱孵育2 h后使用酶标仪测定细胞在450 nm处的吸光度值(A),计算细胞活力。
1.6 TUNEL法检测细胞凋亡
HL-1细胞按照分组处理后,使用4%多聚甲醛室温固定30 min,0.5%Triton X-100通透20 min。PBS洗涤后加入TUNEL反应混合液37℃避光孵育1 h。DAPI避光染核5~10 min,PBS洗涤后使用荧光显微镜拍照,Image J软件统计TUNEL阳性细胞数。
1.7 比色法检测细胞LDH释放
收集各组细胞上清,使用商品化LDH试剂盒并按照说明书步骤操作,检测细胞上清中LDH活性。
1.8 荧光定量PCR检测细胞miR-130a-3p的mRNA水平
各组细胞干预后以PBS洗涤,Trizol法提取总RNA,检测RNA浓度和纯度,甲醛变性胶电泳评价RNA降解,逆转录成cDNA。以cDNA为模板通过SYBR Green qPCR试剂盒进行荧光定量PCR扩增,采用2-ΔΔCt法计算miR-130a-3p的丰度。引物序列如表1所示。
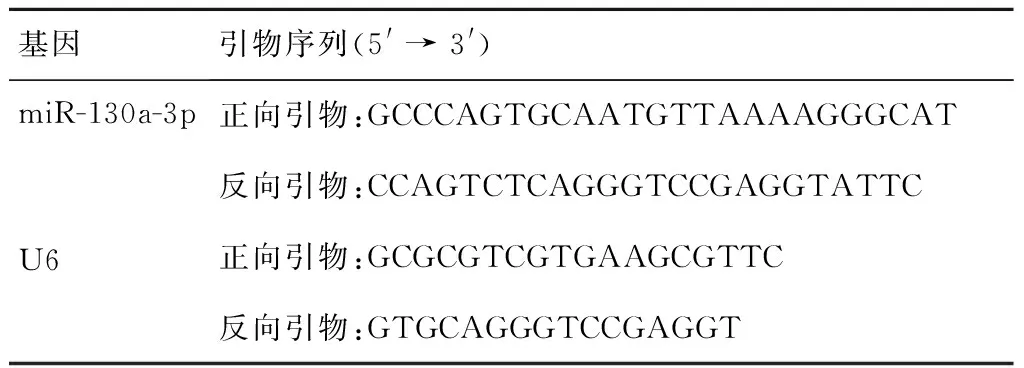
表1 引物序列Table 1 Primer sequences
1.9 Western blot检测细胞TRIM37及凋亡相关蛋白的表达
各组细胞干预后,PBS洗涤,加入含有蛋白酶抑制剂的RIPA裂解液于冰上充分裂解,超声后离心得总蛋白,BCA法进行蛋白定量后加入十二烷基磺酸钠(SDS)进行蛋白变性。分别通过SDS-PAGE电泳、湿法转膜、BSA封闭后加一抗4℃孵育过夜,次日使用TBST洗膜3次,加二抗室温孵育1.5 h,TBST洗膜3次,ECL发光显影,根据灰度值计算Bcl-2、Bax、Cleaved Caspase-3、Caspase-3、Cleaved Caspase-9、Caspase-9蛋白的相对表达水平。
1.10 双荧光素酶报告基因
采用生物信息学网站预测miR-130a-3p与TRIM37的互补结合位点,将该片段插入荧光素酶报告基因载体上,构建TRIM37野生型重组报告基因载体(TRIM37-WT),将结合位点定点突变后插入并构建突变型报告基因载体(TRIM37-MUT)。使用LipofectamineTM2000转染试剂分别将TRIM37-WT、TRIM37-MUT载体与miR-130a-3p mimics、miR-NC共转染至HL-1细胞,转染48 h后,采用双荧光素酶报告系统评价细胞的荧光素酶活性。
1.11 统计学方法

2 结果
2.1 HL-1心肌细胞使用H2O2刺激不同时间后miR-130a-3p相对表达量的变化
为筛选建立氧化应激模型过程中H2O2的最佳刺激时间,采用qPCR检测不同刺激时间后HL-1心肌细胞内miR-130a-3p相对表达量的变化(图1)。结果显示,H2O2刺激不同时间后HL-1细胞内miR-130a-3p的表达均显著降低(均P<0.01),其中刺激3 h后miR-130a-3p水平最低,因此选择3 h刺激时间进行后续实验。
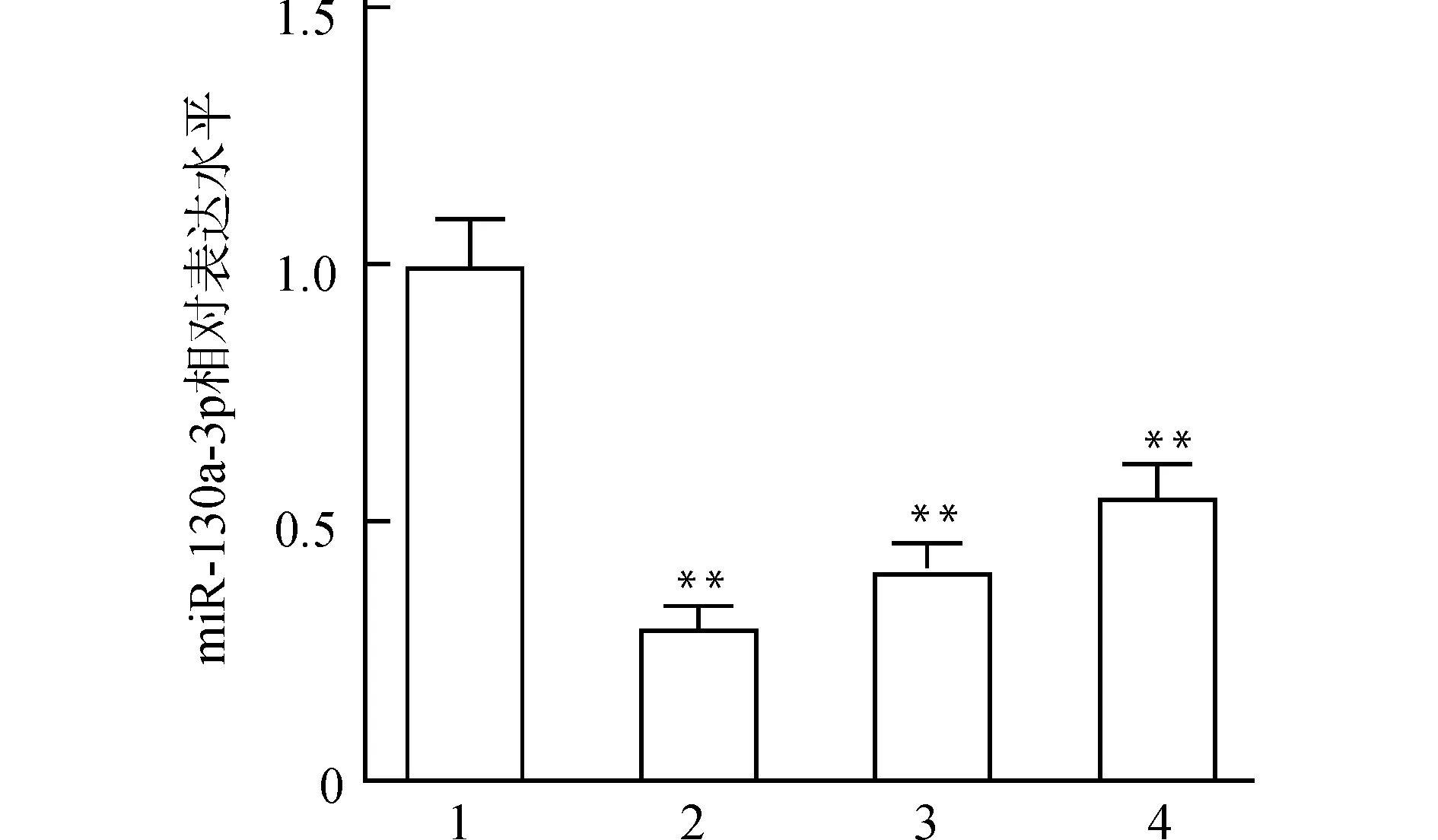
1:对照组;2:H2O2刺激3 h;3:H2O2刺激6 h;4:H2O2刺激12 h;与对照组比较,**P<0.01图1 H2O2刺激HL-1心肌细胞后miR-130a-3p的表达水平Fig.1 miR-130a-3p levels in HL-1 cardiomyocytes after H2O2stimulation
2.2 miR-130a-3p对H2O2诱导的HL-1心肌细胞活力及LDH释放的影响
为验证miR-130a-3p对心肌细胞氧化应激损伤的影响,采用qPCR检测H2O2刺激及转染miR-130a-3p模拟物后细胞miR-130a-3p的表达(图2A)。结果显示,与对照组比较,H2O2刺激组及miR-NC组中miR-130a-3p表达显著下调(均P<0.01),而与H2O2+miR-NC组比较,H2O2+miR-130a-3p mimics组中miR-130a-3p表达明显上调(P<0.01)。CCK-8法(图2B)和LDH比色法(图2C)分别检测细胞活力和LDH水平的变化。与对照组相比,H2O2刺激组及miR-NC组细胞活力均显著降低(均P<0.01)、LDH水平显著升高(均P<0.01);而与H2O2+miR-NC组比较,H2O2+miR-130a-3p mimics组中细胞活力显著升高(P<0.01)、LDH水平显著降低(P<0.01)。提示miR-130a-3p过表达能够显著恢复H2O2诱导的心肌细胞活力和减轻氧化应激损伤。
2.3 miR-130a-3p对H2O2诱导的HL-1心肌细胞凋亡的影响
运用TUNEL法检测心肌细胞凋亡情况(图3A、3B)并通过Western blot检测凋亡相关蛋白的表达(图3C、3D)。结果显示,对照组TUNEL阳性细胞数较少,H2O2刺激组及miR-NC组TUNEL阳性细胞比例显著增加(均P<0.01),Bax、Cleaved Caspase-3、Cleaved Caspase-9水平升高(均P<0.01),Bcl-2水平降低(P<0.01);而H2O2+miR-130a-3p mimics组TUNEL阳性细胞比例较H2O2+miR-NC组明显下降(P<0.01),Bax(P<0.05)、Cleaved Caspase-3、Cleaved Caspase-9水平降低(均P<0.01),Bcl-2水平升高(P<0.01)。提示miR-130a-3p过表达能显著抑制H2O2诱导的心肌细胞凋亡。

A:细胞miR-130a-3p的表达;B:CCK-8法检测细胞活力;C:LDH比色法检测LDH释放量;1:对照组;2:H2O2组;3:H2O2+miR-NC组;4:H2O2+miR-130a-3p mimics组;与对照组比较,**P<0.01;与H2O2+miR-NC组比较,##P<0.01图2 miR-130a-3p过表达对H2O2诱导的HL-1细胞活力和LDH释放的影响Fig.2 Effects of miR-130a-3p overexpression on cell viability and LDH release in H2O2-induced HL-1 cells

A、B:心肌细胞凋亡情况;C、D:凋亡相关蛋白的表达;1:对照组;2:H2O2组;3:H2O2+miR-NC组;4:H2O2+miR-130a-3p mimics组;与对照组比较,**P<0.01;与H2O2+miR-NC组比较,#P<0.05 ##P<0.01图3 miR-130a-3p过表达对H2O2诱导的HL-1细胞凋亡的影响Fig.3 Effects of miR-130a-3p overexpression on the apoptosis of H2O2-induced HL-1 cells
2.4 H2O2刺激不同时间后TRIM37蛋白表达水平的变化
采用Western blot检测不同刺激时间后HL-1心肌细胞内TRIM37蛋白相对表达量的变化(图4),结果显示,H2O2刺激不同时间后HL-1细胞内TRIM37蛋白的表达均较对照组显著升高(均P<0.01),其中刺激3 h后TRIM37蛋白水平最高。

1:对照组;2:H2O2刺激3 h;3:H2O2刺激6 h;4:H2O2刺激12 h;与对照组比较,**P<0.01图4 H2O2刺激HL-1心肌细胞3、6、12 h后TRIM37蛋白的表达水平Fig.4 TRIM37 levels in HL-1 cardiomyocytes after H2O2stimulation for 3,6,12 h
2.5 miR-130a-3p靶向抑制TRIM37的表达
经starBase生物信息学网站预测miR-130a-3p与TRIM37的结合位点(图5A),随后进一步采用双荧光素酶报告基因验证两者的结合关系(图5B)。为进一步验证miR-130a-3p对TRIM37的抑制作用,从蛋白水平检测TRIM37的表达量,结果显示(图5C),转染miR-130a-3p mimics能显著抑制细胞TRIM37蛋白的表达水平(P<0.01),提示miR-130a-3p可与TRIM37相结合,进而抑制TRIM37的表达。
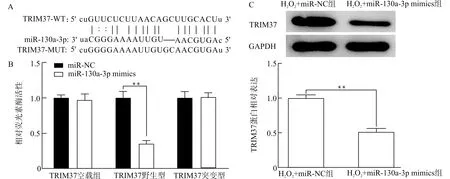
A:预测miR-130a-3p与TRIM37的结合位点;B:验证两者的结合关系;C:验证miR-130a-3p对TRIM37的抑制作用;**P<0.01图5 miR-130a-3p与TRIM37基因的靶向验证Fig.5 Target verification of miR-130a-3p and TRIM37
2.6 TRIM37过表达逆转了miR-130a-3p对HL-1心肌细胞活力及LDH释放的影响
为进一步验证miR-130a-3p对HL-1细胞活力和氧化应激的作用是否与TRIM37有关,采用TRIM37过表达作为回复实验。Western blot结果显示(图6A),与miR-130a-3p mimics+pcDNA3.1组比较,miR-130a-3p mimics+pc-TRIM37组细胞中TRIM37蛋白的表达水平显著上调(P<0.01)。CCK-8法(图6B)和LDH比色法(图6C)结果显示,与miR-130a-3p mimics+pcDNA3.1组比较,miR-130a-3p mimics+pc-TRIM37组细胞活力显著降低(P<0.01)、LDH水平显著升高(P<0.01),提示TRIM37过表达可部分抵消miR-130a-3p抗H2O2诱导的心肌细胞氧化应激损伤效应。

A:Western blot检测;B:CCK-8法检测细胞活力;C:LDH比色法检测LDH释放量;1:miR-NC组;2:miR-130a-3p mimics组;3:miR-130a-3p mimics+pcDNA3.1组;4:miR-130a-3p mimics+pc-TRIM37组;与miR-NC组比较,**P<0.01;与miR-130a-3p mimics+pcDNA3.1组比较,##P<0.01图6 TRIM37过表达逆转了miR-130a-3p对H2O2诱导的HL-1细胞活力及LDH释放的影响Fig.6 TRIM37 overexpression reversed the effects of miR-130a-3p on cell viability and LDH release in H2O2-induced HL-1 cells
2.7 TRIM37过表达逆转了miR-130a-3p对HL-1心肌细胞凋亡的影响
为进一步验证miR-130a-3p通过靶向抑制TRIM37对心肌细胞凋亡的作用,我们进一步采用TUNEL法检测心肌细胞凋亡(图7A、7B)并分析凋亡相关蛋白的表达变化(图7C、7D)。结果显示,与miR-130a-3p mimics+pcDNA3.1组比较,miR-130a-3p mimics+pc-TRIM37组TUNEL阳性细胞比例显著增加,Bax、Cleaved Caspase-3、Cleaved Caspase-9蛋白的表达水平显著升高(均P<0.01),Bcl-2水平显著降低(P<0.05),提示TRIM37过表达可部分抵消miR-130a-3p抗H2O2诱导的心肌细胞凋亡效应。
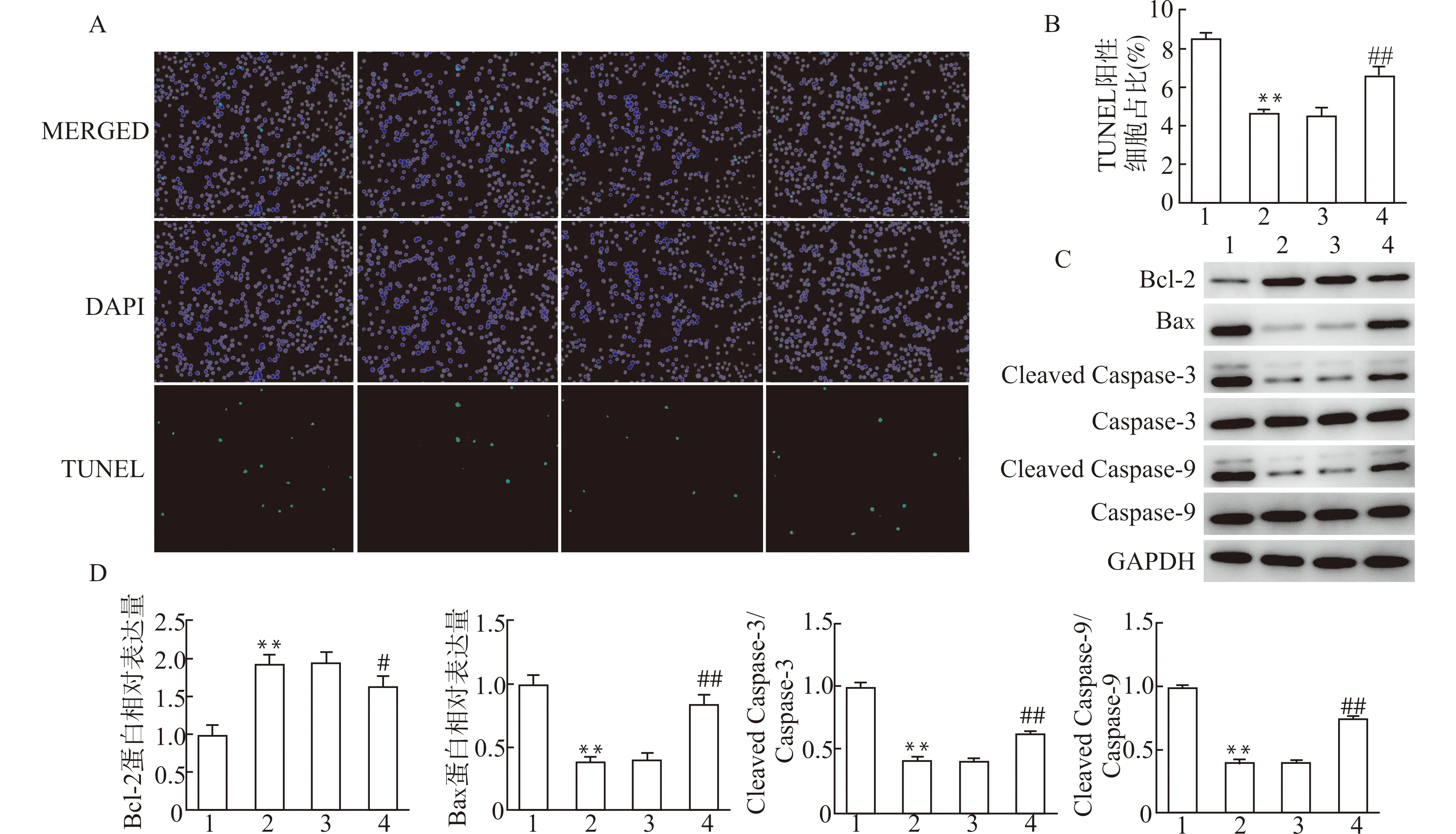
A、B:TUNEL法检测心肌细胞凋亡;C、D:凋亡相关蛋白的表达变化;1:miR-NC组;2:miR-130a-3p mimics组;3:miR-130a-3p mimics+pcDNA3.1组;4:miR-130a-3p mimics+pcDNA-TRIM37组;与miR-NC组比较,**P<0.01;与miR-130a-3p mimics+pcDNA3.1组比较,#P<0.05 ##P<0.01图7 TRIM37过表达逆转了miR-130a-3p对HL-1心肌细胞凋亡的影响Fig.7 TRIM37 overexpression reversed the effects of miR-130a-3p on the apoptosis of H2O2-induced HL-1 cells
3 讨论
ROS介导的心肌氧化应激损伤和凋亡是导致心血管系统结构和功能异常的重要原因。H2O2作为一类ROS,极易透过细胞膜促进氧化应激反应,导致活性氧自由基过量产生和堆积,造成细胞及组织的损伤,因此常被用于构建体外氧化应激损伤模型[11]。同时,ROS可通过抑制Bcl-2蛋白的表达,诱导Bax蛋白转移至线粒体促进细胞色素C的释放,细胞色素C可与半胱天冬酶-9(Caspase-9)和凋亡蛋白酶活化因子1(Apaf-1)结合形成复合物,启动Caspase-3级联反应,促进细胞凋亡[12-13]。因此,本研究通过H2O2刺激HL-1心肌细胞发现,H2O2能显著抑制心肌细胞活力、促进LDH的释放和细胞凋亡,下调Bcl-2的表达,上调Bax、Cleaved Caspase-3、Cleaved Caspase-9的表达,提示H2O2诱导的心肌细胞氧化应激损伤模型造模成功。
越来越多的研究表明miRNAs在心肌细胞氧化损伤中发挥了重要作用。Zou等[14]研究证实,miR-184在H2O2诱导的H9c2心肌细胞中表达上调,而抑制miR-184的表达可通过靶向FBXO28抑制心肌细胞氧化应激和炎症反应,进而抑制心肌细胞凋亡。Shi等[15]研究表明,miR-323-3p在大鼠心肌梗死模型心肌组织和H2O2诱导的H9c2心肌细胞中表达下调,miR-323-3p过表达可显著抑制心肌细胞凋亡,促进心肌细胞抗氧化能力,并能够改善大鼠心脏功能。对于miR-130a-3p,目前已有研究证实miR-130a-3p过表达可能通过抑制Akt/mTOR信号的激活缓解心肌细胞肥大[8]。另有研究发现,miR-130a-3p在心肌梗死后心肌细胞中显著低表达,长链非编码RNA X染色体失活特异转录本(lncRNA XIST)和磷酸二酯酶4D(PDE4D)高表达可通过靶向抑制miR-130a-3p促进心肌细胞凋亡,而miR-130a-3p可逆转PDE4D诱导的心肌梗死和心肌细胞凋亡[9]。此外,Jiang等[16]证实了miR-130a-3p对于氧化应激的作用,miR-130a-3p过表达能够显著抑制高糖诱导的小鼠MPC5足细胞ROS和丙二醛(MDA)水平,上调超氧化物歧化酶(SOD)活性,发挥抗氧化应激损伤作用。与上述研究结果一致,本研究证实了miR-130a-3p在H2O2诱导的HL-1心肌细胞中显著低表达,通过转染miR-130a-3p mimics可显著逆转H2O2诱导的HL-1细胞活力的降低,抑制LDH的释放和细胞凋亡水平,提示miR-130a-3p能够对抗H2O2诱导心肌氧化损伤和凋亡。
TRIM37作为TRIM蛋白家族的成员之一,其基因位于染色体17q22-23,其主要特征是具有RING、B-Box和卷曲螺旋区结构域,表现出E3泛素连接酶活性[17]。目前对于TRIM37的研究主要集中在肿瘤方面,其能够促进多种肿瘤细胞的增殖和转移[18-19]。有研究发现,乙型肝炎病毒(HBV)感染期间,ROS水平上调可通过介导核因子κB(NF-κB)炎症信号的激活诱导TRIM37的转录,提示ROS可促进TRIM37的表达[20]。此外,TRIM37突变可导致Mulibrey综合征,引发患者充血性心力衰竭和心包缩窄等[21]。本研究进一步深入验证了TRIM37与miR-130a-3p的关系,结果发现TRIM37是miR-130a-3p的靶基因,miR-130a-3p过表达后TRIM37表达下调,TRIM37过表达可显著逆转miR-130a-3p的抗氧化作用,促进H2O2诱导的HL-1细胞氧化应激损伤和凋亡。
综上所述,本研究证明了miR-130a-3p可通过靶向抑制TRIM37进而发挥抗H2O2诱导的心肌细胞氧化应激损伤和凋亡作用。这为临床心脏氧化应激损伤的诊断和治疗研究提供了新的靶点和参考。
