ELF4通过Wnt/β-catenin信号通路影响胃癌细胞的增殖和侵袭*
2021-03-02朱季军刘云云王玉欣王晓松王晓燕
刘 伟,朱季军,王 艳,刘云云,王玉欣,王晓松,王晓燕
江苏省宿迁市第一人民医院消化内科,宿迁 223800
胃癌(gastric cancer,GC)是全世界最为常见的恶性肿瘤之一,居癌症相关死亡率的第2位,其5年生存率总体不到30%[1-2]。近年来,随着饮食习惯的逐步改善和医疗技术的稳步提高,我国的胃癌发病率已有所减少,但其晚期预后不良的现象并未得到显著改善。因此,亟须找到用于早期诊断和治疗GC的靶点[3]。E74样受体4(E74-like factor 4,ELF4)是转录因子ETS(E23 transformation specific)家族的成员之一,可参与到免疫反应、成骨、成脂、以及癌症发生的过程,然而目前对于ELF4在胃癌发展中的相关作用及分子机制仍然不明确[4-5]。本文旨在探讨ELF4对人胃癌细胞的增殖和侵袭能力的影响,以揭示ELF4在胃癌发展中可能的调控机制。
1 材料与方法
1.1 材料
人正常胃黏膜上皮细胞GES-1,人胃癌细胞NCI-N87、BGC823、MKN45、AGS细胞系购自美国模式培养物集存库(ATCC)。DMEM培养液和胎牛血清(FBS)购自美国Invitrogen公司,Lipofectamine-3000转染试剂购自美国Thermo Fisher公司。ELF4沉默表达质粒shELF4、空白对照质粒shNC由上海生工生物技术有限公司合成。Western blot检测相关试剂购自上海碧云天公司,ELF4、Cyclin D1、MMP7、β-catenin抗体均购自美国BD公司。
1.2 实验分组
在湿润状态下37℃和5% CO2,将MKN45细胞置于含有10%胎牛血清(FBS)的DMEM完全培养液进行常规培养。当培养液微黄或变黄时将其重新消化、离心,并更换细胞培养液。本实验分为4组:shNC,shELF4,shELF4+PBS以及shELF4+LiCl。收集处于活性状态的细胞,将其消化、离心后接种于6孔板中,置于细胞孵育箱接着培养,达到70%~80%的细胞密度后用Lipofectamine-3000转染试剂进行细胞转染,转染shELF4质粒和空质粒shNC,每孔5 μg质粒,shELF4质粒组加入终浓度为20 mmol/L且溶于去离子水的Wnt通路激动剂LiCl(shELF4+LiCl)或等体积溶剂PBS(shELF4+PBS)。培养2 d后,再收集细胞进行后续实验。
1.3 实时荧光定量PCR(qRT-PCR)检测
根据使用手册说明,采用TransZol RNA试剂盒提取各细胞系的总RNA。先将RNA逆转录合成cDNA,再运用qRT-PCR技术检测所研究的基因表达。ELF4上游引物5′-CCTGATCTTTGA-GTTCGCAAGC-3′和下游引物5′-AGTCCCGAGTACAGATGCAGT-3′;β-catenin上游引物5′-A-AAGCGGCTGTTAGTCACTGG-3′和下游引物5′-CGAGTCATTGCATACTGTCCAT-3′;Cyclin D1上游引物5′-GCTGCGAAGTGGAAACCATC-3′和下游引物5′-CCTCCTTCTGCACACATTTGAA-3′;MMP7上游引物5′-GAGTGAGCTACAGTGGGAACA-3′和下游引物5′-CTATGACGCGGGAGTTTAACAT-3′。反应条件为:95℃下预变性5 min,95℃下变性30 s,60℃反应20 s,72℃反应30 s;总计40个循环。以GAPDH为内参分析实时荧光的相对表达进而比较PCR扩增的程度。
1.4 细胞增殖能力检测
CCK-8实验用于检测细胞增殖,将每组细胞按每孔200 μL的体积上样,以2×103个/孔的标准种植,培养0、24、48、72 h后,将20 μL CCK-8加至每个孔中,用酶标仪(Bio-Rad,USA)于450 nm波长下测定实验组与对照组的吸光度(A)值,绘制细胞增殖曲线,纵坐标为吸光度,横坐标为时间。
1.5 细胞侵袭能力测定
Transwell小室用于侵袭实验,其上室中无血清DMEM与基质胶(购于美国Becton Dickinson公司)以1∶5的比例加入并混匀。待基质胶凝固,分别收集好实验组和对照组细胞,接着进行消化、离心和计数操作。将细胞(3 × 104细胞/孔)接种于上室,下室加入15% DMEM培养液,然后置于孵育箱中培养。24 h后,小室取出,采用0.2%结晶紫溶液染色,200倍显微镜下计算穿膜细胞数,重复3次取平均值,计数并评估细胞的侵袭率。
1.6 蛋白质印迹法(Western blot)检测
转染24 h后,从细胞中提取全部蛋白质,其蛋白浓度经BCA试剂盒定量检测。将蛋白样品上样,经十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳分离,再转至PVDF膜上。在室温下用5%的脱脂奶粉将其封闭2 h,再分别加入抗体,孵育1~2 h;显色剂显色后对蛋白条带进行吸光度检测。以GAPDH为内参测定蛋白相对表达量。
1.7 统计学方法

2 结果
2.1 ELF4在多种人胃癌细胞系中高表达
实时荧光定量PCR结果(图1A)表明,人胃癌细胞株NCI-N87、BGC823、AGS和MKN45中ELF4 mRNA水平均显著高于人正常胃黏膜上皮细胞GES-1;Western blot检测结果(图1B)表明,与GES-1细胞相比,上述4种胃癌细胞中ELF4蛋白表达水平均较高。
上述结果表明,ELF4在4种人胃癌细胞中的表达水平显著提高,尤其是在MKN45细胞中。因此,后续实验选取MKN45细胞进行研究。

A:ELF4 mRNA水平;B:ELF4蛋白水平;1:GES-1,2:NCI-N87,3:BGC823,4:AGS,5:MKN45;与GES-1比较,**P<0.01图1 人正常胃黏膜上皮细胞和胃癌细胞系中ELF4表达Fig.1 ELF4 expression in normal human gastric mucosa epithelial cells and in gastric carcinoma cell lines
2.2 ELF4基因敲降能够抑制MKN45细胞增殖
为进一步验证ELF4基因能否作为功能性癌基因参与胃癌的进程,本研究进一步对MKN45细胞中的ELF4基因进行敲降。转染48 h后,shELF4组的ELF4 mRNA及蛋白相对表达量显著低于对照组shNC(P<0.01,图2A、2B),提示转染成功,可行后续实验。

A:ELF4 mRNA水平;B:ELF4蛋白水平;与shNC组比较,**P<0.01图2 ELF4的敲降效率验证Fig.2 Verification of ELF4 knockdown efficiency
2.3 ELF4基因敲降能够抑制MKN45细胞侵袭
CCK-8检测结果显示,转染后0 h,shELF4组和shNC组细胞增殖活力无明显差异;但转染24、48及72 h后,shELF4组细胞增殖活力则显著低于shNC组,见图3A。因此,ELF4基因的敲降能够抑制MKN45细胞增殖。
Transwell实验显示,200倍视野下shELF4组侵袭细胞数显著少于shNC组侵袭细胞数。定量分析结果发现,shELF4组侵袭细胞数量显著低于shNC组侵袭细胞数量(图3B)。因此,ELF4沉默能够抑制MKN45细胞侵袭。
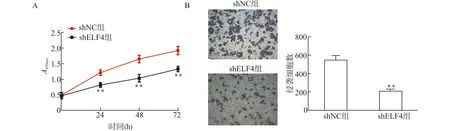
A:细胞增殖曲线;B:细胞侵袭图及定量;与shNC组比较,**P<0.01图3 ELF4敲降对MKN45细胞增殖和侵袭的影响Fig.3 Effect of ELF knockdown on proliferation and invasion of MKN45 cells
2.4 ELF4基因敲降抑制胃癌细胞增殖和侵袭的机制
运用实时荧光定量PCR以及蛋白质印迹法检测实验组和对照组细胞中的β-catenin、Cyclin D1、MMP7的mRNA及蛋白表达水平。图4A~4C显示,ELF4基因敲降后,β-catenin、Cyclin D1、MMP7的mRNA及蛋白表达显著低于对照组shNC。接着,蛋白质印迹法检测不同组别细胞核和细胞质中的β-catenin表达变化。图4D显示,ELF4基因敲降后,β-catenin的核异位减少。因此,ELF4可能通过调控Wnt通路影响胃癌细胞的生物功能。
与添加PBS相比,加入LiCl能够显著增加因ELF4基因敲降而受到抑制的β-catenin,Cyclin D1,MMP7 mRNA及蛋白表达,见图5A和5B。当在shELF4沉默细胞中引入Wnt通路激动剂LiCl处理后,与加入PBS的对照组相比,ELF4敲降抑制细胞增殖活力及侵袭的作用被逆转(图6A和6B)。
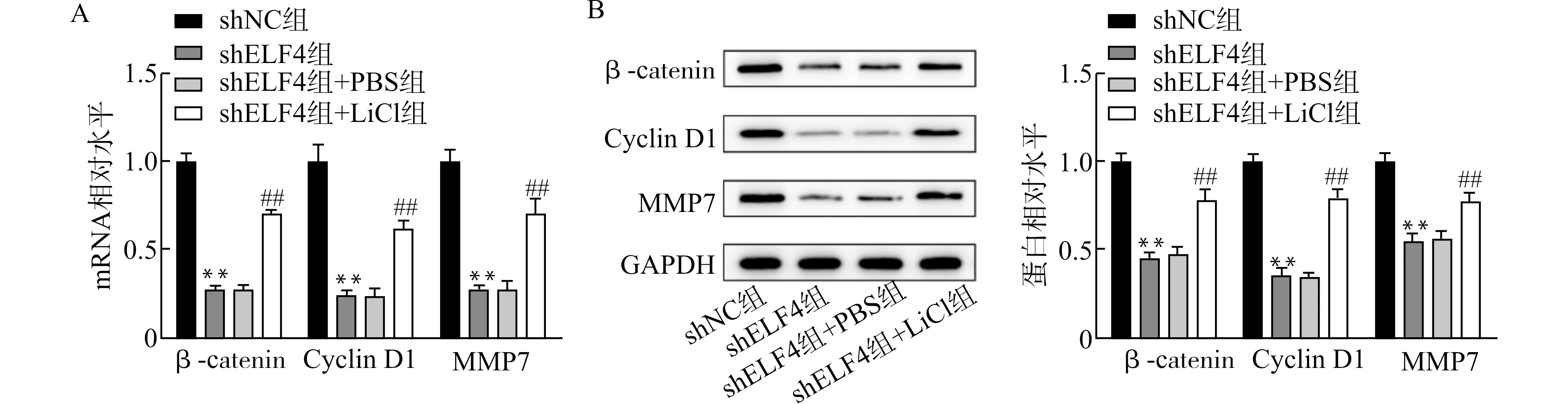
A:β-catenin、Cyclin D1、MMP7 mRNA水平;B:β-catenin、Cyclin D1、MMP7蛋白水平;与shNC组比较,**P<0.01;与shELF4+PBS组比较,##P<0.01图5 LiCl对ELF4敲降抑制的MKN45细胞Wnt/β-catenin通路的影响Fig.5 Effect of LiCl on Wnt/β-catenin pathway inhibited by ELF4 knockdown in MKN45 cells

A:细胞增殖曲线;B:细胞侵袭图及定量;与shNC组比较,**P<0.01;与shELF4+PBS组比较,##P<0.01图6 LiCl处理对ELF4敲降抑制的MKN45细胞增殖和侵袭的影响Fig.6 Effect of LiC1 treatment on MKN45 cell proliferation and invasion inhibited by ELF4 knockdown
3 讨论
胃癌是临床中最为常见的消化系统肿瘤之一,其在全球范围内具有高发病率和高死亡率的特征,对人类健康威胁巨大[6-7]。然而,因地域、经济及医疗水平上的差异,大多数胃癌患者无法进行有效的早期诊断,其治疗手段也有限[8]。因此,如何测定胃癌发展的标志因子,并研究其潜在的作用机制,对胃癌临床治疗和靶点研究极为重要。
转录因子ETS家族最早发现于鸟白血病病毒,其家族中的每一个成员大约含有85个氨基酸的DNA结合域,以此用来调控靶基因的表达,ETS基因能够编码各种转录因子,进而调控细胞的增殖、分化、稳态及凋亡[9]。ELF4是由原癌基因v-ets编码的ETS家族成员,能够参与多种生物学过程,可以作为癌基因通过插入逆转录病毒,进而诱发癌症[10]。研究表明ELF4是miR-124的靶标,并促进神经母细胞瘤增殖和未分化状态[11]。ELF4在多种癌症中呈现高表达且起抑癌作用,然而ELF4在胃癌中的作用尚未完全明确[12]。在本研究中,ELF4在人胃癌细胞中的表达明显高于人正常胃黏膜细胞,这与以往报道的ELF4在肿瘤组织中高表达的情况一致。本研究进一步发现,敲低ELF4基因表达,实验组MKN45细胞增殖能力以及侵袭能力显著低于对照组,因此,ELF4具有促进胃癌细胞增殖及侵袭的作用。
我们进一步验证ELF4调控胃癌细胞系MKN45增殖和侵袭的分子机制。目前已知包括胃癌在内的十几种高发性恶性肿瘤与Wnt/β-catenin信号通路的转录活性失调密切相关[13-14]。作为一个多功能蛋白,β-catenin异常活化后可促进肿瘤发生[15];Cyclin D1是调控细胞周期G1期的关键蛋白,其过度表达可致细胞增殖失控而恶性化[16];活化的MMPs是恶性肿瘤细胞获取侵袭和迁移能力的一个非常重要的标志[17]。在本研究中,抑制ELF4后,实验组细胞β-catenin、Cyclin D1和MMP7的表达水平显著降低,并且β-catenin的核异位也减少。加入LiCl处理胃癌细胞后,shELF4+LiCl组能够显著抵消沉默ELF4引起的β-catenin,Cyclin,D1,MMP7 mRNA及蛋白表达的降低。用Wnt通路激动剂LiCl处理胃癌细胞后,敲降ELF4基因对细胞增殖及侵袭的抑制作用被显著逆转。因此,上述结果表明,ELF4可能通过调节Wnt/β-catenin通路,进而实现对胃癌细胞增殖和侵袭的正向调节作用。
