淋巴结阳性率对ⅢC期子宫内膜癌的预后意义*
2021-03-02王笑犁
任 武,王 波,王笑犁
华中科技大学同济医学院附属同济医院妇产科,武汉 430030
子宫内膜癌是女性三大恶性肿瘤之一,在发展中国家其发病率仅次于宫颈癌[1]。子宫内膜癌首选的治疗方法是手术,包括全子宫切除、双侧输卵管切除以及淋巴结清扫[2]。其中,盆腹腔淋巴结清扫主要包括盆腔及腹主动脉旁淋巴结。国际妇产科协会(The Federation International of Gynecology and Obstetrics,FIGO)将淋巴结转移作为子宫内膜癌分期的重要指标,伴有盆腔或腹主动脉旁淋巴结阳性的患者被归为ⅢC期,其中仅有盆腔淋巴结阳性者为ⅢC1期,伴腹主动脉淋巴结阳性者为ⅢC2期[3-4]。淋巴结阳性率(LNR)为阳性淋巴结数占被检淋巴结总数的比例,在多种肿瘤中被证实为重要的预后指标[5-9]。对于ⅢC期子宫内膜癌患者,研究表明LNR是影响预后的独立因素[10-14]。然而这些研究大多采用经验性方法或是ROC曲线进行截断点值选取,采用了不同的截断点值,不仅具有一定主观性也未考虑时间因素影响。同时,这些研究样本量小,所得到结果说服力不足。因此,为了合理规避这些问题,本研究选取Surveillance,Epidemiology,and End Results(SEER)及The Cancer Genome Atlas(TCGA)数据库ⅢC期子宫内膜癌数据,在大样本上采用X-tile软件选取截断点值,合理纳入时间因素影响,评估ⅢC期子宫内膜癌患者中LNR的预后意义并寻找合理的截断点值。
1 资料与方法
1.1 一般资料
采用SEER Stat软件提取SEER数据库2000年至2017年间诊断为子宫内膜癌患者的临床信息。纳入标准:①ⅢC期患者;②年龄大于30岁;③接受手术治疗;④具有完整淋巴结清扫及阳性淋巴结记录信息;⑤术后随访信息完整且随访时间>1月;⑥原发部位明确为子宫内膜(C54.1);⑦根据ICD-O-3编码将病理组织类型分为:子宫内膜样癌/腺癌/黏液性腺癌(8052、8070、8140、8210、8260-8263、8380-8383、8480-8482、8560、8570、8574),浆液性腺癌(8441、8460、8461),癌肉瘤(8950、8951、8980、8981),透明细胞癌(8310),混合性腺癌(8323),去除ICD-O-3编码中其他病理组织类型(包括:8000、8010-8013、8020-8021、8041、8045-8046、8370、8440、8890、8900、8930-8931、8933、8935)。于UCSC Xena(http://xena.ucsc.edu)提取TCGA子宫内膜癌患者临床信息,纳入标准:①ⅢC期患者;②年龄大于30岁;③接受手术治疗;④具有完整淋巴结清扫及阳性淋巴结记录信息;⑤术后随访信息完整且随访时间>1月。研究中,总体生存时间(OS)为术后至任何原因导致患者死亡的时间,肿瘤特异性生存时间(CSS)为术后至肿瘤导致患者死亡的时间。
1.2 统计学方法
本研究采用R3.6、X-tile以及GraphPad软件。其中Cox回归分析基于R survival数据包进行,X-tile 3.6.1软件用于数据截断点值选取,GraphPad软件用于Kaplan-Meier生存曲线绘制,R pROC数据包用于ROC曲线绘制。以P< 0.05为差异具有统计学意义。
2 结果
2.1 患者临床特征
如表1所示,SEER数据库3840例ⅢC期子宫内膜癌患者纳入研究,被检淋巴结中位数值为16(1~99)枚,阳性淋巴结中位数为2(1~99)枚,淋巴结阳性率(LNR)中位数值为0.154(0.010~1),中位随访时间为35(1~167)月,随访期间1528(39.8%)例患者死亡。TCGA数据库共79例ⅢC期子宫内膜癌患者纳入研究,病理组织类型为子宫内膜样癌与浆液性腺癌,被检淋巴结中位数值为20(1~91)枚,阳性淋巴结中位数为2(1~38)枚,LNR中位数值为0.161(0.019~1),中位随访时间为28(1~99)月,随访期间死亡21(26.6%)例。
2.2 截断点值选取及预后相关性分析
在SEER子宫内膜癌数据中使用X-tile 3.6.1软件筛选最佳截断点,被检淋巴结总数最佳截断点值为6枚,阳性淋巴结计数最佳截断点值为5枚,而LNR的最佳截断点为0.31。图1为LNR的X-tile计算结果。

A:LNR截断点值如图中所示;B:截断点值0.31在患者LNR分布直方图中将患者分为2组;C:根据截断点值对患者进行分组后绘制Kaplan-Meier生存曲线。图1 利用X-tile选择LNR的截断点值Fig.1 Best cut-off point selection for LNR
利用SEER子宫内膜癌数据进行单因素COX回归分析,如表2所示,年龄、种族、分化程度、组织病理类型、手术方式、被检淋巴结总数、阳性淋巴结计数以及LNR均与总体生存时间(OS)及肿瘤特异性生存时间(CSS)相关。

表2 SEER数据库ⅢC期子宫内膜癌患者临床信息单因素COX回归分析Table 2 Univariate Cox regression analysis on clinical information of patients with stage ⅢC uterine endometrial cancer from SEER database
如表3所示,多因素COX回归分析,年龄、种族、分化程度、病理组织类型以及LNR是OS及CSS相关的独立预后因素。而阳性淋巴结个数是CSS独立预后因素(P=0.046),不是OS独立预后因素(P=0.059)。
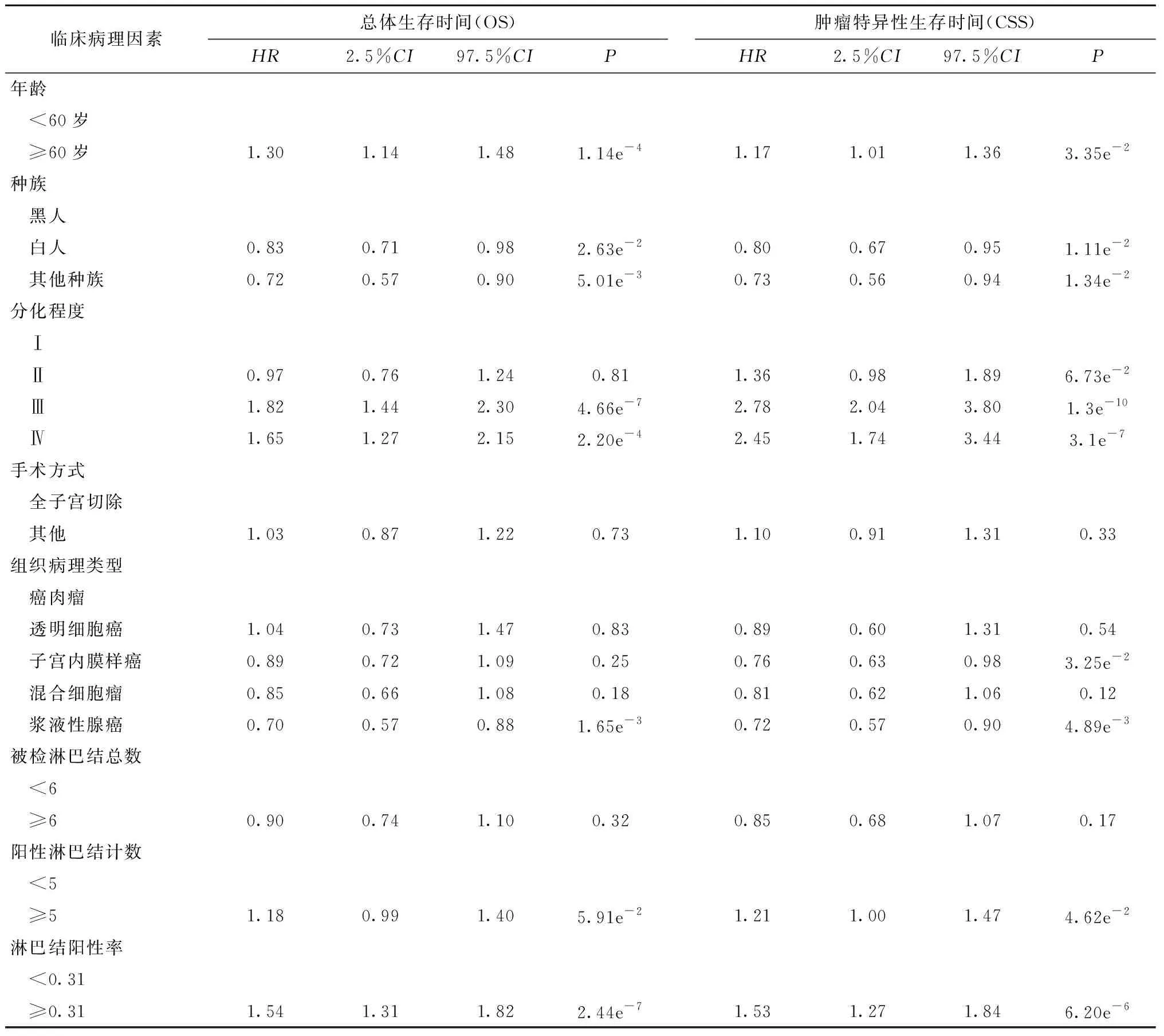
表3 SEER数据库ⅢC期子宫内膜癌患者临床信息多因素COX回归分析Table 3 Multivariate Cox regression analysis on clinical information of patients with stage ⅢC uterine endometrial cancer from SEER database
2.3 LNR的预后意义及与ⅢC分期预后评估价值比较
以0.31为LNR最佳截断点值,LNR<0.31组患者中位生存时间为105个月(95%CI:94.65~116.40),LNR≥0.31组中位生存时间为62个月(95%CI:55.90~68.75),如图2A与2B所示,两组在OS(HR=1.77,Log-rankP< 0.01)及CSS(HR=1.91,Log-rankP<0.01)上均具有显著差异。同时在子宫内膜样癌(n=2346,61.1%)及非子宫内膜样癌(n=1494,38.9%)两临床亚组患者中,分别验证LNR的预后意义,LNR值越高OS越短(Log-rankP值:子宫内膜样癌P<0.01,非子宫内膜样癌P<0.01),CSS也越短(Log-rankP值:子宫内膜样癌P<0.01,非子宫内膜样癌P<0.01)。在不同分化程度子宫内膜癌患者中评估LNR的预后意义,采用0.31为LNR截断点值,LNR值越高OS越短(Log-rankP值:Ⅰ~ⅡP=3.0 e-4;Ⅲ~ⅣP<0.01),CSS也越短(Log-rankP值:Ⅰ~ⅡP=3.0 e-4;Ⅲ~ⅣP<0.01)。在ⅢC1/ⅢC2患者中评估LNR的预后意义,采用0.31为LNR截断点值,LNR值越高OS越短(Log-rankP值:ⅢC1P<0.01;ⅢC2P<0.01),CSS也越短(Log-rankP值:ⅢC1P< 0.01;ⅢC2P<0.01)。我们对LNR(LNR<0.31,LNR≥0.31)与ⅢC分期(ⅢC1与ⅢC2期)评估预后的准确性进行比较,通过图2C与2D的ROC曲线可看出,LNR与ⅢC分期在OS及CSS两组比较中AUC面积均具有显著差异,LNR预测价值要明显优于ⅢC分期(Pos=1.86e-6,Pcss=2.9e-4)。

A:LNR<0.31与LNR≥0.31在总体生存时间上具有明显差异;B:LNR<0.31与LNR≥0.31在肿瘤特异生存时间上具有明显差异;C:LNR(LNR<0.31,LNR≥0.31)与FIGO分期(ⅢC1与ⅢC2期)对总体生存时间评估价值比较;D:LNR(LNR<0.31,LNR≥0.31)与FIGO分期(ⅢC1与ⅢC2期)对肿瘤特异生存时间评估价值比较图2 LNR对SEER数据库ⅢC期子宫内膜癌患者预后价值评估Fig.2 Value of LNR in predicting prognosis of ⅢC uterine endometrial cancer patients from SEER database
2.4 TCGA数据集进行验证
采用SEER数据集研究所获取截断点值,我们在TCGA ⅢC期子宫内膜癌数据中进行验证。如表4所示,与SEER数据中所获结果相一致,通过多因素COX回归分析,LNR被证实为独立的预后风险因素。如图3所示,通过KM生存曲线可看出,LNR≥0.31组患者总体生存(OS)与LNR<0.31组总体生存(OS)之间具有明显差异(HR=6.74,Log-rankP<0.01)。

表4 TCGA数据库ⅢC期子宫内膜癌患者临床信息多因素COX回归分析Table 4 Multivariate Cox regression analysis on clinical information of stage ⅢC uterine endometrial cancer patients from TCGA database

图3 TCGA ⅢC期子宫内膜癌患者LNR<0.31与LNR≥0.31两组的总体生存曲线。Fig.3 Overall survival curves of TCGA stage ⅢC uterine endometrial cancer patients with LNR<0.31 and LNR≥0.31
3 讨论
从1988年首次将淋巴结转移信息纳入子宫内膜癌分期标准,到2009年FIGO将仅有盆腔淋巴结转移患者定为ⅢC1期,腹主动脉旁淋巴结阳性患者定为ⅢC2期,淋巴结转移状态与子宫内膜癌预后间相关性已较为明确[3-4]。但是该方法通过淋巴结转移状态进行分期,在评估患者预后上未考虑阳性淋巴结计数及被检淋巴结总数,当切除阳性淋巴结个数不足时会影响患者预后,因而该方法具有一定局限性。LNR是阳性淋巴结计数占被检淋巴结总数的比例,结合了阳性淋巴结计数与被检淋巴结总数的影响,且其评估患者预后的价值被证实优于被检淋巴结总数[15]。
对于LNR截断点值的选取,多项研究结果却无法统一。Chan等[10]首次经验性地将10%及50%作为ⅢC~Ⅳ期子宫内膜癌淋巴结阳性率截断点值应用于预后研究,Polterauer等[11]也选取10%及50%作为ⅢC期子宫内膜癌的截断点值进行研究,Ayhan等[13]则经验性地选取15%作为ⅢC期子宫内膜癌的截断点值,Tangjitgamol等[14]则利用统计学方法ROC曲线计算得到10%作为子宫内膜癌淋巴结阳性率的截断点。虽然这些研究对于LNR的截断点取值,在不同数据集上都显示出显著生存差异,但是所采用的方法要么属于经验性方法要么使用简单的ROC曲线,没法体现时间因素影响,因而具有一定缺陷。本研究中使用X-tile软件统计方法通过寻找最佳的截断点,参考某一截断点得出合理临床数据,但与ROC曲线不同的是X-tile在统计分析时纳入了时间因素,因此结果更加合理、准确[16]。LNR值受淋巴结清扫范围与程度的影响,不同手术方式、手术中心以及术者等临床因素可能导致不同结果,单中心数据研究很难具有说服力。在纳入研究对象上,本研究采用的是2000年至2017年的SEER数据集,为多中心长时间段数据,样本量不仅更大且数据更全,在一定程度上减少这些因素的影响。研究中得出0.31作为LNR的截断点值,通过单因素及多因素分析被证实为独立的预后因素,而且所得到的结果经过TCGA数据进行验证,更增加了说服力。
FIGO于2009年根据淋巴结转移状态对ⅢC期子宫内膜癌进行再分期(ⅢC1与ⅢC2期),但对于预后评估该分期的价值并非最佳,之后Kapp及Wen等[17-18]分别从预后角度出发研究ⅢC期子宫内膜癌患者再分期问题。本研究通过ROC曲线,对LNR(LNR<0.31,LNR≥0.31)与FIGO分期(ⅢC1与ⅢC2期)在预后评估价值方面进行了比较,发现LNR效果要优于FIGOⅢC分期,这与Kapp等的研究结论相一致。
综上,LNR充分结合了阳性淋巴结个数和清扫淋巴结总数对ⅢC期子宫内膜癌预后的影响,预后评估价值优于FIGO分期,是一种极具潜力的预后指标。LNR≥0.31是独立的预后指标,在临床决策中应该得到重视。
