下调lncRNA KCNQ1OT1抑制H2O2诱导的心肌细胞凋亡和氧化损伤*
2022-01-16张荣城吴玉塘
张荣城, 吴玉塘
福建医科大学附属第二医院 1心内科 2急诊科,泉州 362000
心血管系统疾病已经成为世界范围内威胁人类生命健康的重要疾病,临床上常见的有动脉粥样硬化、心肌缺血再灌注、心肌梗死等,而心肌细胞损伤与这些疾病息息相关[1]。研究显示,氧化应激和凋亡引起的心肌细胞损伤是心血管系统疾病发生的重要机制[2]。长链非编码RNA(long non-coding RNA,lncRNA)属于非编码RNA的一种,其转录本超过200 nt,在细胞核和细胞质内均有表达,主要通过RNA形式在转录水平或转录后水平等多个层面上发挥作用[3-4]。lncRNA在心血管系统疾病中也具有十分重要的作用,其影响心肌细胞氧化损伤和细胞凋亡过程,lncRNA可能是改善心肌损伤的靶向分子[5]。lncRNA KCNQ1重叠转录物1(KCNQ1 overlapping transcript 1,KCNQ1OT1)定位于11p15.5染色体上,其长度为91 kb,通过与染色质作用,经表观遗传修饰影响下游基因的表达[6]。KCNQ1OT1在肿瘤中异常表达,如肺癌、结直肠癌、卵巢癌等肿瘤中KCNQ1OT1表达改变与肿瘤细胞恶性生物学行为有关[7-9]。近年来的文献报道表明,KCNQ1OT1还与心血管系统疾病有关,下调KCNQ1OT1能够抑制急性心肌梗死引起的心肌损伤,KCNQ1OT1在糖尿病心肌损伤中高表达,沉默KCNQ1OT1抑制高糖诱导的心肌细胞凋亡[10-11]。目前尚不清楚KCNQ1OT1在过氧化氢(H2O2)诱导的心肌细胞凋亡和氧化损伤中的作用。本次实验以H2O2诱导构建心肌细胞氧化应激模型,探讨下调KCNQ1OT1对心肌细胞凋亡和氧化损伤的作用和机制,为寻找有效的分子标记物治疗心肌损伤提供参考方向。
1 材料与方法
1.1 实验材料
心肌细胞H9c2购自美国ATCC;H2O2购自美国Sigma;KCNQ1OT1 siRNA、siRNA control由湖南普拉特泽生物科技有限公司构建;丙二醛(MDA)测定试剂盒、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(C-Caspase-3)抗体、β-连环蛋白(β-catenin)抗体、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒购自南京建成生物工程研究所;原癌基因(c-Myc)抗体购自美国Thermo Fisher公司;活化的含半胱氨酸的天冬氨酸蛋白水解酶9(C-Caspase-9)抗体购自美国Abcam公司;过氧化氢酶(CAT)测定试剂盒购自北京索莱宝科技有限公司;超氧化物歧化酶(SOD)测定试剂盒购自北京盛科博源生物科技有限公司。
1.2 细胞转染
用Lipofectamine 2000分别将KCNQ1OT1 siRNA、siRNA control转染到心肌细胞中,转染操作方法完全按照转染试剂说明书进行。将转染KCNQ1OT1 siRNA、siRNA control以后的心肌细胞用200 μmol/L的H2O2细胞培养液培养处理,记为si-KCNQ1OT1组、si-NC组。将未经转染的心肌细胞用200 μmol/L的H2O2细胞培养液培养处理,记为H2O2组。以不作处理、正常培养的心肌细胞为Control组。
1.3 qRT-PCR检测KCNQ1OT1表达
RNA提取方法参照常规Trizol试剂说明,分别将培养12 h以后的Control、H2O2、si-NC、si-KCNQ1OT1组细胞中的总RNA提取,RNA经紫外分光光度计分析A260nm/A280nm在1.8~2.0之间,把RNA置于-80 ℃环境中长期保存。根据下述方法制备逆转录反应体系,在干净的EP管中添加8μL的RNA提取液、2 μL的PrimeScript mix和DEPC水,最终体积为20 μL,逆转录反应条件为:37 ℃结合15 min,85 ℃结合5 s,在4 ℃保存。取2 μL的cDNA,再依次添加如下试剂:5 μL的SYBR Ⅱ、0.4 μL的上下游引物、2.2 μL的DEPC水,最终体积为10 μL,设置PCR反应程序为:95 ℃ 5 min,95 ℃ 30 s,60 ℃ 1 min,72 ℃ 1 min,共40个循环。GAPDH作为内参,按照2-ΔΔCt法对KCNQ1OT1表达水平进行分析。引物为:KCNQ1OT1上游5′-CCCAGAA-ATCCACACCTCGG-3′,下游5′-TCCTCAGTGA-GCAGATGGAGA-3′。
1.4 CCK-8检测细胞增殖
把心肌细胞分别种植到96孔板内,细胞种植密度为5×104个/mL,将细胞放在37 ℃,5% CO2培养箱中培养过夜,取出培养板,把培养上清吸除,分别按照Control、H2O2、si-NC、si-KCNQ1OT1组分组处理细胞,继续培养12 h,吸取CCK-8溶液至96孔板中,每个孔内加入10 μL,置于37 ℃环境中孵育2 h。上酶标仪分析检测细胞的(A)值(490 nm)。把Control组心肌细胞存活率设置为100%,评价其余各组细胞存活率变化情况。
1.5 流式细胞术检测细胞凋亡
收集处理12 h以后的Control、H2O2、si-NC、si-KCNQ1OT1组细胞,分别将孔中的上清液弃除,然后加入磷酸盐缓冲液(PBS)将细胞洗涤2次,分别添加0.25%胰蛋白酶,置于37 ℃孵育1 min,以1000 ×g离心10 min,添加PBS洗涤细胞,最后用PBS将细胞密度均调整为1×106个/mL。小心吸取1 mL的细胞培养液,以1000 ×g离心10 min,收集细胞沉淀,分别加入400 μL的结合缓冲溶液,混合均匀以后,再添加5 μL的Annexin Ⅴ-FITC以及PI,置于避光环境中结合15 min。上流式细胞仪检测各组心肌细胞凋亡情况。
1.6 MDA、SOD、CAT、GSH-Px水平检测
收集处理12 h以后的Control、H2O2、si-NC、si-KCNQ1OT1组细胞,分别用试剂盒检测细胞中MDA(硫代巴比妥酸法)、SOD(黄嘌呤氧化法)、CAT(微量法)、GSH-Px(比色法)水平,步骤分别按照试剂盒检测说明书进行。
1.7 Western blot检测C-Caspase-3、C-Caspase-9、β-catenin、c-Myc蛋白表达
收集处理12 h以后的Control、H2O2、si-NC、si-KCNQ1OT1组细胞,分别加入添加PMSF以后的RIPA裂解试剂,混合均匀后,置于冰上裂解20 min。以4 ℃,12000 ×g离心10 min,将上清溶液吸取并保存,蛋白浓度检测用BCA法。分别在蛋白样品内加入等量体积的Loading Buffer,混合均匀,置于100 ℃结合5 min。本次实验采用10%分离胶、5%浓缩胶行常规SDS-PAGE电泳,设置蛋白上样量为30 μg,首先以70 V的电压进行电泳,30 min后,将电压变更为100 V继续电泳,肉眼观察到染料已经到达分离胶的底部后,终止电泳。把凝胶取出,设置90 V的电压转膜,转膜60 min后关闭电源。将PVDF膜取出,置于封闭液(5%牛血清白蛋白)内,转移到室温、摇床条件下结合2 h。PVDF膜分别放在1∶1000稀释的β-catenin以及1∶800稀释后的C-Caspase-3、C-Caspase-9、c-Myc一抗溶液内,转移到4 ℃条件中结合反应过夜。PVDF膜继续放在1∶4000稀释以后的二抗溶液内,置于室温环境结合反应2 h。ECL法显色。设置GAPDH为内参,对目的蛋白的表达水平进行分析。C-Caspase-3、C-Caspase-9、β-catenin、c-Myc蛋白水平=目的蛋白条带灰度值/内参GAPDH条带灰度值。
1.8 Wnt信号激活剂对下调KCNQ1OT1影响心肌细胞的作用
取转染KCNQ1OT1 siRNA以后的心肌细胞,用Wnt信号激活剂氯化锂(LiCl)(30 mmol/L)和H2O2(200 μmol/L)的细胞培养液处理,记为si-KCNQ1OT1+LiCl组。以si-NC组、si-KCNQ1OT1组为参照,CCK-8法检测细胞增殖,流式细胞术检测细胞凋亡,用试剂盒检测细胞中MDA、SOD、CAT、GSH-Px水平,Western blot检测C-Caspase-3、C-Caspase-9、β-catenin、c-Myc蛋白表达。
1.9 统计学分析

2 结果
2.1 KCNQ1OT1 siRNA对H2O2诱导的心肌细胞中KCNQ1OT1表达的影响
与Control组(1.00±0.12)比较,H2O2组(2.16±0.15)心肌细胞中KCNQ1OT1水平升高;与si-NC组(2.17±0.18)比较,si-KCNQ1OT1组(0.96±0.09)心肌细胞中KCNQ1OT1水平降低。KCNQ1OT1 siRNA下调H2O2诱导的心肌细胞中KCNQ1OT1表达水平。
2.2 下调KCNQ1OT1对H2O2诱导的心肌细胞增殖和凋亡的影响
结果见图1和表1,与Control组比较,H2O2组心肌细胞存活率降低,细胞凋亡率升高,细胞中C-Caspase-3、C-Caspase-9蛋白表达水平升高;与si-NC组比较,si-KCNQ1OT1组心肌细胞存活率升高,细胞凋亡率降低,细胞中C-Caspase-3、C-Caspase-9蛋白表达水平降低。KCNQ1OT1 siRNA抑制H2O2诱导的心肌细胞凋亡。

1:Control;2:H2O2;3:si-NC;4:si-KCNQ1OT1;A:流式细胞术检测心肌细胞凋亡变化;B:Western blot检测心肌细胞中C-Caspase-3、C-Caspase-9蛋白水平图1 下调KCNQ1OT1对H2O2诱导的心肌细胞凋亡和细胞中C-Caspase-3、C-Caspase-9蛋白表达的影响Fig.1 Down-regulation of KCNQ1OT1 affects H2O2-induced cardiomyocyte apoptosis and the expression of C-Caspase-3 and C-Caspase-9 proteins in the cell

表1 下调KCNQ1OT1后H2O2诱导的心肌细胞存活率、凋亡率和C-Caspase-3、C-Caspase-9蛋白水平Table 1 H2O2-induced cardiomyocyte survival rate,apoptosis rate,C-Caspase-3 and C-Caspase-9 protein levels after down-regulation of
2.3 下调KCNQ1OT1对H2O2诱导的心肌细胞氧化损伤的影响
结果见表2,与Control组比较,H2O2组心肌细胞中MDA水平升高,细胞中SOD、CAT、GSH-Px水平降低;与si-NC组比较,si-KCNQ1OT1组心肌细胞中MDA水平降低,细胞中SOD、CAT、GSH-Px水平升高。KCNQ1OT1 siRNA抑制H2O2诱导的心肌细胞氧化损伤。
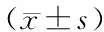
表2 下调KCNQ1OT1后H2O2诱导的心肌细胞中MDA、SOD、CAT、GSH-Px水平Table 2 MDA,SOD,CAT,GSH-Px levels in cardiomyocytes induced by H2O2 after down-regulation of
2.4 下调KCNQ1OT1对H2O2诱导的心肌细胞中Wnt信号通路的影响
结果见图2和表3,与Control组比较,H2O2组心肌细胞中β-catenin、c-Myc蛋白水平升高;与si-NC组比较,si-KCNQ1OT1组心肌细胞中β-catenin、c-Myc蛋白水平降低;与si-KCNQ1OT1组比较,si-KCNQ1OT1+LiCl组心肌细胞中β-catenin、c-Myc蛋白水平升高。KCNQ1OT1 siRNA抑制H2O2诱导的心肌细胞中Wnt信号通路激活。

1:Control;2:H2O2;3:si-NC;4:si-KCNQ1OT1;5:si-KCNQ1OT1+LiCl图2 Western blot检测下调KCNQ1OT1后H2O2诱导的心肌细胞中β-catenin、c-Myc蛋白水平Fig.2 Western blotting detection of β-catenin and c-Myc protein levels in cardiomyocytes induced by H2O2 after down-regulation of KCNQ1OT1

表3 下调KCNQ1OT1后H2O2诱导的心肌细胞中β-catenin、c-Myc水平Table 3 The levels of β-catenin and c-Myc in cardiomyocytes induced by H2O2 after down-regulation of
2.5 Wnt信号激活剂对下调KCNQ1OT1的H2O2诱导的心肌细胞凋亡的影响
结果见图3和表4,与si-NC组比较,si-KCNQ1OT1组心肌细胞存活率升高,细胞凋亡率降低,细胞中C-Caspase-3、C-Caspase-9蛋白水平降低;与si-KCNQ1OT1组比较,si-KCNQ1OT1+LiCl组心肌细胞存活率降低,细胞凋亡率升高,细胞中C-Caspase-3、C-Caspase-9蛋白水平升高。

1:si-NC;2:si-KCNQ1OT1;3:si-KCNQ1OT1+LiCl;A:流式细胞术检测心肌细胞凋亡变化;B:Western blot检测心肌细胞中C-Caspase-3、C-Caspase-9蛋白水平图3 Wnt信号激活剂对下调KCNQ1OT1后H2O2诱导的心肌细胞凋亡和细胞中C-Caspase-3、C-Caspase-9蛋白表达的影响Fig.3 Effect of Wnt signal activator on the apoptosis of cardiomyocytes induced by H2O2 and the expression of C-Caspase-3 and C-Caspase-9 proteins in the cells after down-regulation of KCNQ1OT1

表4 Wnt信号激活剂对下调KCNQ1OT1后H2O2诱导的心肌细胞存活率、凋亡率和C-Caspase-3、C-Caspase-9蛋白水平的影响Table 4 Effect of Wnt signal activator on H2O2-induced cardiomyocyte survival rate,apoptosis rate and C-Caspase-3 and C-Caspase-9 protein levels after down-regulation of
2.6 Wnt信号激活剂对下调KCNQ1OT1后H2O2诱导的心肌细胞氧化损伤的影响
结果见表5,与si-NC组比较,si-KCNQ1OT1组心肌细胞MDA水平降低,SOD、CAT、GSH-Px水平升高;与si-KCNQ1OT1组比较,si-KCNQ1OT1+LiCl组心肌细胞MDA水平升高,SOD、CAT、GSH-Px水平降低。
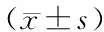
表5 Wnt信号激活剂对下调KCNQ1OT1后H2O2诱导的MDA、SOD、CAT、GSH-Px水平的影响Table 5 Effect of Wnt signal activator on H2O2-induced MDA,SOD,CAT,GSH-Px levels after down-regulation of
3 讨论
lncRNA是指长度超过200 nt的非编码RNA,其最初被认为是转录过程中的“噪音”,越来越多的研究证据表明,lncRNA可以通过多个途径影响细胞分化、染色体失活、细胞凋亡等过程[12]。lncRNA异常表达与人类疾病的进展有关,如肿瘤、神经退行性疾病、炎性疾病等等,可能是疾病治疗的潜在靶点[13]。在心肌梗死、心肌缺血再灌注等心血管系统疾病中也发现lncRNA发挥重要作用,lncRNA参与影响病理条件下心肌细胞损伤过程[14]。KCNQ1OT1是目前发现的具有促进肿瘤进展作用的调控因子,参与影响肿瘤细胞的生长、凋亡、侵袭等恶性生物学行为[7-8]。近些年来,KCNQ1OT1在心血管系统疾病中的作用也逐渐被揭示,KCNQ1OT1在心肌梗死患者中高表达,并且下调KCNQ1OT1可以改善缺氧诱导的心肌细胞凋亡[14]。在糖尿病心肌病患者中发现KCNQ1OT1具有促进心肌细胞凋亡的作用[11]。本实验显示,H2O2诱导的心肌细胞中KCNQ1OT1高表达,而下调KCNQ1OT1改善H2O2诱导的心肌细胞增殖活性低下,这提示下调KCNQ1OT1可能具有改善氧化应激条件下心肌细胞损伤的作用。
心肌损伤是一个复杂过程,氧化损伤、细胞凋亡等是目前发现的心肌细胞损伤主要机制,心肌细胞受到外界因素刺激后,细胞中产生大量的氧自由基,这些氧自由基不能被抗氧化酶及时清除,导致其在细胞内过量聚集[15]。过量的氧自由基能够将细胞膜上的脂质过氧化,造成细胞损伤,脂质过氧化的产物是MDA,MDA水平越高,氧化损伤程度也就越高[16]。SOD、CAT、GSH-Px是存在于机体内的抗氧化酶,其活性高低与细胞内氧自由基水平密切相关[17]。另外,过量的氧自由基还可以刺激Caspase,诱导细胞凋亡的发生[18]。Caspase是与细胞凋亡有关的蛋白家族,其蛋白成员常常以没有活性的形式存在于细胞内,只有被活化后才可以构成Caspase凋亡级联反应,诱导细胞凋亡发生[19-20]。本实验显示,下调KCNQ1OT1可以降低心肌凋亡率,减少细胞中C-Caspase-9、C-Caspase-3蛋白表达水平,提高SOD、CAT、GSH-Px水平,减少MDA水平,这说明下调KCNQ1OT1可抑制H2O2诱导的心肌细胞凋亡和氧化损伤。
lncRNA可以通过影响下游基因、信号通路的转导等发挥不同的生物学作用[21]。有研究显示,KCNQ1OT1通过激活Wnt信号通路参与骨折延迟愈合[22]。Wnt信号通路在人体组织中的作用广泛,参与多种疾病进展,β-catenin是经典Wnt信号通路的关键因子,其水平高低与信号通路激活程度有关[23-24]。本实验发现,下调KCNQ1OT1能够抑制H2O2诱导的心肌细胞中β-catenin、c-Myc蛋白表达,下调KCNQ1OT1可降低Wnt信号通路激活水平,机制可能与Wnt信号通路有关。Wnt信号在心肌损伤中高表达,氧化应激诱导心肌细胞中Wnt信号激活,而抑制Wnt信号通路改善心肌细胞损伤[25]。本实验表明,Wnt信号激活剂能够逆转下调KCNQ1OT1对H2O2诱导的心肌细胞凋亡和氧化损伤的保护作用,这提示下调KCNQ1OT1通过Wnt信号通路发挥作用,进而参与心肌细胞氧化损伤。
总而言之,下调KCNQ1OT1通过抑制Wnt信号通路改善H2O2诱导的心肌细胞凋亡和氧化损伤。现阶段对KCNQ1OT1通过何种靶向机制影响Wnt信号通路发挥作用还不明确,在以后的实验中会进行具体探讨。
