Chk1抑制剂逆转TP53突变型乳腺癌细胞的顺铂耐药*
2021-03-02简丹妮熊慧华袁响林
秦 凯,简丹妮, 熊慧华,彭 慧,袁响林,程 熠△
1华中科技大学同济医学院附属同济医院肿瘤科,武汉 430030 2华中科技大学同济医学院附属协和医院耳鼻咽喉-头颈外科,武汉 430022
乳腺癌是全世界女性中最常见的恶性肿瘤之一。临床上,这种高度异质性疾病被分为3个基本亚型,即雌激素受体(ER)阳性、人表皮生长因子受体2(HER2)扩增型和三阴性乳腺癌(triple-negative breast cancer,TNBC),后者缺乏雌激素受体(ER)、孕酮受体(PR)和HER2[1-2]。TNBC在非裔美国妇女中的发病率较高[2],目前还没有针对这种疾病的特定靶向治疗方法。与其他亚型相比,TNBC患者局部或远处复发的风险更高,预后更差[2-4]。
TP53在遗传毒性应激诱导细胞周期阻滞方面起到重要作用,并借此维持基因组的完整性。大约30%的乳腺癌患者中含有TP53基因的体细胞突变。超过80%的TNBC患者存在TP53点突变或缺失[5-6]。野生型TP53细胞的主要特征是细胞可以老化,但突变型则不能,因此TP53突变状态与化疗耐药有关。TP53突变状态也与乳腺癌患者治疗反应差和生存率下降有关[7-8]。因此,迫切需要采用新的治疗策略来克服TP53突变患者固有的化疗耐药性。在真核细胞中,细胞周期受3个检查点(G1/S、S期和G2/M检查点)的精细调节,而p53调节G1/S检查点。因此,TP53缺陷细胞通过ATR/Chk1途径依赖G2/M期检查点来阻止DNA损伤后细胞周期的进展。细胞周期检查点激酶1(cell cycle checkpoint kinase 1,Chk1)和(或)ATR抑制可能导致TP53缺陷型肿瘤的有丝分裂改变和凋亡[9]。
临床前研究数据显示,Chk1抑制剂(Chk1 inhibitor,Chk1 i)选择性地增强DNA损伤剂(如顺铂)在TP53突变癌细胞中的作用[10-12]。近年来,大量的Chk1/Chk2抑制剂被开发用于治疗多种癌症。AZD7762是一种新的ATP位点依赖性等电位抑制剂。它对检查点激酶表现出比其他激酶更高的特异性[13]。在这项研究中,我们研究了AZD7762对TNBC细胞的作用,探讨AZD7762是否能提高TNBC细胞对顺铂的敏感性。
1 材料和方法
1.1 细胞培养
人乳腺癌细胞系BT-549、HCC70、MDA-MB-231、T47D和MCF-7(American type culture collection,美国)在含有10%胎牛血清(Invitrogen,美国)的DMEM中培养。
1.2 siRNA与慢病毒体外转染
采用Control、Chk1和Chk2 ON-TARGET plus siRNA SMARTpool(GE Dharmacon,美国),按照说明书以Lipofectamine-3000在40 nmol/L的最终浓度下进行siRNA体外转染。
1.3 细胞活力测定
细胞[5000个细胞(100 μL/孔)]在96孔板(Sarstedt,德国)中培养,并在指定的时间点以指定浓度药物处理。CCK8分析法(Dojindo molecular technologies,日本)用于评估细胞活力,以载体处理的对照组对数据进行标化。所有细胞活力实验重复进行3次。
1.4 集落形成实验
细胞(1000个细胞/孔)置于6孔板中,与指定药物一起孵育7~10 d。存活克隆用4%甲醛固定5 min后用0.5%结晶紫在无水乙醇中染色。然后用数字扫描仪(佳能CANOSCANNLIDE220扫描仪)拍摄细胞照片。
1.5 组合指数分析
在96孔板中加入100 μL细胞悬液(约5000个细胞),并在37℃下用递增剂量的AZD7762(稀释比1∶4,Selleckchem,美国)和顺铂(稀释比1∶4,Sigma-Aldrich,美国)孵育72 h。采用1.3项方法评估细胞活力。利用CalcuSyn软件,用Chou-Talalay方程计算2种化合物的协同效应,得到效价(IC50值)和剂量-效应曲线。组合指数(CI)小于0.5表示协同作用,CI大于0.5表示有无协同作用。所有细胞活力实验重复进行3次。
1.6 细胞周期分析
细胞在指定药物浓度处理24 h后,收集细胞,用70%乙醇固定,并在-20℃下储存24 h。在PBS中2次洗涤后,用碘化丙二钠(PI 5 mg/mL,NaCl 9.65 mmol,0.1%柠檬酸三钠和RNase A 100 mg/mL)在室温下染色0.5 h。在FACS-Canto系统(BD Biosciences,美国)中检测细胞周期曲线,并使用FlowJo软件进行分析。
1.7 膜联蛋白-Ⅴ染色
细胞在指定药物浓度处理24 h后取细胞,用Annexin Ⅴ/PI染色。用流式细胞术(FACS-Canto)计算Annexin Ⅴ-PI阳性细胞的百分比。数据以至少2个独立实验的平均值表示。
1.8 MCF-7-shp53细胞的建立
当对数生长的MCF-7细胞达到大约60%的融合率时,利用对照逆转录病毒(MKOPuro)或表达p53特异性shRNA的逆转录病毒(pMKOPuro)感染MCF-7细胞,其MOI为10。24 h后,更换培养液,在1 μg/mL嘌呤霉素的培养液中筛选细胞。收集并扩增耐药细胞株。细胞裂解,蛋白质敲除用免疫印迹法验证。
1.9 免疫印迹法(Western blot)
细胞裂解物在裂解缓冲液[1% NP-40、0.1 mol/L KH2PO4(pH 7.5)、0.1 mmol/L β-甘油磷酸盐和1×完整蛋白酶抑制剂混合物(罗氏诊断公司)]中制备。将来自每个样品的总共30 mg全细胞裂解物在Mini-Protean TGX无染色预制凝胶(Bio-Rad,美国)上电泳,印迹到硝酸纤维素膜上,并与这些主要抗体一起孵育过夜:Chk1(#2345S)、磷酸化Chk1(Ser296)(#2349S)、磷酸化H2AX(Ser139)(γ-H2AX)(#2577S)、裂解的PARP(Asp214)(#5625)和PARP1(#9542S)(Cell Signaling,USA)。Chk2(sc-5278)、p53(sc-126)(Santa Cruz,美国)和抗β-肌动蛋白抗体(Sigma,Merck KGaA,Darmstadt,德国)用作内参对照。
1.10γ-H2AX/磷酸化组蛋白H3/碘化丙啶共染色
将细胞(5×105/mL)接种到96孔板,并按照说明书在37℃处理48 h。然后收集细胞并在-20℃下用70%乙醇固定24 h。在用PBS加0.5% Tween 20和PBS+0.1%BSA洗涤2次后,用Alexa-Fluor©488结合磷酸化组蛋白H3抗体(#9708,Cell Signaling,美国),稀释比为1∶200、PE-CF594小鼠抗H2AX(pS139)(#564719,BD Biosciences,美国,稀释比为1∶200)和组蛋白H2AX兔pAb(A11540,Abclonal,中国,稀释比为1∶1000)培养细胞,在冰上放置1 h。在PBS中2次洗涤后,用70%乙醇固定细胞并在-20℃下保存24 h,然后在室温下用PI染色液(PI 5 mg/mL,NaCl 9.65 mmol/L,0.1%柠檬酸三钠和RNase A 100 mg/mL)染色0.5 h。使用BD FACS Canto进行细胞周期分析和磷酸化组蛋白H3或H2AX阳性细胞的检测。使用FlowJo软件进行定量分析。
1.11统计学分析

2 结果
2.1 乳腺癌细胞对AZD7762的敏感性依赖于TP53状态
我们首先评估了AZD7762对5种乳腺癌细胞株(BT-549、HCC70、MDA-MB-231、T47D和MCF-7)细胞活力的影响。细胞暴露于不同浓度的AZD7762中,用CCK8法测定细胞活力。分别计算每个细胞系的IC50值。结果显示,AZD7762以剂量和时间依赖的方式诱导上述癌细胞死亡(图1A)。IC50值表明MCF-7是最具AZD7762耐药性的乳腺癌细胞系(图1A)。对这些细胞系中常见突变与IC50值之间的关联分析表明,其对AZD7762的敏感性与TP53突变状态相关,而与ARID1A、ATM、ATR、BRCA1/2、KRAS、PIK3CA和PTEN无关(图1B)。
为了进一步研究乳腺癌细胞对AZD7762的敏感性与TP53突变状态之间的关系,我们建立了1对由MCF-7(p53WT)和MCF-7-shp53细胞(转染p53慢病毒shRNA的衍生细胞系)组成的乳腺癌细胞系。p53基因敲除的有效性通过Western blot进行验证(图1C)。将2株细胞分别暴露于不同剂量的AZD7762,用集落形成实验和CCK8实验评估细胞活力。如CCK8和集落形成分析所示(图1D和图1E),MCF-7-shp53细胞比MCF-7-p53WT细胞对AZD7762更敏感。
2.2 AZD7762通过促进DNA损伤和凋亡导致细胞死亡
为了探讨AZD7762对乳腺癌细胞毒性作用的潜在机制,我们用不同的方法对乳腺癌细胞进行凋亡检测。Annexin-Ⅴ凋亡测定结果再次验证了细胞活力实验结果,即AZD7762显著增加了乳腺癌细胞凋亡(图2A)。凋亡标记物cleaved PARP的表达证

A:5种乳腺癌细胞系经不同剂量AZD7762作用96 h后的药物反应曲线;B:左为测试5种细胞系中的选定突变,TP53突变与AZD7762敏感性相关,右为AZD7762在5种乳腺癌细胞中的IC50;C:蛋白质印迹验证MCF-7 shp53细胞中p53的稳定抑制;D:CCK8法测定MCF-7或MCF-7 shp53细胞活力;E:100 nmol/L AZD7762处理12 d后MCF-7和MCF-7 shp53细胞集落形成的代表性图像;与cont组比较,**P<0.01图1 乳腺癌细胞对AZD7762的敏感性依赖于TP53状态Fig.1 The sensitivity of breast cancer cells to AZD7762 was dependent on TP53 status
实凋亡诱导具有剂量和时间依赖性(图2B)。AZD7762显著下调Chk1功能抑制的标志物磷酸化Chk1 ser296的表达,表明其对靶点的影响,并增加DNA损伤标记物γ-H2AX的表达,证实其对DNA损伤的诱导效应(图2C)。通过流式检测发现MCF-7-shp53细胞的凋亡率高于MCF-7细胞,证实了AZD7762是通过p53突变依赖性地诱导凋亡(图2D)。泛半胱氨酸蛋白酶抑制剂Z-VAD-FMK对凋亡途径的抑制有效地降低了AZD7762的药物杀伤力(图2E),证实了AZD7762通过诱导乳腺癌细胞凋亡而导致的细胞死亡。

A:T47D细胞暴露于指定浓度的AZD7762 24 h后的代表性流式细胞图;B:条形图显示通过流式细胞术分析T47D细胞观察到的时间和剂量依赖性凋亡;C:Western blot检测cleaved PARP1(用于测量凋亡细胞死亡的c-PARP1)和H2AX(测量DNA损伤);D:显示MCF-7或MCF-7 shp53细胞暴露于指定剂量AZD7762 24 h后的代表性流式细胞图;E:用不同浓度的AZD7762处理T47D细胞,加入或不加入Z-VAD-FMK(泛半胱天冬酶抑制剂),96 h后用CCK8法检测细胞活力,与DMSO+AZD7762组比较,**P<0.01。图2 AZD7762通过增加DNA损伤和细胞凋亡导致细胞死亡Fig.2 AZD7762 resulted in cell death by increasing DNA damage and apoptosis
2.3 AZD7762终止TP53突变细胞S期和G2/M期阻滞
TP53突变癌细胞的特征是G1/S检查点缺陷。为了评价AZD7762对细胞周期进程的影响,我们用AZD7762(IC50)处理细胞24 h,然后对PI和磷酸组蛋白H3(有丝分裂的标志物)进行染色。结果表明,AZD7762使TP53突变型乳腺癌细胞的G1期细胞数减少,S期和G2/M期细胞数显著增加(图3A),尤其是M期细胞数(P<0.01)(图3A、3B)。此外,AZD7762显著增加了MCF-7-shp53细胞中S期和M期的细胞数量(均P<0.01),但在野生型细胞中没有(图3C),证实其依赖于细胞的TP53状态发挥作用。
2.4 AZD7762增加TP53突变型乳腺癌细胞对顺铂的敏感性
顺铂是临床治疗乳腺癌常用的化疗药物。与先前关于TP53突变与化疗耐药相关的报道一致,我们发现MCF-7-shp53细胞比MCF-7细胞对顺铂更具耐药性(图4A)。Western blot分析显示,顺铂增加了T47D细胞中Chk1磷酸化(图4B),可能导致顺铂耐药,为Chk1抑制剂和顺铂联合治疗提供了理论依据。接下来,我们评估AZD7762是否提高细胞(特别是对顺铂耐药的TP53突变细胞)对顺铂的敏感性。根据CCK8和集落形成分析(图4C、4D),AZD7762和顺铂联合比单一作用具更强的细胞毒性(P<0.01)。用不同的组合指数(CI)分析进一步评价AZD7762与顺铂的协同作用。等容图分析表明,联合疗法对T47D细胞(CI=0.2045)和MDA-MB-231细胞(CI=0.1204)的抗肿瘤作用是协同作用而不是相加的(图4C)。接下来,我们发现AZD7762和顺铂无论作为单一药物或联合使用均会导致DNA损伤。Western blot结果显示,与单一药物相比,联合作用显著增加了DNA损伤诱导(γH2AX)和凋亡(PARP1断裂)(图4E)。
为了证实AZD7762对TP53突变细胞顺铂致敏的靶向效应,我们通过siRNA敲除T47D细胞中的Chk1、Chk2或两者。Chk1或Chk2的敲除增加了顺铂的细胞杀伤效应和DNA损伤诱导(图4F,P<0.01)。综上所述,上述结果表明,通过在化疗中加入Chk1抑制剂,可以克服TP53突变型乳腺癌细胞对顺铂的耐药性。

A:上图为50 nmol/L AZD7762处理24 h的T47D细胞的代表性细胞周期分析;下图为50 nmol/L AZD7762处理T47D细胞24 h,并进行pH3和PI染色流式细胞术分析;B:50 nmol/L AZD7762作用24 h后T47D和MDA-MB-231细胞中不同细胞周期分布;C:500 nmol/L AZD7762处理24 h的MCF-7和MCF-7 shp53细胞中不同细胞周期分布;与DMSO处理组比较,**P<0.01图3 AZD7762终止S期和G2/M期细胞周期停滞Fig.3 AZD7762 abrogated S and G2/M phase cell cycle arrest
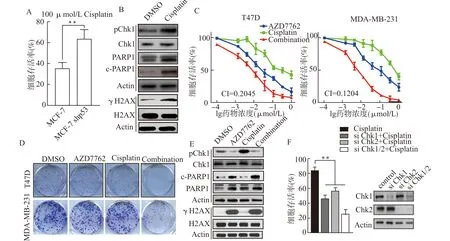
A:条形图显示MCF-7或MCF-7 shp53细胞经顺铂(100 μmol/L)处理48 h后的存活率,**P<0.01;B:用顺铂(50 μmol/L)孵育48 h后T47D细胞中指示蛋白的表达;C:顺铂与AZD7762联合作用72 h(AZD7762∶顺铂=1∶100)对T47D和MDA-MB-231细胞的药物反应曲线,用Chou-Talalay方程计算CI值;D:T47D和MDA-MB-231细胞集落形成,按说明书处理10 d,结晶紫染色。E:用10 nmol/L对照siRNA、si-Chk1转染T47D细胞,观察顺铂(50 μmol/L)、AZD7762(50 nmol/L)和联合治疗48 h后T47D细胞中所示蛋白的表达;F:si-Chk2或si-Chk1/2治疗24 h,然后用顺铂(25 μmol/L)给药48 h,用CCK8法分析生存率。**P<0.01。图4 AZD7762使TP53突变型乳腺癌细胞克服顺铂耐药Fig.4 AZD7762 sensitized TP53 mutant breast cancer cells to cisplatin
2.5 顺铂联合AZD7762诱导TP53突变型乳腺癌细胞有丝分裂改变
在TP53突变细胞中,功能性Chk1对于S和G2细胞周期检查点至关重要。因此,我们研究了DNA损伤和凋亡是否与有丝分裂改变诱导的细胞死亡有关。用细胞周期指示剂PI、DNA损伤标记物γH2AX和有丝分裂标记物磷酸组蛋白H3共染色。AZD7762和顺铂联合作用显著增加了γH2AX染色,而顺铂或AZD7762单药作用可导致细胞发生轻度或中度的DNA损伤(图5A和图5B)。AZD7762诱导的γH2AX阳性细胞主要处于S期和G2/M期。AZD7762和顺铂联合治疗增加了γH2AX阳性G2/M细胞群,表明AZD7762消除了G2/M期阻滞(图5C)。此外,大多数G2/M期细胞呈γH2AX阳性(图5D)。这些数据表明AZD7762作为Chk1抑制剂可通过消除G2/M检查点阻滞使细胞对顺铂敏感,使含有高水平DNA双链断裂的细胞进入有丝分裂,导致有丝分裂的改变。

A:将T47D细胞与顺铂(50 μmol/L)、AZD7762(50 nmol/L)共孵育48 h,H2AX和PI染色后流式细胞仪检测;B:T47D细胞中γH2AX阳性群体的百分比;C:在T47D中量化γH2AX阳性G2/M期细胞;D:T47D细胞转染10 nmol/L对照siRNA,si-Chk1,si-Chk2或si-Chk1/2持续24 h,用顺铂(50 μmol/L)给药48 h,H2AX和PI染色后流式细胞术检测,对γH2AX阳性G2/M期细胞进行定量分析;**P<0.01。图5 顺铂联合AZD7762诱导TP53突变型乳腺癌细胞有丝分裂改变Fig.5 Cisplatin plus AZD7762 induced mitotic mutation in TP53 mutant breast cancer cell
3 讨论
TNBC是最致命的乳腺癌亚型,预后最差,现有的治疗策略对其没有特定的分子靶点[14]。因此,开发TNBC的靶向治疗方法是乳腺癌研究的重中之重。本研究发现TNBC的TP53突变可能是Chk1抑制药物AZD7762单药作用或与顺铂联合作用的有效靶点。AZD7762与顺铂联合应用不仅协同降低了细胞活力,而且加重了DNA损伤,证实了细胞周期检查点的损伤和DNA损伤的累积作用。
TP53在各种压力下被激活,通过诱导DNA修复、细胞周期停滞和凋亡来抑制细胞转化。TP53突变型肿瘤细胞依赖Chk1/2阻滞S期和G2/M期细胞周期。Cdc25A磷酸酶是Chk1的关键靶点,在DNA损伤的情况下可以磷酸化,导致Cdc25A蛋白水解和细胞周期停滞[15-16]。当Chk1抑制阻断S和G2/M检查点时,p53缺陷的癌细胞发生有丝分裂改变和凋亡。最近的研究报道了不同的Chk1/Chk2抑制剂作为单一疗法,或联合化疗(放疗)治疗各种类型癌症的疗效[7,17-19]。Gadhikar等[20]发现Chk1/2抑制剂可逆转TP53突变型头颈癌细胞的顺铂耐药。与这些研究结果一致,我们证实Chk1在TP53突变型乳腺癌细胞的存活中起着决定性的作用。AZD7762降低细胞活力的方式具有剂量和时间依赖性,且敏感性与细胞的TP53突变状态相关。Chk1磷酸化CDC25A和CDC25C导致其失活/降解,阻止它们激活细胞周期蛋白依赖激酶。综上所述,我们的研究表明顺铂和AZD7762相互作用诱导TP53突变型乳腺癌细胞死亡。DNA损伤的增加是评价细胞对联合治疗反应的替代指标。
目前的数据有力地支持了Chk1抑制剂药物AZD7762和顺铂联合治疗TP53突变型乳腺癌的临床前评估。未来的研究将集中在这一策略的动物实验上,确定最佳的联合方案,以及期待在乳腺癌患者中进一步开展Ⅰ期临床试验。
