表皮生长因子受体抑制剂对氧糖剥夺/复氧诱导的血脊髓屏障损伤的保护作用研究
2021-03-01李在望姜冬梅韩晶涂景梅王倩
李在望,姜冬梅,韩晶,涂景梅,王倩
脊髓损伤(spinal cord injury,SCI)后往往会造成受损平面以下肢体和躯干严重的运动、感觉功能缺损,大小便及性功能障碍,且这些缺损往往不可逆[1]。SCI后的神经功能缺损由原发性损伤和继发性损伤所造成。原发性损伤是指原发疾病对脊髓造成的直接损伤,而继发性损伤与SCI后过度炎症反应及血脊髓屏障(blood-spinal cord barrier,BSCB)的破坏密切相关[2]。因此,SCI后如何控制炎症反应和保护BSCB结构和功能的完整是减轻继发性损伤的关键环节。
BSCB是中枢神经系统(central nervous system,CNS)特有的屏障结构,与血脑屏障(blood-brain barrier,BBB)类似,其主要由脊髓微血管内皮细胞、星形胶质细胞、血管周围的小胶质细胞、周细胞及基膜组成,是维持脊髓神经组织微稳态的高选择性屏障结构[3]。目前有研究证实,在SCI后,BSCB结构的主要组成细胞(微血管内皮细胞、星形胶质细胞及小胶质细胞)出现表皮生长因子受体(epidemical growth factor recepter,EGFR)的大量活化[4-6]。EGFR是位于细胞质膜上的受体型酪氨酸蛋白激酶(tyrosine-protein kinase,TPK),在细胞存活、生长、分化、增生及凋亡等信号转导通路中起着关键性调节作用[7]。研究发现,EGFR信号通路参与细胞屏障功能的调节,而微血管损伤、肺损伤及肠道内膜的通透性异常改变均与EGFR活化相关[8]。
有研究证实EGFR抑制剂能改善SCI后神经功能缺损症状[5,6,9],推测其机制可能与维持SCI后BSCB完整性,减轻脊髓继发性损伤有关。本实验通过建立BSCB体外模型,给予氧糖剥夺/复氧(oxygen and glucose deprivation/reoxygenation,OGD/R)处理,应用EGFR抑制剂PD168393对损伤的BSCB进行干预,观察内皮细胞通透性、紧密连接蛋白的表达及BSCB细胞分泌炎症因子的变化,以探讨EGFR抑制剂PD168393对BSCB通透性的影响及其可能的机制。
1 材料与方法
1.1 主要试剂与材料
①实验动物:新生24 h内SD大鼠10只,购自常州卡文斯实验动物有限公司。②主要试剂:PD168393购于德国Calbiochem公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-右旋糖酐(dextranum)(F-D)购于美国Sigma公司;兔抗Occludin、小鼠抗ZO-1抗体均购于Invitrogen公司;白细胞介素(interleukin,IL)-6、肿瘤坏死因子(tumor necrosis factor,TNF)-αELISA试剂盒均购于美国R&D公司;诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)ELISA试剂盒购于AVIVA公司。
1.2 方法
1.2.1 建立体外BSCB模型培养原代大鼠来源的脊髓微血管内皮细胞和混合胶质细胞,细胞95%融合后进行消化,重悬后以5×104/mL密度取1 mL接种在12孔板Transwell(聚酯膜,直径12 mm,孔径0.4μm)下室,作为滋养层;脊髓微血管内皮细胞取200μL接种在上室(Transwell嵌套内),建立上下双层细胞共培养体系。贴壁后每2天换液1次。常规培养约7 d后,Transwell嵌套内脊髓微血管内皮细胞即可形成内皮细胞屏障样组织,模拟BSCB组成细胞间的相互作用,建立体外BSCB模型[10]。
1.2.2 细胞分组①将体外培养的BSCB模型分为3组:对照组、损伤组和治疗组。②损伤组和治疗组细胞用PBS清洗上、下室3次,加入无糖无血清DMEM培养基;将Transwell及校准的测氧仪放入预缺氧小室中,通入95%N2,5%CO2直至测氧仪调至0.0~0.2,制造无氧环境。在培养箱内培养6 h后,将2组细胞取出,更换为正常糖、血清的培养基,放入饱和湿度、正常含氧细胞培养箱中进行复氧(此时氧浓度约20%),复氧时间分别为3 h、6 h和12 h;其中治疗组在复氧开始时即给予10 nM PD168393进行干预(给药浓度参照既往研究报道)[11]。对照组细胞用含糖、含血清的DMEM/F-12完全培养基洗涤3次,然后继续放入正常温度和含氧度的培养箱中培养。
1.2.3 荧光染料渗漏实验将上述处理3组的上室培养液除去,在Transwell嵌套中加入200μL FITC-右旋糖酐(F-D)(1 mg/mL),置于培养箱中30 min。从各组底室分别取100μL(每孔取3次)置于96孔板,加入不同已知浓度的F-D,用荧光检测仪在540 nm处读取各孔溶液的荧光强度。根据标准曲线,计算各组渗透到底室的F-D浓度,评估渗透性随时间的变化趋势。
1.2.4 跨膜电阻(transepithelial electrical resistance,TEER)测量使用来自美国EMD Millipore公司的Millicell ERS-2电阻仪测量3组在不同复氧时间点的TEER值。单位面积电阻/(Ω×cm2)=(所测得电阻值-空白电阻值)×有效膜面积(本实验采用12孔板Tranwell系统,有效生长膜1.13 cm2)。
1.2.5 免疫荧光染色当各组细胞爬片的细胞长至95%融合时,取出爬片,常规4%多聚甲醛固定15~20 min,0.2%Triton/PBS液室温透膜15 min,山羊血清白蛋白室温封闭1 h,加预先用抗体稀释液稀释的一抗,于4℃冰箱中孵育过夜,用PBS替代一抗作为阴性对照;滴加二抗(1∶300),室温避光孵育1 h;加核染料DAPI工作液(1 mg/mL),室温复染5 min;50%甘油封片;于荧光显微镜下观察并照相;上述每一步操作间均用PBS洗5 min/次×3次。
1.2.6 Western Blot法OGD/R后6 h,收集各组细胞,加入裂解液冰上孵育并彻底匀浆,离心后留取上清,BCA法测定蛋白浓度。聚丙烯酰胺凝胶电泳分离蛋白;全湿式电转法转移到PVDF膜上;5%封闭液封闭2 h,分别加入一抗兔抗Occludin、小鼠抗ZO-1(1∶1000);内参为GAPDH(1∶500),4℃孵育过夜。用TBST溶液洗涤10 min/次×3次;加入HRP标记羊抗鼠、羊抗兔IgG二抗(1∶1000),4℃过夜;TBST洗膜10 min/次×3次,加ECL发光显示液在暗室中摄像,凝胶成像分析系统进行分析。
1.2.7 ELISA法ELISA法测定各组细胞分泌的致炎因子IL-6、TNF-α、iNOS,具体操作步骤按ELISA试剂盒的说明进行。
1.3 统计学处理
采用SPSS 22.0软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用单因素方差分析;P<0.05为差异有统计学意义。
2 结果
2.1 EGFR抑制剂对OGD/R诱导的BSCB损伤模型通透性的影响
对照组渗透到底室F-D的平均浓度为(230±34)nmol/L;损伤组的F-D浓度在复氧3 h、6 h和12 h分别为(280±53)nmol/L、(300±57)nmol/L和(270±42)nmol/L,均高于对照组(P<0.05或P<0.01);治疗组的F-D浓度在复氧3 h、6 h和12 h分别为(240±39)nmol/L、(250±40)nmol/L和(238±33)nmol/L,均低于损伤组(均P<0.05),见图1 A。损伤组的TEER值在复氧3 h、6 h、12 h后均低于对照组(均P<0.01),而治疗组在这3个时间点,所测TEER值均高于损伤组(均P<0.05),见图1B。
2.2 EGFR抑制剂对OGD/R诱导的BSCB损伤模型紧密连接蛋白表达的影响
与对照组相比,损伤组紧密连接蛋白ZO-1和Occludin的表达量显著降低(均P<0.05),而治疗组ZO-1和Occludin的表达量较损伤组显著升高(均P<0.05),见图2A、B。免疫荧光染色结果显示,对照组细胞排列紧密,呈条索状排列,符合正常内皮细胞生长形式,紧密连接蛋白ZO-1和Occludin在细胞间呈连续性的线条样外观,见图2C1、D1;损伤组ZO-1和Occludin表达量显著下调,线条显著变细,部分线条断裂或部分缺损,见图2C2、D2;治疗组ZO-1和Occludin荧光线条虽仍有缺损,但较损伤组的断裂和缺损均明显减少,表达均有所增加,见图2C3、D3。
2.3 EGFR抑制剂对OGD/R诱导的BSCB损伤模型致炎因子表达的影响
ELISA结果显示,与对照组相比,损伤组分泌的致炎因子IL-6、iNOS、TNF-α均显著上调。IL-6在OGD/R 6 h时表达量增幅最大,见图3A。iNOS、TNF-α在OGD/R后的表达也增加,呈缓慢上升的趋势,见图3B、C。OGD/R 12 h时,损伤组IL-6、iNOS分泌逐渐减少,而TNF-α仍有持续的高表达。治疗组在各时间点致炎因子IL-6、iNOS、TNF-α的分泌均较损伤组显著下调(均P<0.05),见图3。
3 讨论
BSCB是CNS高度分化的神经血管特殊化内皮结构,而微血管内皮细胞是BSCB重要组成细胞[3]。紧密连接蛋白是微血管内皮细胞分泌的一种特殊蛋白,可填补内皮细胞间隙,使内皮细胞形成紧密连接状态,对BSCB的功能维持有极其重要的意义[12]。ZO-1和Occludin是紧密连接的主要蛋白质,也被认为是CNS屏障结构正常或损坏时的敏感标记物[12]。Occludin是第1个被发现的完整的紧密连接膜蛋白,分子量56 kDa,可以通过羧基与ZO-1连接[12]。Occludin在CNS血管内皮上的表达较非神经组织的高,这是BBB与BSCB通透性明显低于其它血组织屏障的重要原因之一[12]。ZO-1蛋白不仅作为细胞内多个信号通路的支架,也涉及紧密连接蛋白的调节功能[12]。在SCI的过程中,ZO-1通过辅助紧密连接装配、传递相邻细胞间的信号、影响血管内皮细胞的基因表达等途径,参与BSCB通透性变化的过程[13]。

图1各组BSCB在OGD/R处理后的通透性
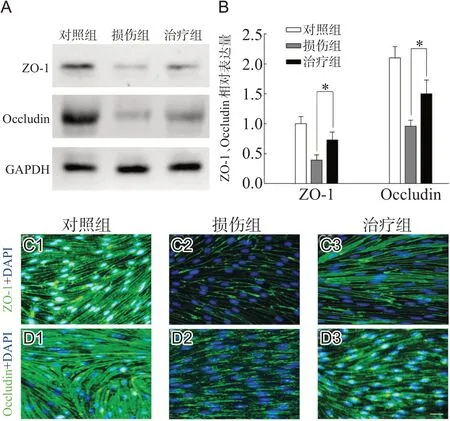
图2 EGFR抑制剂对OGD/R处理后BSCB紧密连接蛋白ZO-1和Occludin表达量的影响
有研究证实在SCI后BSCB通透性增大,紧密连接蛋白表达减少[14,15]。本研究构建体外BSCB模型OGD/R损伤后,免疫荧光显示损伤后的BSCB紧密连接蛋白表达减少,荧光染料渗漏实验及内皮细胞跨膜电阻检测均证实BSCB在损伤后通透性明显增加,说明BSCB的结构破坏、屏障功能受损。在western blot和免疫荧光检测中发现,治疗组紧密连接蛋白的表达较损伤组增加,说明EGFR抑制剂有助于减轻BSCB损伤后紧密连接蛋白的破坏。本研究结果还显示,体外BSCB在OGD/R损伤后致炎因子(TNF-α、IL-6、iNOS)分泌明显增加,而应用EGFR抑制剂干预后致炎因子的表达明显下调。有研究证实致炎因子的表达与紧密连接蛋白表达呈负性相关,抑制过度的炎症反应可减少紧密连接蛋白缺失,保护BSCB完整性[10]。
目前有多个研究证实EGFR抑制剂对CNS损伤有保护作用[5-7,9],但其作用机制一直未完全明确。目前有研究证实SCI后活化的星形胶质细胞和小胶质细胞均出现EGFR大量活化,EGFR抑制剂既能有效抑制星形胶质细胞和小胶质细胞EGFR活化,又能明显抑制过度的胶质增生[5,6,9]。SCI后BSCB的破坏和胶质细胞活化引发的炎症反应是导致脊髓继发损伤的2个关键病理改变[16]。SCI后BSCB破坏导致血液中白细胞和致炎因子进入神经组织,激活星形胶质细胞、小胶质细胞[2]。胶质细胞活化后引发炎症损伤反应,不仅导致神经元和少突胶质细胞损伤,还进一步破坏BSCB的完整性,使脊髓继发性损伤作用不断放大,形成脊髓组织炎症损伤的恶性循环(即正反馈损伤)[10,17]。阻断这一炎症损伤的恶性循环是治疗SCI的一个重要策略。根据本研究结果,我们推测在BSCB损伤后应用EGFR抑制剂,可能通过抑制胶质细胞EGFR的活化而减缓胶质细胞的过度增生,减少过度的炎症反应所造成的炎症损伤,起到保护BSCB的作用。
综上所述,EGFR抑制剂PD168393可减少BSCB在OGD/R损伤后致炎因子的表达,并减少BSCB紧密连接蛋白的脱失,维护BSCB的完整性。
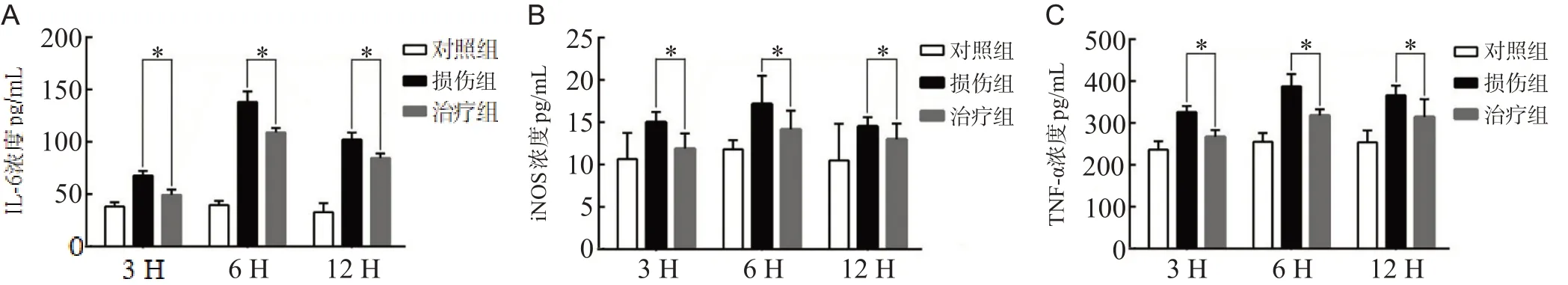
图3 EGFR抑制剂对OGD/R处理后BSCB分泌致炎因子的影响
