血神经屏障和Claudin-1蛋白在大鼠慢性神经病理性疼痛中的作用
2021-03-01杨少兵胡柳迟晓慧张志发
杨少兵,胡柳,迟晓慧,张志发
神经病理性疼痛是神经系统受损导致的慢性或持续性疼痛,其主要特征是自发痛、痛觉过敏、触诱发通和感觉异常,并在神经损伤后持续很长时间,严重影响患者的生活质量。目前关于神经病理性疼痛的发病机制尚未明了,且对其治疗也存在很多缺陷。深入探索疼痛的发病机制,寻找疼痛治疗靶点,对提高疼痛治疗效果有着深远的意义。
最近研究表明血神经屏障(blood nerve barrier,BNB)参与神经病理性疼痛的发生发展[1]。BNB主要由神经束膜和神经内膜组成,正常情况下能够维护神经内环境稳定,保护神经纤维。但在某些病理状态下(如坐骨神经受损后),BNB通透性增加,屏障功能减弱[2],外周的纤维蛋白原及炎性因子穿过通透性增加的BNB,作用于外周神经导致痛阈值降低,参与慢性疼痛的病理过程[3]。但BNB在疼痛中的具体调节机制尚不清楚。紧密连接是BNB的结构基础之一,密封蛋白(Claudin)-1是紧密连接蛋白中最重要的一种,Claudin-1表达下降导致BNB通透性增加[4],可能是慢性疼痛发生发展的关键环节。本研究拟制备慢性坐骨神经压迫损伤(chronic constriction injury of sciatic nerve,CCI)模型大鼠,观察Claudin-1和BNB通透性的变化,探讨其在慢性神经性疼痛中的具体作用。
1 材料与方法
1.1 主要试剂与材料
清洁级雌性SD大鼠,体质量180~200 g,购自华中科技大学同济医学院实验动物中心。伊文斯蓝(Evans blue,EB)购自美国Sigma Aldrich公司;兔抗Claudin-1单克隆抗体购自德国Life Technologies公司(货号51-9000),β-actin抗体购自Sigma Aldrich公司(货号#A3854),Lumi-Light荧光试剂盒和DAPI均购自德国Roche公司。逆转录PCR(reverse transcription polymerase chain reaction,RT-PCR)引 物 购 自 德 国MWG Eurofins公司。
1.2 方法
1.2.1 分组所有大鼠随机分为3组,对照组(Control组),假手术组(Sham组)和慢性疼痛组(CCI组),各组6只。后续实验中,每组大鼠各时间点均提取6样标本进行各项实验检测。对照组不做处理;另外2组大鼠经10%水合氯醛(3 mL/kg)腹腔注射麻醉后,俯卧位固定,分离暴露右侧坐骨神经,Sham组仅暴露不结扎,CCI组用4/0丝线在坐骨神经上打4个松结,每个结间隔1 mm,结扎强度以引起小腿肌肉轻度颤动为宜。
1.2.2 行为学观察3组共18只大鼠均在实验前1 d及术后6 h、1 d、7 d和14 d进行机械性触诱发痛测定。将透明有机玻璃箱放置于实验台的铁丝网架上,待测大鼠置于箱中适应15 min后,用Von-frey丝垂直刺激小鼠右后肢的足底中部,使之稍弯成S形,持续时间不超过4 s,出现抬足或舔足行为视为阳性反应,否则为阴性反应。当该力度的刺激不能引起阳性反应时,则给予相邻大1级力度的刺激;如出现阳性反应时,则给予相邻小1级力度的刺激;如此连续进行,每次间隔15 s。计算出50%缩足阈值,绘制大鼠机械性触诱发痛曲线。
1.2.3 BNB渗透检测1%EB溶于5%牛血清白蛋白制备成伊文斯蓝蛋白染剂(Evans blue albumin,EBA)。3组共18只(n=6)大鼠术后1 d提取坐骨神经,4%多聚甲醛固定90 min后,将其浸泡于2 mL的EBA溶液中1 h,再次甲醛固定,OCT胶包埋后切片,显微镜下拍照。每只大鼠取1张图片,用Image J软件测量神经内部EBA总灰度值,计算平均密度,以评价BNB通透性。
1.2.4 RT-PCR为节约实验动物,Control组(未做任何处理)只取6只大鼠的坐骨神经作为所有时间点的阴性对照。3组共66只大鼠(n=6),分别于术前及术后6 h、1 d、7 d和14 d,腹腔注射10%水合氯醛(3 mL/kg)麻醉大鼠后处死,提取坐骨神经。采用Trizol提取液提取坐骨神经总RNA,Nanodrop 2000分光光度计上测量总RNA浓度,使用cDNA-kit试剂盒逆转录合成cDNA,再以cDNA为模板进行PCR反应。引物序列:Claudin-1,上游引物:5’-GGGACAACATCGTGACTG CT-3’,下游引物:5’-CCACTAATGTCGCCAGACCTG-3’;GAPDH,上游引物:5’-AGTCTACTGGCGTCTTC AC-3’,下游引物:5’-TCATATTTCTCGTGGTTCAC-3’。扩增反应条件:95℃预变性10 min,随后95℃变性15 s,60℃退火延伸1 min,40个循环。以循环阈值(Ct值)作为统计参数,GAPDH为内参,结果数据利用Applied Biosystems 7300 SDS软件,采用2-ΔΔCT法进行数据分析。
1.2.5 Western blot Control组取6只大鼠的坐骨神经(n=6)作为所有时间点的阴性对照。3组共66只大鼠在相应时间点腹腔注射10%水合氯醛(3 mL/kg)麻醉后处死,提取坐骨神经,匀浆,超声粉碎,4500 g离心10 min后取上清。采用Bradford法绘制标准曲线,测定蛋白浓度,并计算上样量。蛋白样品与缓冲液混合后,95℃水浴5 min变性,上样,进行聚丙烯酰胺凝胶电泳分离,转印至PVDF膜。PVDF膜经含5%脱脂奶粉的TBST封闭液37℃封闭2 h,加入兔抗Claudin-1抗体(1∶1000稀释),4℃孵育过夜。TBST洗膜10 min×3次,加入HRP标记羊抗兔IgG抗体(1:2000稀释),室温孵育2 h;使用Lumi-Light荧光试剂盒显影并扫描测定Claudin-1蛋白光密度值。TBST洗膜后加入β-actin抗体(1∶25000稀释),室温孵育1 h后,再次使用Lumi-Light荧光试剂盒显影并扫描测定β-actin蛋白光密度值。
1.2.6 免疫荧光染色3组共18只大鼠(n=6)术后1 d经10%水合氯醛(3 mL/kg)腹腔注射麻醉后处死,提取坐骨神经。冰冻切片机制作坐骨神经的横断切片,片厚10µm。标本用3%BSA和1%羊血清封闭后,兔抗Claudin-1抗体1∶100稀释后4℃孵育过夜,使用1∶500稀释的Alexa Fluor 594结合羊抗兔IgG二抗常温孵育60 min,再用DAPI行核染色10 min后,共聚焦显微镜下拍照。每只大鼠各选取1张图片,采用Image J软件测定神经内Claudin-1蛋白阳性表达的综合密度值。
1.3 统计学处理
采用SPSS 18.0统计软件进行分析。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用单因素方差分析或双因素方差分析;P<0.05为差异有统计学意义。
2 结果
2.1 大鼠机械性触诱发痛阈值变化
与Control组和Sham组相比,CCI组大鼠术后1 d右侧后肢机械痛阈值降低,术后7 d降至最低,并且一直持续到术后14 d(均P<0.05),见图1。
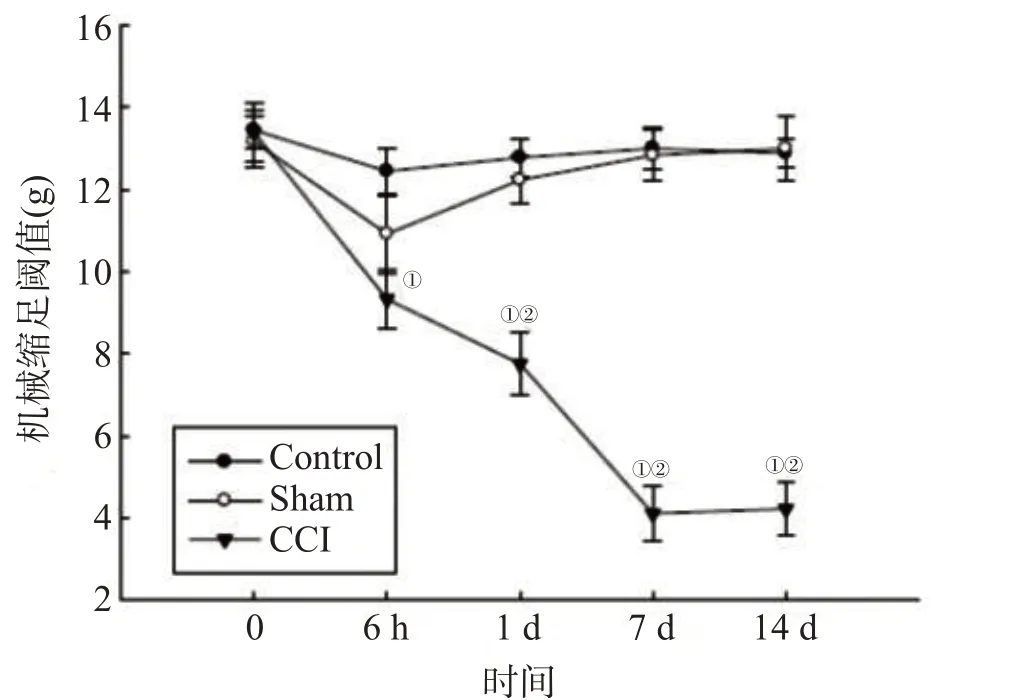
注:与Control组比较,①P<0.05,与Sham组比较,②P<0.05
2.2 BNB渗透性变化
CCI组术后1 d,坐骨神经EBA染色,显微镜下观察发现3组大鼠的坐骨神经外膜结构完整,EBA染色连续均匀,Control组和Sham组的EBA集中在神经外膜,未穿透BNB;CCI组的EBA穿过BNB,渗透入神经内部,见图2。灰度值定量分析结果显示,Control组和Sham组大鼠坐骨神经内EBA含量接近于零,CCI组EBA含量显著增高(P<0.05),见图2。
2.3 坐骨神经内Claudin-1表达水平变化
RT-PCR测量结果显示,术后6 h、1 d、7 d和14 d CCI组大鼠坐骨神经内Claudin-1 mRNA转录水平显著低于其他2组(均P<0.05),且术后1 d下降幅度最为明显,见图3A。Western Blot检测结果显示,术后1 d、7 d和14 d,CCI组大鼠坐骨神经内Claudin-1蛋白表达水平显著低于其他2组(均P<0.05),见图3B。
显微镜下观察坐骨神经切片,可见神经束膜和神经内膜较为完整,未见明显破损。坐骨神经免疫荧光染色显示,Claudin-1蛋白主要分布于神经内膜和神经束膜,见图3C;CCI组坐骨神经损伤后1 d,神经束膜中Claudin-1蛋白荧光强度明显下降,低于其他2组(均P<0.05),见图3D。
3 讨论
本研究采用丝线结扎法制作CCI模型,结果显示CCI组大鼠术后1 d右侧后肢机械痛阈值降低,术后7 d降至最低,并且一直持续到术后14 d,造模成功。
外周神经被神经外膜、神经束膜和神经内膜包绕。神经外膜包绕在最外层,位于第2层的神经束膜将神经纤维分隔成束,并向内延续形成神经内膜。神经束膜和神经内膜组成BNB,将外周神经与周围组织隔离,维护外周神经内环境稳定、保护神经纤维[5]。在一些病理状态下(如糖尿病神经病变、肌萎缩侧索硬化、多发性硬化等),BNB通透性常常被改变,神经内环境稳态失衡[6,7]。小鼠在坐骨神经挤压损伤后,BNB通透性增加,屏障功能减弱[2];CCI大鼠术后3 h即出现BNB通透性增加,且作用可持续至术后2月[8]。这些研究结果均提示,神经损伤引起的慢性疼痛中,BNB的通透性增加。
Lim KT等[3]首次发现BNB通透性的变化直接影响到疼痛的发展:坐骨神经部分结扎后,局部的巨噬细胞通过释放血管内皮生长因子降低紧密连接蛋白ZO-1的表达,从而增加BNB的通透性;受损的坐骨神经中纤维蛋白原及炎性因子释放增加,如白细胞介素(interleukin,IL)-1α,肿瘤坏死因子(tumor necrosis factor,TNF)-β。这些致痛物质穿过通透性增加的BNB,作用于外周神经降低痛阈值,激活或者刺激细胞导致慢性疼痛状态。本研究同样发现大鼠在接受CCI手术后,虽然神经束膜外观正常,但是能够渗透进入坐骨神经内的EBA显著增加,证明BNB完整性被破坏,通透性明显增加。
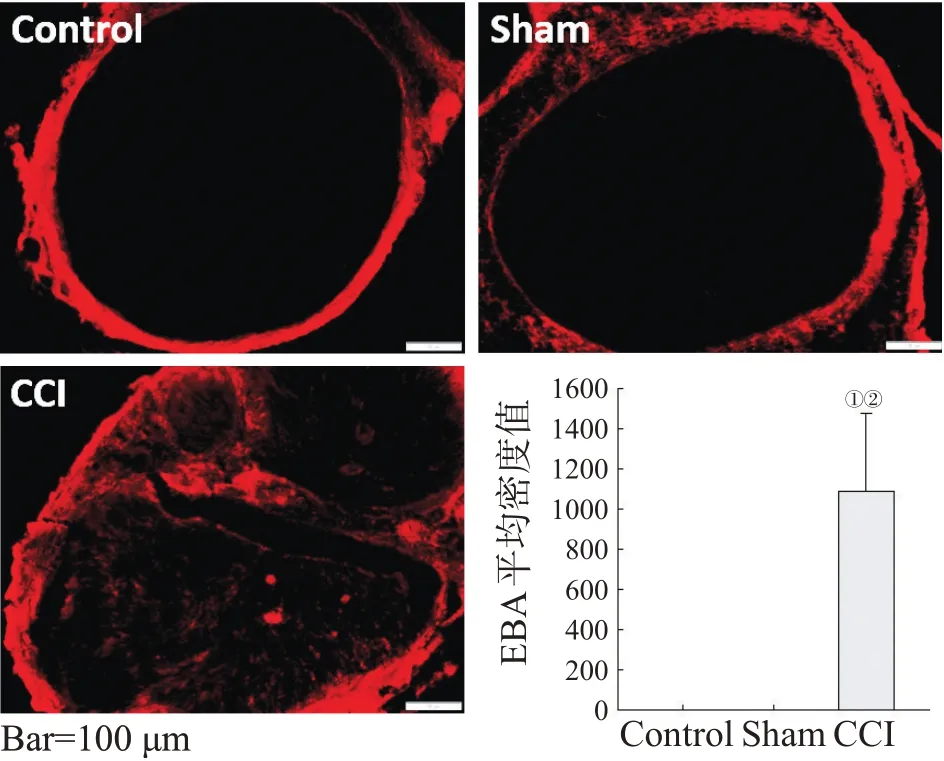
图2大鼠坐骨神经内EBA含量

图3大鼠坐骨神经Claudin-1表达水平变化
BNB的主要结构由多种紧密连接蛋白(Occludin、Claudin、tricellulin等)及紧密连接的骨架蛋白ZO等组成[9],其 中Claudin-1起 关 键 作 用。Claudin-1不 仅 是BNB的重要组成部分,同时也是中枢神经系统血脑屏障的重要组成部分,对维护整个神经系统内环境稳定起到了至关重要的作用。研究发现神经周围局部注射高渗盐水(10%氯化钠)[10]或重组纤溶酶原激活剂[4],能够降低神经内Claudin-1表达水平,增加BNB通透性。Reinhold等[7]发现小鼠在CCI术后7 d时坐骨神经内Claudin-1蛋白下调。本研究进一步揭示了神经病理性疼痛中Claudin-1的变化趋势,结果表明CCI大鼠术后6 h时,Claudin-1的mRNA转录水平开始下降,术后1 d时,Claudin-1蛋白表达水平开始下降,一直持续到术后14 d。这提示,Claudin-1调节BNB通透性可能是神经病理性疼痛的发生发展中的重要环节。
本课题深入观察外周神经受损后BNB通透性及紧密连接蛋白Claudin-1的变化,提示BNB在神经病理性疼痛发生发展机制中的发挥重要作用,其通透性改变可能促进炎症因子进入神经内部,从而导致疼痛的产生,但其具体调节机制尚需进一步研究。降低神经屏障的通透性可能会减少神经内部的炎症因子,从而减缓或者抑制慢性疼痛的发生发展,这将是疼痛治疗的新靶点。
