睾丸精原细胞瘤MRI表现及其鉴别诊断
2021-03-01龙德云叶孝乾张国强
龙德云,舒 亮,叶孝乾,张国强
睾丸精原细胞瘤是一种起源于睾丸原始生殖细胞的低度恶性睾丸肿瘤,可发生于正常位置睾丸和隐睾,好发于中青年。睾丸肿块位置表浅,结合临床病史和超声检查,大部分能够得到诊断;但MRI在肿块定位、诊断的准确性以及显示周围情况方面更加有优势。有研究显示,MRI能较准确评估睾丸肿瘤的病理类型,准确率为92.3%[1]。本研究回顾性分析19例经手术和病理证实的睾丸精原细胞瘤,对其MRI表现进行分析,旨在提高对该病的诊断水平。
1 对象与方法
1.1 对象 收集2007-01至2019-01在我院行MRI检查,并经手术和病理证实的睾丸精原细胞瘤共19例,年龄24~64岁;病程2周~4年,以2周~4个月多见。临床表现大多为无意中发现睾丸肿大,或睾丸肿痛、下坠感。
1.2 仪器与检查方法 患者取仰卧位,毛巾置于阴囊下,可充分显示阴囊且减少运动伪影。应用德国Siemens Magnetom Avanto 1.5 T超导磁共振机扫描,使用体部线圈,层厚2~4 mm,层间距2 mm,扫描序列包括T1WI及T2WI,脂肪抑制T2WI(T2WI+FS),扩散加权成像(DWI),表观扩散系数(ADC),扫描方位为轴位、失状位及冠位。(TSE)T1WI:TR 789~997 ms,TE 9.3~12 ms;(TSE)T2WI:TR 3960~4380 ms,TE 94~95 ms;扩散加权成像(DWI)序 列:TR3007~6103 ms,TE 73~79 ms,采用b值为50 s/mm2,500 s/mm2,1000 s/mm2,并自动生成ADC图。其中8例于静脉注射对比剂多它灵(法国GUERBET公司生产)377 mg/ml(0.2 ml/kg)后采用轴位及冠状位T1-VIBE-FS序列进行多期扫描,同时增加盆腔及中下腹部扫描。
1.3 图像分析和判断标准 由2名高年资医师进行盲阅,主要观察肿块大小、形态、信号特点、强化表现、精囊与附睾累及情况和远处转移情况,并与手术病理结果对照,结合临床资料对精原细胞瘤进行诊断分析。
2 结 果
2.1 手术和病理表现 19例病理诊断均为睾丸精原细胞瘤,其中2例为间变型精原细胞瘤。病理巨检:肿瘤大多为结节融合状、分叶状团块,质软、质中或质嫩,边界清楚,无包膜(图1)。组织学表现:切面为灰红、灰褐,呈鱼肉样,或表现为灰红、红、灰白、灰黄(图2);其中伴有斑片状、大片凝固性坏死11例,出血2例。显微镜下(HE,×200)所见:肿瘤细胞被含有淋巴细胞的纤维束分隔成大小不一的巢状或致密腺泡状,瘤细胞大小均匀,排列紧密,胞浆丰富透明,核分裂像常见(图3)。免疫组化:18例CD117、PLAP均表达阳性,14例D2-40表达阳性,5例P53表达阳性,3例TOPO-Ⅱ表达阳性,2例LCA表达阳性,1例GST-π表达阳性,Ki-67瘤细胞阳性率为30%~80%,其余无特殊。
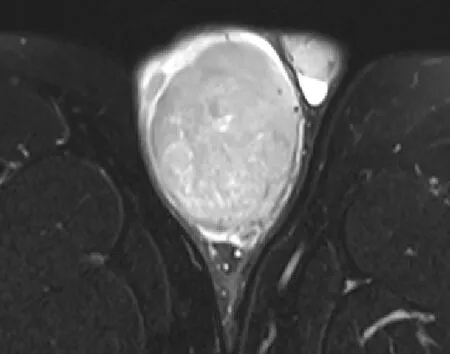
图1 右睾丸间变型精原细胞瘤伴条片状坏死
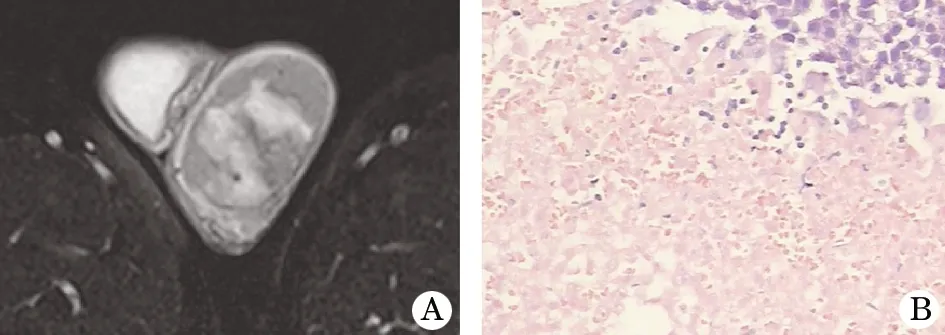
图2 左睾丸精原细胞瘤伴大片凝固性坏死
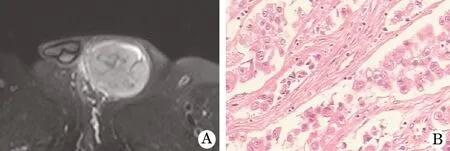
图3 左睾丸精原细胞瘤
2.2 临床表现 患者年龄24~64岁,平均38.6岁,位于右侧阴囊13例,左侧6例,主要表现为无明显诱因发现睾丸进行性肿大,5例有阴囊胀痛下坠感,轻触痛4例,无痛10例;触诊质硬表面结节感12例,表面光滑7例。1例患者一侧睾丸精原细胞瘤切除9年后对侧复发。
2.3 精原细胞瘤的MRI表现 19例睾丸精原细胞瘤MRI表现见表1,其中8例行MRI增强,肿瘤实质部分呈轻中度强化,坏死囊变区无强化,7例间隔强化明显(图4)。
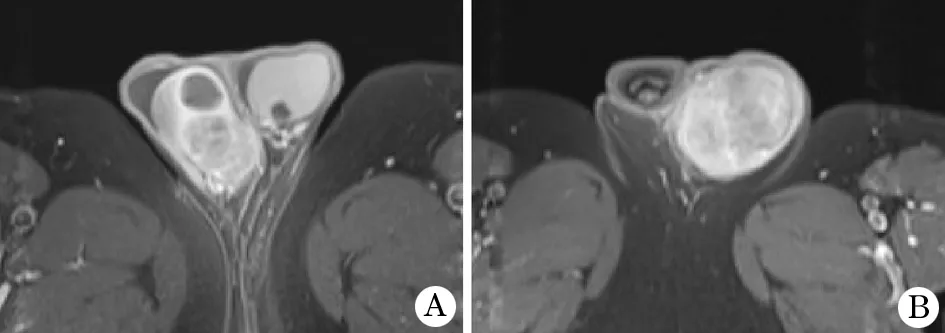
图4 睾丸精原细胞瘤MRI增强
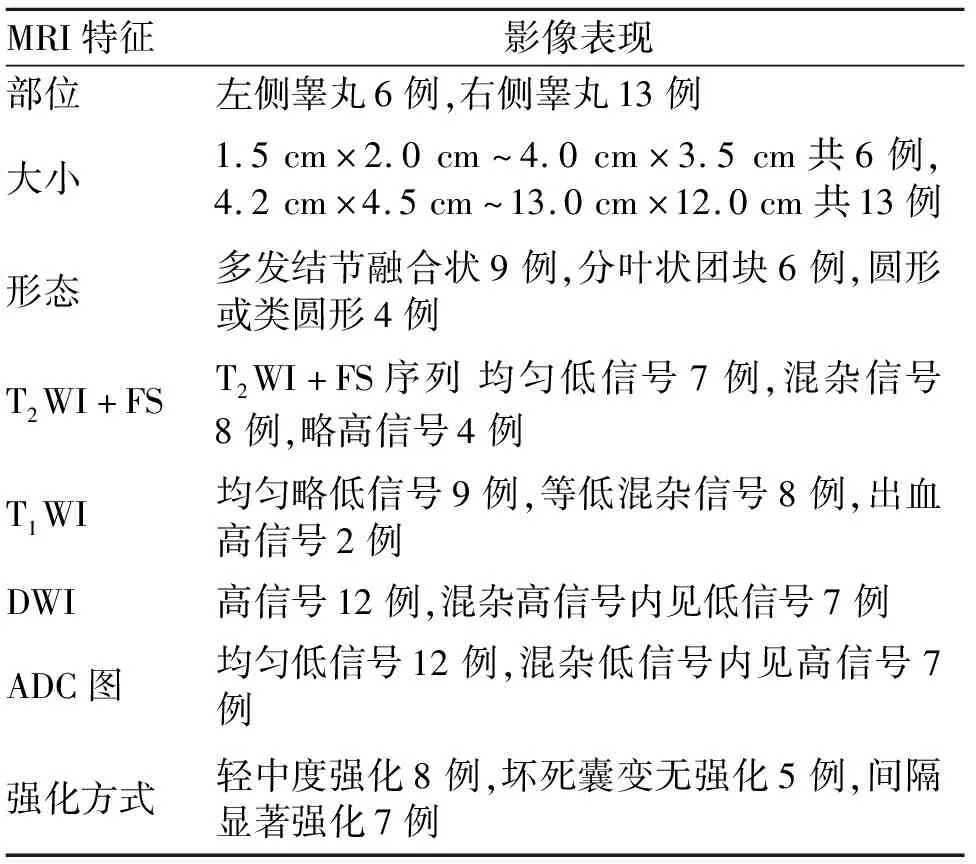
表1 19例睾丸精原细胞瘤的MRI表现
2.4 附睾、精索、睾丸鞘膜积液及转移情况 睾丸鞘膜积液7例,均呈淡黄色,附睾及精索未见累及,血管内瘤栓3例;术后常规检查发现右腹股沟淋巴结转移1例,后腹腔淋巴结转移4例,肝脏多发瘤转移1例。
3 讨 论
3.1 病因、病理表现及临床特点 精原细胞瘤是睾丸生殖细胞瘤最常见的肿瘤,占睾丸肿瘤的60%,好发于中青年男性[2],本组患者平均38.6岁,与文献[2]报道基本一致。临床研究发现,精原细胞瘤常单侧发生,发生于右侧睾丸51.5%,左侧睾丸46.2%,双侧睾丸同时发生仅占0.35%[3]。本研究发现,发生于右侧睾丸68.4%,1例间隔9年后对侧睾丸也发现精原细胞瘤,与上述报道略有差异。文献[4]发现,超过80%的精原细胞瘤患者无特异性症状,多以睾丸无痛性增大为主要表现,少数出现睾丸疼痛和下坠感。王晓阳等[5]认为,阴囊内精原细胞瘤多发生患侧睾丸鞘膜积液,患侧腹股沟管内血管多较对侧增粗;本研究发现,睾丸胀痛下坠感5例,轻触痛4例,患侧睾丸鞘膜积液7例,可能与本组睾丸肿块直径>4 cm病例较多和部分患者病程偏长引起慢性炎症或出血、坏死有关。Trevino等[6]认为,肿瘤的大小和血管是否侵犯是预测精原细胞瘤临床分期的主要依据,且肿瘤大于4 cm时转移风险增加。本组19例中,手术病理发现血管内瘤栓4例;术后常规检查发现右腹股沟淋巴结转移1例,后腹腔淋巴结转移4例,肝脏多发转移瘤1例,肿块均大于4 cm,与文献[6]报道基本一致。睾丸精原细胞瘤体检触诊多数肿块质硬、表面结节感,部分触诊表面光滑。
3.2 MRI影像表现及病理基础 精原细胞瘤一般为低度恶性肿瘤,本组19例精索及附睾切缘均阴性,主要表现为睾丸肿大,MRI表现以多发结节融合状及分叶状团块居多;如文泽军等[7]统计10例精原细胞瘤有8例呈多发结节状;本研究中有9例呈多发结节融合状,6例呈分叶状团块状,4例呈圆形或类圆形。结节融合分叶状病理基础为:肿瘤细胞排列成小巢状或不规则致密腺泡状,各个肿瘤组织趋向相互融合;结节融合分叶状可支持精原细胞瘤的诊断[8]。因精原细胞瘤巢细胞排列致密,含水量低于正常睾丸生精细胞,与正常睾丸高信号对比,肿瘤在T2WI+FS呈均匀低信号,部分病例可见条形更低信号纤维间隔;当肿瘤体积较大时可出现出血、坏死,增强扫描不均匀强化[9];本研究中6例睾丸肿块最大径≤4 cm,13例肿块最小径>4 cm,白膜均完整,伴有斑片状、大片凝固性坏死11例,出血2例。对照正常睾丸高信号,7例在T2WI+FS序列上呈均匀低信号,8例因肿块最小径>4 cm,内有出血、坏死呈以低信号为主的高低混杂信号,4例肿块最小径>6 cm,呈略高信号表现,与王岸飞等[10]报道的14例睾丸精原细胞瘤T2WI均表现均匀低信号有差异,可能与本组收集的睾丸肿块体积较大所占比例较高有关。肿瘤细胞密集,高b值弥散受限,DWI肿瘤实性部分呈高信号,ADC图呈低信号,本研究19例中,DWI呈高信号12例,呈高信号为主伴有斑片状低信号7例;ADC图呈低信号为主伴有条片状高信号7例,呈均匀低信号12例;8例行MRI增强后实性部分呈轻中度强化,坏死囊变区无强化,其中7例见分隔样强化,与文献[9]报道有差异,可能与本研究增强MRI检查病例较少有关,有待收集更多病例进行分析;也有研究认为纤维间隔强化是精原细胞瘤的特征性表现,其病理基础是肿瘤纤维血管间隔[11]。免疫组化提示精原细胞瘤恒定表达PLAP、CD-117,部分表达D2-40、P53,TOPO-Ⅱ;有研究证实,CD117对精原细胞瘤准确度可达80%,敏感性超过90%[12,13],本研究CD117、PLAP均表达阳性18例,D2-40表达阳性14例,P53表达阳性5例,TOPO-Ⅱ表达阳性3例;与上述文献报道基本一致。
3.3 鉴别诊断 精原细胞瘤需要与以下病变鉴别:(1)睾丸淋巴瘤。好发于60岁以上患者,肿块呈弥漫浸润性生长,累及整个睾丸,T1WI、T2WI 均呈稍低信号,轻度强化,无边缘及瘤内分隔样强化,可双侧同时或先后发病,常伴有睾丸鞘膜积液或附睾、精索受累,常伴发其他部位淋巴瘤。(2)睾丸畸胎瘤。儿童多见,MRI较具特征性的表现是肿瘤内含脂肪信号及囊性成分,CT可见钙化灶。(3)睾丸间质细胞瘤。可伴有激素内分泌症状,肿块常发生于睾丸的外周部位,边界清晰,周围有较多的正常睾丸组织,血供丰富,增强后显著强化[14]。(4)睾丸胚胎癌。青壮年多见,睾丸肿块生长迅速,体积巨大,瘤体无包膜,界限不清,常有灶性出血和坏死,密度或信号不均匀,常有小片状或条形钙化,扪及肿块质地坚硬,表面结节感,转移的淋巴结融合成团块状,出现远处转移早,精索及附睾常受累,伴有AFP及HCG肿瘤标志物显著增高。
综上所述,MRI无辐射,可多方位,多参数、多序列成像,已成为睾丸肿块影像检查的一个有效补充;睾丸肿块的术前诊断应根据肿块的大小、形态、边缘、信号特点、强化方式等综合分析,总结影像学表现与病理之间的关系,可提高睾丸肿块诊断的准确率;注重病理学诊断,及免疫组化检查。
