樟芝多糖通过ROS-NOX2-NLRP1信号减轻皮层神经细胞炎症损伤的作用研究
2021-02-28沈和平官俏兵郝亚南俞晓翔王云翟丽萍韩晨阳
沈和平 官俏兵 郝亚南 俞晓翔 王云 翟丽萍 韩晨阳
神经细胞损伤是大脑结构和功能改变的主要原因,而神经细胞损伤最终可以造成认知障碍,甚至发展为阿尔茨海默病、帕金森病等神经退行性疾病[1-2]。在这类疾病中,炎症因子的产生和释放是引起神经细胞损伤的主要原因。研究发现脂多糖(lipopolysaccharide,LPS)诱导后大脑皮质和海马组织中炎症因子的表达大量上调[3-4],此外,LPS 还可以进一步激活小胶质细胞。活性氧(reactive oxygen species,ROS)可以促进神经细胞炎症的产生,还可以进一步调节下游还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(NADPH oxidase 2,NOX2)的表达[5-6]。NOX2 可以调控中枢病理性氧化应激反应,ROS 通过NOX2 进一步促进炎性小体NLRP1激活,而神经细胞的炎症反应主是NLRP1 介导的[7-8]。因此,ROS-NOX2-NLRP1 轴在神经细胞炎症反应中有着重要的作用,也是炎症反应的重要靶点。在ROS 的研究中常用N-乙酰半胱氨酸(N-acetylcysteine,NAC)作为抑制剂。樟芝是一种多孔菌科真菌,也是一种食用/医用两用的真菌,其含有多种活性物质。前期研究发现樟芝多糖(antrodia camphorata polysaccharide,ACP)对于帕金森病,尤其是神经细胞有着良好的保护作用,其机制和炎症的调控有关[9-10]。神经细胞损伤是导致帕金森病的重要因素,所以进一步揭示ACP 抑制神经细胞炎症损伤的机制对于深入了解ACP 的药理作用有着重要的意义。本研究主要探讨ACP 通过抑制ROSNOX2-NLRP1 信号减轻CNC 炎症损伤的作用和机制。
1 材料和方法
1.1 细胞和试剂 小鼠皮层神经细胞(cortical neuron cell,CNC)(武汉普诺赛生命科技有限公司,批号:CPM143)及其完全培养基(武汉普诺赛生命科技有限公司,批号:CM-M143);细胞活力CCK-8 检测试剂盒(北京索莱宝科技有限公司,批号:CA1210);Annexin VFITC/PI 流式双染细胞凋亡检测试剂盒(北京索莱宝科技有限公司,批号:CA1220);ROS 检测探针DCFH-DA(北京索莱宝科技有限公司,批号:D6470);ELISA 检测试剂盒IL-1β、IL-6、TNF-α(南京建成生物工程研究所,批号:H002、H007、H052);LPS(美国Sigma 公司分装);NAC(中国MCE 公司,批号:HY-B0215);ACP(实验室自备,纯度95%以上)。
1.2 细胞分组及药物干预 CNC 用完全培养基培养,待细胞生长至对数期,融合70%~80%左右,将细胞用胰蛋白酶消化后分组。在研究ACP 抗炎症反应作用的实验中,将CNC 细胞分为对照组、LPS 组、ACP 5 mg/L组、ACP 10 mg/L 组和ACP 20 mg/L 组。对照组为常规培养的细胞,无LPS 和ACP 干预;LPS 组用0.1 mg/L LPS 诱导细胞炎症反应;ACP 各组分别使用终浓度为5、10、20 mg/L 的ACP 进行预处理6 h 后,再用0.1 mg/L LPS 诱导细胞炎症反应。在研究ACP 通过抑制ROS 发挥作用的机制研究中,将CNC 分为LPS 组、NAC 组和NAC+ACP 组。LPS 组用0.1 mg/L LPS 诱导细胞炎症反应;NAC 组用10 mM NAC 预处理4 h 后,再用0.1 mg/L LPS 诱导细胞炎症反应;NAC+ACP 组同时用10 mM NAC 和20 mg/L ACP 预处理4 h 后,再用0.1 mg/L LPS诱导细胞炎症反应。
1.3 细胞活力检测 采用CCK-8 法。将CNC 接种到96 孔板后,每组细胞设置3 个复孔(以下检测相同),待药物干预后,于0、3、6、12、24 h 进行细胞活力检测。将每孔培养基吸去后再加入100 μl 完全培养基,同时加入10 μl CCK-8 溶液,继续孵育4 h,待细胞染色后,在450 nm 处检测吸光度(OD)值,同时设置空白培养基为对照。细胞活力=(OD实验组-OD对照)/(OD初始-OD对照)×100%。
1.4 细胞凋亡水平检测 采用Annexin V-FITC/PI 双染后流式细胞术。将细胞接种到6 孔板中,干预12 h后,用0.25%胰蛋白酶消化,PBS 清洗后,2 000 r/min离心10 min,收集细胞后用预冷的PBS 重悬,再次2 000 r/min 离心10 min 后用Binding Buffer 进行悬浮,加入5 μl Annexin V-FITC 染色,避光15 h 后,用5 μl PI 染色5 min,上机检测。
1.5 细胞ROS 水平检测 采用DCFH-DA 探针。将细胞接种到6 孔板中,药物干预12 h 后弃去培养基。按照1∶1 000 的比例用无血清培养基稀释DCFH-DA 探针,每孔加入1 ml 的含DCFH-DA 探针的培养基,在培养箱中继续孵育30 min。弃去培养基,用无血清培养基洗涤细胞2 次。荧光显微镜下观察细胞染色水平,同时检测荧光光度值。
1.6 细胞NOX2、NLRP1 蛋白表达水平检测 采用Western blot 法。药物干预12 h 后收集细胞,PBS 洗2次后加入1.0 ml 的RIPA 裂解液在冰上裂解30 min,10 000 g 转速下离心15 min,取上清液进行BCA 试剂盒的蛋白定量检测。根据分子量不同分别配置8%~12% SDS-PAGE 凝胶,取蛋白液后用5×loading buffer补充体积至20 μl,煮沸8 min 后,80 V 电压进行电泳,之后转换为120 V 电压继续电泳。将凝胶去除后进行PVDF 膜的转膜,采用300 mA 恒流转膜0.5~2 h,PVDF 膜使用5%脱脂奶粉封闭2 h,TBST 稀释一抗,NOX2、NLRP1 的一抗稀释比例分别为1∶500、1∶500、1∶600,一抗孵育后PVDF 膜用TBST 洗2 次后,用辣根过氧化物酶标记的山羊抗兔二抗孵育,二抗稀释比例为1∶2 000。孵育完成后用化学发光法检测,采用Image Pro-Plus 6.0 软件进行光密度的分析,以GAPDH 为内参,结果以目的蛋白与内参蛋白光密度值比值表示。
1.7 细胞IL-1β、IL-6 和TNF-α 表达水平检测 根据试剂盒说明书进行标准曲线的测定。CNC 分组培养,在ACP 干预12 h 后收集细胞培养基,培养基在2 000 r/min 离心15 min,除去细胞碎片和悬浮细胞,取上清液,参照ELISA 检测试剂盒说明书检测,利用测定的标准曲线计算细胞因子水平。
1.8 统计学处理 采用SPSS 17.0 统计软件。计量资料以表示,组间比较采用单因素方差分析,两两比较采用Bonferroni 校正的t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 ACP 对于LPS 诱导下CNC 细胞活力的影响 0 h时5 组细胞活力比较差异无统计学意义(P >0.05);而LPS 干预后,与对照组同一时间点比较,LPS 组细胞活力均明显下调(均P<0.05);而ACP 干预后,与LPS 组同一时间点比较,ACP 10 mg/L 组和ACP 20 mg/L 组细胞活力均明显上调(均P<0.05);且随着ACP 浓度的升高,细胞活力明显上调(P<0.05),见图1。
2.2 ACP 对于LPS 诱导下CNC 细胞凋亡的影响 对照组、LPS 组、ACP 5 mg/L 组、ACP 10 mg/L 组和ACP 20 mg/L 组细胞凋亡率分别为(6.43±0.65)%、(58.65±5.54)%、(38.76±4.55)%、(28.65±3.65)%和(18.65±3.11)%。LPS 干预后,与对照组比较,LPS 组细胞凋亡率明显上调(P<0.05);而ACP 干预后,与LPS 组比较,ACP 5 mg/L 组、ACP 10 mg/L 组和ACP 20 mg/L 组细胞凋亡率均下调(均P<0.05);且随着ACP 浓度的升高,细胞凋亡率明显下调(P<0.05),见图2。
2.3 ACP 对于LPS 诱导下CNC 中ROS 产生及NOX2、NLRP1 蛋白表达的影响 对照组、LPS 组、ACP 5 mg/L组、ACP 10 mg/L 组和ACP 20 mg/L 组细胞中ROS 的荧光光度值分别为0.03±0.01、0.27±0.08、0.18±0.06、0.11±0.03、0.07±0.01。与LPS 组比较,ACP 5 mg/L 组、ACP 10 mg/L 组和ACP 20 mg/L 组细胞中ROS 的荧光光度值均降低(均P<0.05);且随着ACP 浓度的升高,细胞中ROS 的荧光光度值明显降低(P<0.05),见图3(插页)。与对照组比较,LPS 组NOX2 和NLRP1 蛋白表达水平均升高(均P<0.05);经ACP 干预后,与LPS 组比较,ACP 5 mg/L 组、ACP 10 mg/L 组和ACP 20 mg/L 组NOX2和NLRP1 蛋白表达水平均降低(均P<0.05),见图4。

图1 樟芝多糖(ACP)对于脂多糖(LPS)诱导下皮层神经细胞(CNC)细胞活力的影响(与对照组同一时间点比较,*P<0.05;与LPS 组同一时间点比较,△P<0.05)

图2 樟芝多糖(ACP)对于脂多糖(LPS)诱导下皮层神经细胞(CNC)细胞凋亡的影响

图4 樟芝多糖(ACP)对于脂多糖(LPS)诱导下皮层神经细胞(CNC)中NADPH 氧化酶2(NOX2)、NLRP1 蛋白表达的影响(a:各组细胞NOX2 和NLRP1 蛋白表达的电泳图;b:各组细胞NOX2和NLRP1 蛋白表达水平比较,与对照组比较,*P<0.05;与LPS 组比较,△P<0.05)
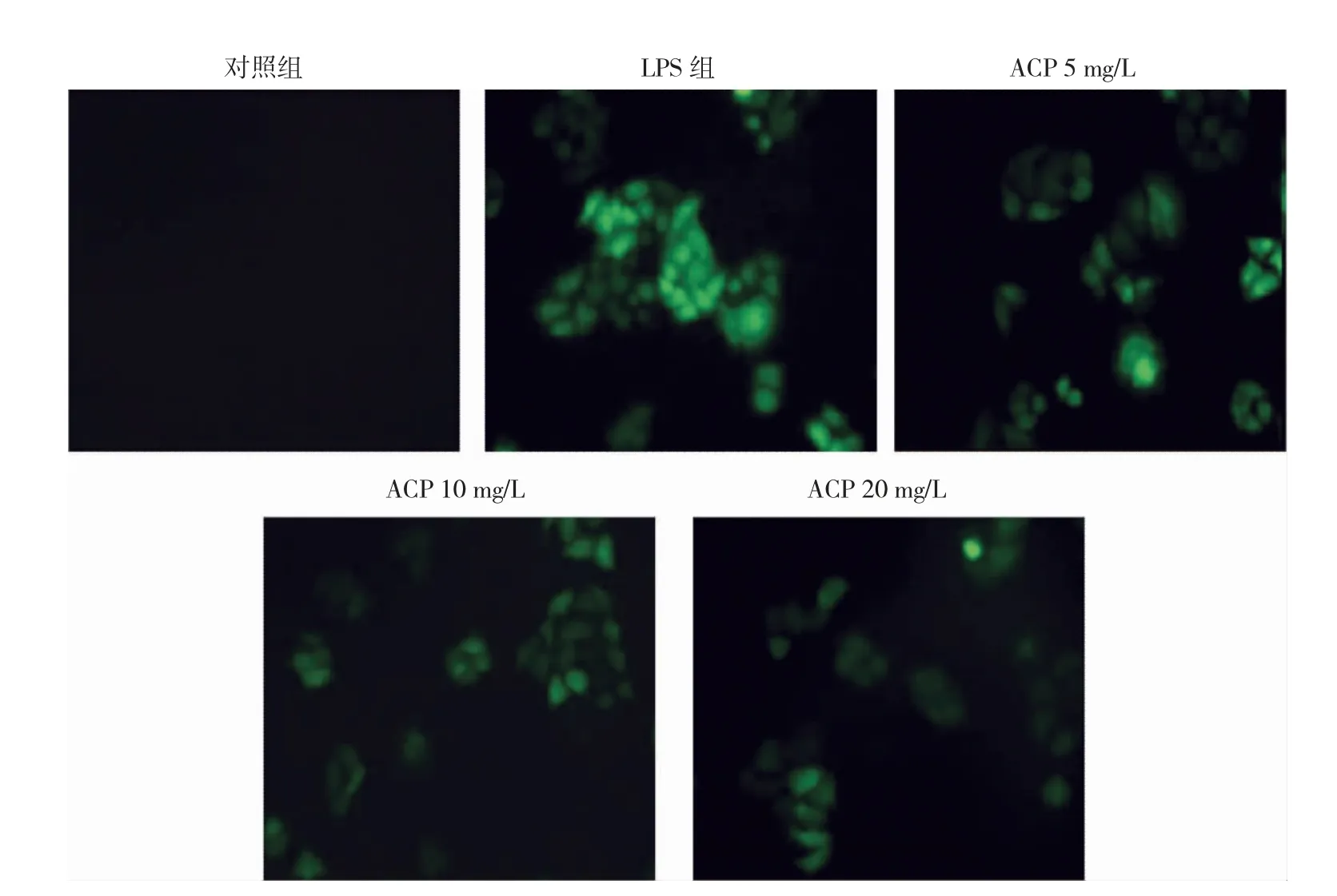
图3 樟芝多糖(ACP)对于脂多糖(LPS)诱导下皮层神经细胞(CNC)中活性氧(ROS)的产生的影响
2.4 ACP 对于LPS 诱导下CNC IL-1β、IL-6 和TNF-α水平的影响 与对照组比较,LPS 组IL-1β、IL-6 和TNF-α 水平均升高(均P<0.05);经ACP 干预后,与LPS组比较,ACP 5 mg/L 组、ACP 10 mg/L 组和ACP 20 mg/L组IL-1β、IL-6 和TNF-α 水平均降低(均P<0.05);且随着ACP 浓度的升高,IL-1β、IL-6 和TNF-α 表达水平均下降(均P<0.05),见图5。

图5 樟芝多糖(ACP)对于脂多糖(LPS)诱导下皮层神经细胞(CNC)IL-1β、IL-6 和TNF-α 水平的影响(与对照组比较,*P<0.05;与LPS 组比较,△P<0.05)
2.5 NAC 抑制ROS 后,ACP 对于CNC 细胞凋亡的影响 LPS 组、NAC 组和NAC+ACP 组细胞凋亡率分别为(56.98±6.54)%、(28.54±4.23)%和(24.63±3.65)%。与LPS 组比较,NAC 组和NAC+ACP 组细胞凋亡率均下调(均P<0.05);而NAC 组和NAC+ACP 组细胞凋亡率比较差异无统计学意义(P >0.05),见图6。
2.6 NAC 抑制ROS 后,ACP 对于ROS 产生及NOX2、NLRP1 蛋白表达的影响 LPS 组、NAC 组和NAC+ACP组细胞中ROS 的荧光光度值分别为0.30±0.04、0.07±0.01、0.06±0.01。与LPS 组比较,NAC 组和NAC+ACP 组细胞中ROS 的荧光光度值均降低(均P<0.05);而NAC和NAC+ACP 组细胞中ROS 的荧光光度值比较差异无统计学意义(P >0.05),见图7(插页)。与LPS 组比较,NAC 组和NAC+ACP 组NOX2 和NLRP1 蛋白表达水平均降低(均P<0.05);而NAC 组和NAC+ACP 组NOX2 和NLRP1 蛋白表达水平比较差异均无统计学意义(均P >0.05),见图8。
2.7 NAC 抑制ROS 后,ACP 对于CNC IL-1β、IL-6 和TNF-α 水平的影响 与LPS 组比较,NAC 和NAC+ACP组IL-1β、IL-6 和TNF-α 表达水平均降低(均P<0.05);而NAC 组 和NAC+ACP 组IL-1β、IL-6 和TNF-α 表达水平比较差异均无统计学意义(均P >0.05),见图9。
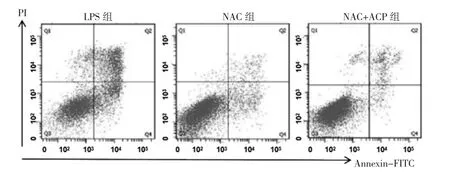
图6 N-乙酰半胱氨酸(NAC)抑制活性氧(ROS)后,樟芝多糖(ACP)对于皮层神经细胞(CNC)细胞凋亡的影响(LPS 为脂多糖)
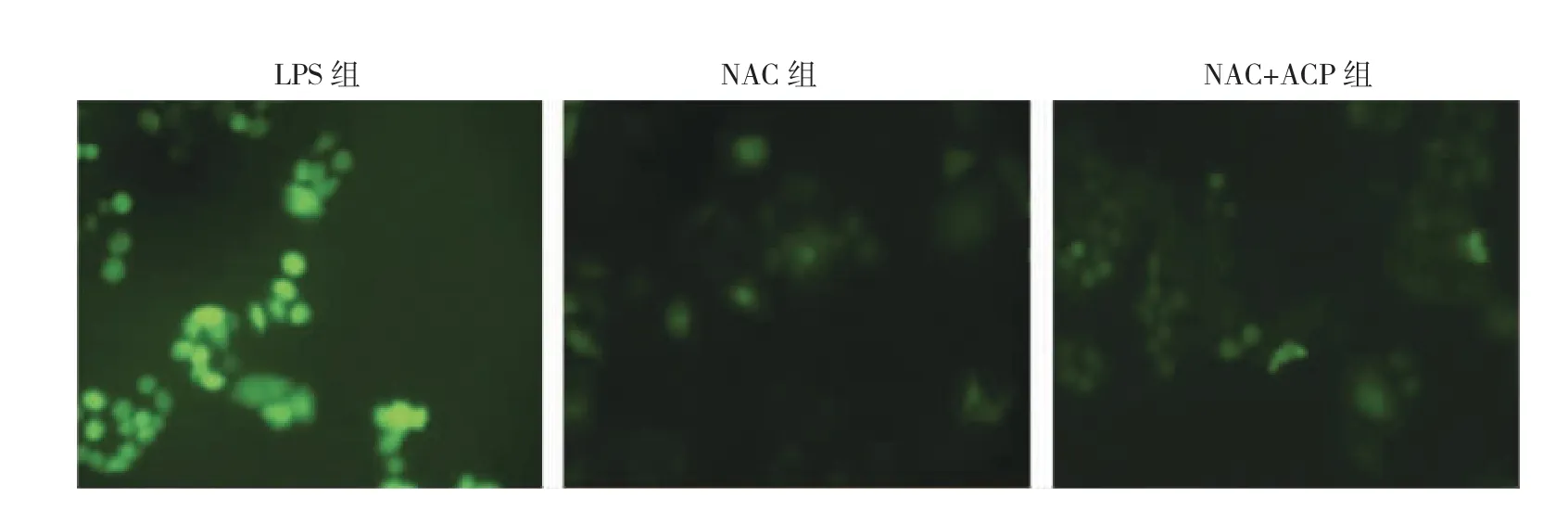
图7 N-乙酰半胱氨酸(NAC)抑制活性氧(ROS)后,樟芝多糖(ACP)对于ROS 产生的影响(LPS 为脂多糖)
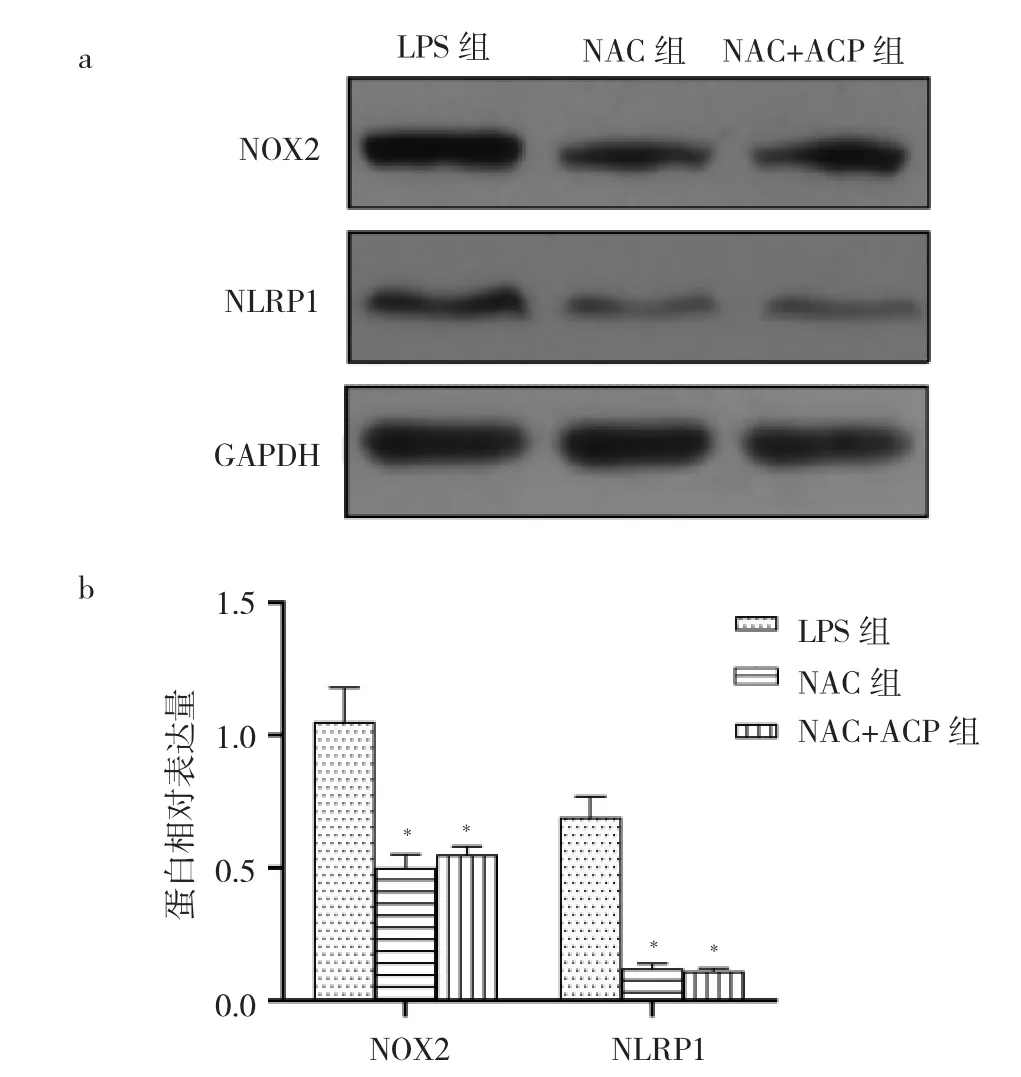
图8 N-乙酰半胱氨酸(NAC)抑制活性氧(ROS)后,樟芝多糖(ACP)对于NADPH 氧化酶2(NOX2)、NLRP1 蛋白表达的影响[a:各组细胞NOX2 和NLRP1 蛋白表达的电泳图;b:各组细胞NOX2 和NLRP1 蛋白表达水平比较,与脂多糖(LPS)组比较,*P<0.05]

图9 N-乙酰半胱氨酸(NAC)抑制活性氧(ROS)后,樟芝多糖(ACP)对于皮层神经细胞(CNC)IL-1β、IL-6 和TNF-α 水平的影响[与脂多糖(LPS)组比较,*P<0.05]
3 讨论
神经细胞损伤是多种类型神经系统疾病的重要事件,在阿尔茨海默病、帕金森病、多发性硬化症以及脑缺血疾病中,神经细胞损伤都可以造成中枢不可逆转的伤害,而在损伤的机制研究中,氧化应激、线粒体功能损伤、慢性炎症等都可以造成神经细胞的损伤[11-12]。ROS 目前被认为是氧化损伤的重要因素。ROS 是正常的代谢产物,其中包括超氧阴离子、羟基自由基以及氧自由基等。细胞的ROS 主要有外源性和内源性两种,内源性ROS 主要由线粒体呼吸链NOX 系统产生[13]。线粒体作为ROS 的主要来源,可以产生大多数ROS。线粒体电子传递链主要由烟酰胺腺嘌呤二核苷酸酶、琥珀酸氧化还原酶、细胞色素C 还原酶等构成。NOX 是一种跨膜的酶复合物,其中NOX2 主要表达于吞噬细胞、神经细胞以及心机细胞[14-15]。在人的神经组织,包括海马区、脊髓、皮质区等都有NOX2 的表达。NOX2 在正常生理环境下保持动态平衡,而接受外界信号后可以迅速产生ROS,造成细胞内NOX2 浓度的升高,ROS增高主要可以介导炎症反应的发生[16-17]。ROS 主要可以通过酪氨酸磷酸化系统、转录因子家族、丝裂原活化蛋白激酶等刺激炎症的产生。目前ROS 被认为可以激活炎性小体的产生。NLRP1 是一种炎性小体,主要包括感受器NLRP1、凋亡相关斑点样蛋白以及效应蛋白Caspase-1,3 种蛋白相互作用形成高分子的蛋白复合体,激活Caspase 加速,迅速进行炎症因子IL-1β、IL-6的切合,并释放到细胞外。研究发现NLRP1 在神经细胞损伤中发挥着重要的作用[18]。
ACP 是一种复合的多糖类化合物,课题组前期的研究中已经发现ACP 对于帕金森病等有着良好的治疗效果,其作用和炎症因子的调控有关[9-10]。而本研究主要以CNC 为对象,深入研究了ACP 的作用,结果发现LPS 诱导的神经细胞炎症模型中,ROS-NOX2-NLRP1 轴是激活的,ROS 水平迅速上调,可以诱导下游NOX2 和NLRP1 激活,这是神经细胞炎症反应的主要信号轴。而ACP 干预后,可以抑制ROS 的产生,探针检测结果也显示,ROS 荧光光度值下调,而NOX2 和NLRP1 蛋白表达也下调。虽然ACP 的干预抑制了ROS-NOX2-NLRP1轴,可以使细胞活力上调,细胞凋亡水平和炎症因子表达水平下调。但还需要进一步研究ACP 的具体作用机制,所以笔者采用NAC 进行处理。NAC 是一种ROS 的特异性抑制剂,可以抑制ROS 的产生。在此基础上将NAC 和ACP 联用,结果显示NAC 可以抑制ROS 的产生,从而抑制NOX2 和NLRP1 的激活。但是NAC 和ACP联用后,对比单一NAC 未见统计学差异。因此,笔者推测ACP 主要抑制了ROS 的产生,从而抑制下游NOX2-NLRP1 轴,改善了神经细胞的炎症损伤。
综上所述,ACP 可以通过抑制ROS 的表达抑制NOX2-NLRP1 激活,从而减轻CNC 的炎症反应。
