先天性子宫畸形临床表现与超声诊断
2021-02-28鲁红
鲁红
先天性子宫畸形(congenital uterine anomaly,CUA)在人群中患病率差异较大,约为0.16%~10%,其在自然流产和不孕女性中可高达24.5%[1-2]。子宫畸形分类和诊断命名尚无公认的分类系统,目前美国生殖协会(American Fertility Society,AFS)1988 年的苗勒管缺陷分类系统认可度较高。CUA 可能引起一些症状,例如月经初潮开始,出现周期性盆腔痛或非周期性慢性盆腔痛、异常出血、反复妊娠丢失或早产等,在有这些病症的女性中应注意子宫畸形的发生。也有一些患者并无症状,查体时或常规超声检查时偶尔发现CUA,但潜在影响依然存在。了解女性生殖道的胚胎发育、CUA 的命名和诊断标准,精准诊断CUA,将对CUA 的治疗有帮助。本文从CUA 的发病机制、临床表现及不良后果、近年来CUA 分类和命名的国内外标准以及超声诊断的影像学特征等作一评述。
1 女性内生殖系统发育及CUA 的发病机制
正常子宫发育最早可在妊娠6 周左右识别出苗勒管(Müller 管,也称副中肾管),此时两侧苗勒管开始向尾侧延伸,并向内越过后肾管,以使两侧苗勒管在正中线融合。至第7 周时,尿直肠隔已经形成,其将直肠从尿生殖窦中分离出来。约12 周时,苗勒管的尾侧部融合形成子宫阴道管,后者嵌入苗勒管结节处的尿生殖窦背侧壁。两侧苗勒管最初由实质性组织构成,并列排列。随后,两个苗勒管的内部分别腔道化,产生两个由隔膜分开的管道,此隔膜在截止妊娠20 周被吸收,吸收方向自下而上朝向头端。苗勒管未融合的颅侧部分发育为输卵管及其伞部,而尾端融合部分则形成子宫和阴道上段。至此,女性胎儿内生殖系统基本形成。
女性生殖系统与泌尿系统在胚胎起源上均起源于胚胎中胚层的间介中胚层成分,故生殖系统的发育异常常合并泌尿系统的发育异常。有文献表明,约10%的泌尿系统发育异常患者伴有生殖系统发育异常[3]。因此,妇产科医生在诊治女性生殖道畸形患者的同时一定要考虑是否伴有泌尿系统的异常。
子宫畸形女性的核型通常正常(92%的女性为46,XX)。但子宫畸形的基础病因很可能与多个基因相关且涉及多种原因,故其尚不明确。
依其胚胎发育特征,CUA 主要有三大类。
1.1 苗勒管发育不良 一是先天性无子宫,因双侧苗勒管形成子宫段未融合,退化所致,常合并无阴道;卵巢发育正常。二是始基子宫,双侧苗勒管融合后不久即停止发育,子宫极小,多数无宫腔或为一实体肌性子宫;无子宫内膜;卵巢发育可正常。三是幼稚子宫,双侧苗勒管融合形成子宫后发育停止所致,有子宫内膜。卵巢发育正常。
苗勒管缺如或发育不全导致不同程度的子宫发育异常合并无阴道,称为MRKH 综合征。形成的子宫可能包括侧向半子宫或子宫角(如单角子宫)、无宫颈的中线子宫。
1.2 苗勒管侧向融合缺陷 侧向融合缺陷导致器官发育呈对称性或非对称性、非梗阻性或梗阻性,例如双侧苗勒管融合不良所致的双角子宫、双侧苗勒管未融合所致的双子宫和双侧苗勒管融合后,纵隔吸收受阻所致的纵隔子宫。
1.3 苗勒管纵向融合缺陷 纵向融合缺陷起因于苗勒管尾端和尿生殖窦融合缺陷,或者起因于阴道管道形成缺陷,导致形成阴道横隔、节段性阴道缺如和(或)宫颈缺如或发育不良。阴道和(或)宫颈可能梗阻或不梗阻。此大类主要造成阴道畸形,暂不在此文讨论。
2 CUA 的临床表现及不良后果
非妊娠女性的CUA 完全阻塞或部分阻塞月经血时,例如非交通性功能性子宫角、重复子宫伴一侧阴道梗阻、子宫纵隔一侧阴道梗阻,就会造成下列后果:子宫积血(血液充填宫腔)、阴道积血(血液充填阴道)、经血逆流和发生子宫内膜异位症、周期性或非周期性盆腔痛、子宫异常出血或分泌物异常、生殖道感染。
CUA 通常不会妨碍自然受精和体外受精后的受孕和着床。但不同类型子宫畸形会导致不同潜在不良后果。如单角子宫女性发生子宫内膜异位症、早产和胎儿臀先露的风险较高。一项回顾性研究探讨了单角子宫女性的妊娠结局,结果显示产科并发症发生率如下:异位妊娠率为2.7%,早期妊娠流产率为24.3%,中期妊娠流产率为9.7%,早产率为20.1%,胎死率为3.8%,活产率为51.5%[4]。梗阻或残存的宫角妊娠可致子宫破裂和(或)胎盘附着异常,例如粘连性胎盘、植入性胎盘和穿透性胎盘[5]。自发破裂以及与临产或引产有关的破裂均已有报道。此类妊娠应早期诊断后立即终止妊娠。
妊娠女性CUA 可致下列后果:自然流产或反复自然流产、早产、宫内生长受限、产前和产后出血、胎盘附着异常、宫颈功能不全、胎先露异常、妊娠相关高血压、剖宫产、残角子宫破裂等。胎先露异常及所致剖宫产可能与畸形子宫的小宫腔有关。宫内生长受限可能与子宫脉管系统异常有关。产后出血的原因可能是胎盘部分嵌入一个附属宫角内或胎盘附着异常。妊娠相关高血压归因于共存的先天性肾脏畸形。妊娠丢失可能起因于胚泡着床位置不佳,例如着床于隔等。
3 CUA 的分类和命名
子宫畸形是常见的女性生殖系统发育异常,种类复杂多样,有多个分类系统,标准不一,部分女性生殖器官畸形的命名也不统一,存在着一病多名的现象。临床上比较认可的分类方法是AFS 1988 年的苗勒管缺陷分类系统以及欧洲人类生殖与胚胎学会(European Society of Human Reproduction and Embryology,ESHRE)和欧洲妇科内镜学会(European Society for Gynaecological Endoscopy,ESGE)已发布的分类系统。
AFS 分类系统[6]由Buttra 等于1979 年首先提出,是基于苗勒管发育过程中异常的分类系统,后被AFS 采纳并于1988 年进行修订。根据苗勒管发育异常的发生阶段不同将子宫畸形分成7 种类型(图1)。该分类简单明了,是最早获得全球共识、应用广泛且使用最久的分类系统。
ESHRE/ESGE[7]成立专门CUA 工作组并达成共识,以女性生殖系统解剖为基础,也将最常见的子宫畸形分成7 个主型,各主型根据临床意义分为不同亚型,并按严重程度从轻到重进行排序,畸形程度越轻位置越靠前,程度越重位置越靠后。宫颈和阴道的畸形根据其临床意义又单独分为不同亚型(图2),能够更加全面客观地对生殖系统畸形进行分类,也弥补了AFS 系统对宫颈和阴道畸形的描述不够细致的缺陷。但鉴于其应用时间较短,临床价值仍待进一步研究。
中华医学会妇产科学分会在2015 年8 月通过回顾性分析近10 年的相关中文文献,对一些重要的、容易产生歧义的命名提出了统一的意见,发布了“女性生殖器官畸形统一命名和定义的中国专家共识”[8],如:对“子宫纵隔、子宫纵膈、子宫中隔”称谓建议使用“子宫纵隔”。理由:“膈”特指膈肌,是分隔胸、腹两腔的膜状肌肉。在古文字中,小篆“肉”和“月”的写法极其相近,因此在用作偏旁时就都写成了“月”,如肝、胆、肺、脾等均为人体较大的器官。而“隔”是取“隔膜”“分隔”之意。英文为“septate”,为“分隔”之意。建议废除“子宫中隔”。对一些易混淆的子宫畸形的定义进一步明确,如弓形子宫;各文献中的常见对弓形子宫定义为:子宫外形基本正常,宫底外形无切迹,宫腔底部内膜呈弧形内凹,内凹深度一般<1 cm,两侧内膜夹角>90°(图3)。因弓形子宫在子宫输卵管造影中宫底呈较宽的马鞍形凹陷。过去又称“鞍状子宫”。中华医学会妇产科学分会共识建议废除“鞍状子宫”。

图2 欧洲人类生殖与胚胎学会(ESHRE)和欧洲妇科内镜学会(ESGE)分类系统

图3 弓形子宫(a:弓形子宫示意图:外形基本正常,宫腔底部内膜呈弧形内凹,内凹深度<1 cm,两侧内膜夹角>90°;b:弓形子宫三维超声图)
4 CUA 的诊断方法
子宫畸形的诊断应综合临床病史、妇科检查,并充分利用各种辅助检查方法,如二维超声检查、三维超声检查,甚至MRI 检查及内镜检查。但也有部分子宫畸形是在影像学检查评估妇科问题或妊娠不良结局时偶然发现,例如不孕症患者、盆腔肿块、盆腔痛或反复妊娠丢失时;或者评估肾脏异常、骨骼异常、腹壁异常或有腹股沟疝病史的女性常规妇科超声检查时发现。
辅助检查均应以能够客观体现女性生殖道解剖状态的诊断模型为基础,能提供以下解剖结构客观的、可测量的信息:(1)阴道;(2)宫颈;(3)子宫腔;(4)子宫壁;(5)子宫外廓;(6)其他腹膜内结构。
据报道,各检查措施的总体的诊断准确性为:三维超声(97.6%),宫腔超声造影(96.5%),二维超声(86.6%),子宫输卵管超声造影检查(86.9%)[6]。MRI 检查可准确地将85.8%的畸形患者分为各个亚型。可见经阴道的三维超声检查准确性较高,相对便捷、可重复,甚至比MRI在畸形的亚型分类方面更为准确。
4.1 妇科检查 妇科双合诊,必要时三合诊检查是每一例患者就诊后,诊断前必须经历的基础性检查。在原发闭经的患者,应仔细检查外阴,看是否有处女膜闭锁。仔细检查阴道,避免因仅进入双阴道腔中的一腔而漏诊阴道纵隔患者。使用窥具仔细检查阴道穹窿,明确单宫颈或双宫颈。对于周期性盆腔痛、合并或不合并原发闭经的患者,仔细触诊是否有经血聚集激发的可触及的包块(阻塞性)。
4.2 二维超声检查 超声检查作为对子宫畸形有较高诊断准确性的一项检查,二维超声是其基础。已婚妇女建议行经阴道超声检查;未婚女性或阴道堵塞或狭窄的患者,经患者同意后,用阴道探头行经直肠(或会阴)超声,来评估阴道腔及子宫状态,利用探头较高的频率增加观察器官的分辨率。推荐在月经中期或黄体期进行超声检查,因为在晚期增殖期或分泌期时,内膜线清晰,内膜回声与子宫肌层回声有较大差异,可精确显示宫腔的影像学形态。应系统、连续采集从子宫一侧边界至另一侧边界(若可能,同时包括宫颈和宫体)的矢状切面,以及从宫颈至宫底以上的横切面。
4.3 三维超声检查 三维超声可轻易获得二维超声无法获得的子宫冠状面影像,从而增强子宫显像,尤其是宫腔形态的显示,提高了诊断子宫异常的能力,并可在冠状切面上测量宫角间距、宫底凹陷深度、纵隔宽度等,为子宫畸形的诊断提供更多信息,其临床应用价值媲美MRI。在用二维超声对子宫进行全面评估后,三维超声重建的子宫冠状面图像可清晰显示宫腔及子宫外轮廓、输卵管的开口以及结合带。正常子宫宫腔呈等腰或等边三角形,双侧宫角锐利,三边光滑流畅,延至宫颈管,内膜结合带完整(图4)。
4.4 子宫输卵管超声造影检查 对于部分内膜菲薄,内膜与肌层分界不明显的患者,或者可以选择子宫输卵管宫腔造影检查,利用膨宫液扩张宫腔后在用三维超声检查显示子宫腔冠状切面,诊断子宫畸形。
5 常见子宫畸形三维超声声像特征及鉴别要点
5.1 幼稚子宫 超声可见宫腔和内膜,但宫腔小,宫颈和宫体比例1∶1 或2∶1。
5.2 单角子宫和残角子宫 仅一侧苗勒管正常发育,另一侧苗勒管完全未发育,正常侧形成单角子宫,有同侧的卵巢和输卵管,对侧缺如。单角子宫三维超声子宫冠状切面上宫腔内膜呈朝向一侧的立体羊角状单角,一侧宫角缺如(图5)。如另一侧苗勒管不是缺如,而是下端发育缺陷,则形成单角子宫和发育缺陷侧的残角子宫。故发现单角子宫时,应仔细评估对侧有无残角子宫。残角子宫大多无宫腔,无内膜,仅为一实心组织(图6)。也有少部分残角子宫有宫腔,有内膜,随月经周期内膜剥脱出血,残角子宫宫腔可以和单角子宫相通也可以不相通。
5.3 双角子宫 双角子宫形态显著特征就是宫底浆膜层凹陷,三维超声能同时显示宫底外部(浆膜面)和内部(宫腔)轮廓(图7),冠状切面宫底浆膜层有切迹>1 cm 明显凹陷,子宫两侧各有羊角状突出,宫腔呈蝶翅样。根据宫底凹陷是否达到宫颈内口,双角子宫分为完全双角子宫和不全双角子宫,完全双角子宫阴道和宫颈也大都正常(常有1 个宫颈)。
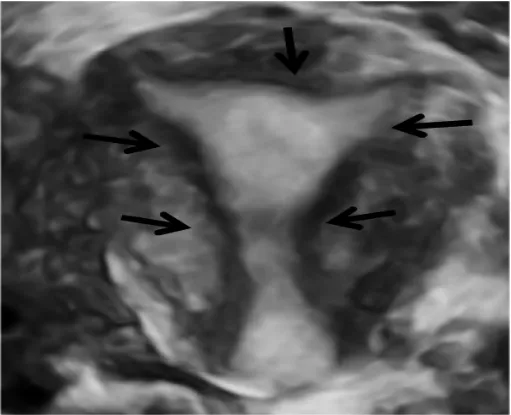
图4 正常子宫:宫腔呈流畅等腰,双侧宫角锐利,低回声内膜结合带完整(箭头处)

图5 单角子宫:子宫冠状切面上宫腔内膜呈朝向一侧的立体羊角状单角,一侧宫角缺如
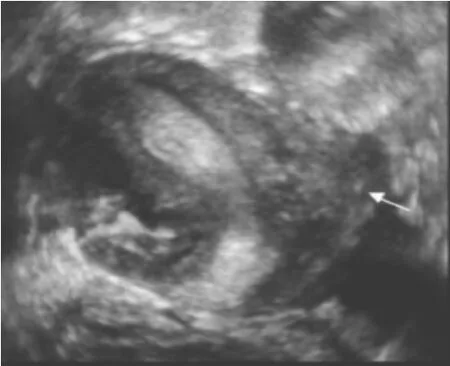
图6 残角子宫:单角子宫合并左侧残角子宫(箭头处)
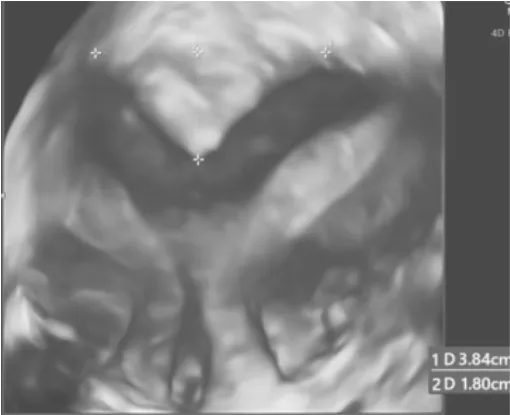
图7 完全双角子宫,见宫底浆膜层凹陷1.8 cm,宫腔呈“蝶翅样”宫底凹陷达到宫颈外口
5.4 双子宫 双子宫是生殖结构的重复畸形。一般而言,重复仅限于子宫和宫颈(双子宫和双宫颈),但重复也可能发生于外阴、膀胱、尿道、阴道和肛门。三维超声冠状切面显示2 个子宫完全分开,有独立的内膜,外形规则的宫壁和宫颈,双宫腔呈“双香蕉征”,两个宫体大小一致,两个子宫间见间隙。
5.5 纵隔子宫 纵隔子宫是最常见的子宫畸形,在所有已识别的子宫畸形中占35%~90%,其中又以不全纵隔子宫更为常见。三维超声冠状切面上子宫外形和正常子宫相似,宫底较宽,宫底无凹陷或有轻微凹陷≤1.0 cm。三维超声可以显示子宫冠状切面宫底部突向宫腔的肌性组织纵隔末端位置。纵隔严重程度差异很大,根据纵隔末端不同位置诊断完全纵隔子宫畸形或不全纵隔子宫(图8)。完全纵隔子宫可见纵隔末端到达或超过宫颈内口,有时纵隔末端终止在宫颈外口,外观似双宫颈。不全纵隔子宫可见纵隔末端终止在内口以上水平任何部位,但纵隔长度>1 cm,宫腔呈“Y”型。
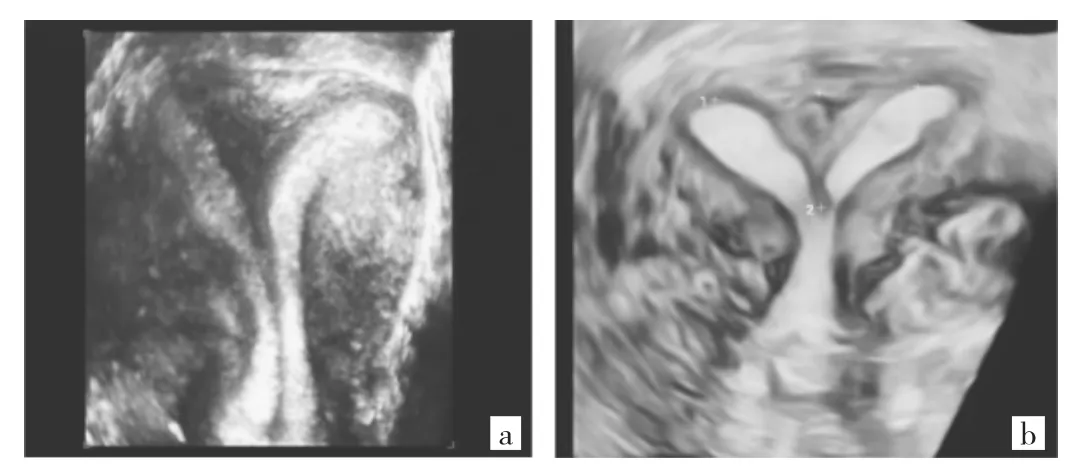
图8 完全纵隔子宫和不全纵隔子宫(a:完全纵隔子宫,纵隔末端终止在宫颈外口,外观似双宫颈,宫底形态正常;b:不全纵隔子宫,纵隔末端终止在宫颈内口上方,宫腔呈“Y”型)
5.6 “T”型宫腔 子宫外形正常,三维超声显示宫腔呈“T”型(图9),该类型子宫宫腔发育不全,容积狭小,妊娠后易流产。

图9 “T”型宫腔
5.7 弓形子宫 子宫外形基本正常,宫底外形无切迹,宫腔底部内膜呈弧形内凹,内凹深度一般<1.0 cm,两侧内膜夹角>90°(图3)。弓形子宫通常归类为正常变异型。
6 小结
超声检查作为一种实体成像技术,尤其是三维超声检查因其显示子宫的冠状切面的优势,被广泛应用于子宫畸形的诊断。但超声检查是一项依赖于操作者的技术,只有在指导下获得大量正常和异常检查经验,才能达到较高的技术水平。同时,也要熟悉生殖道各部分的评估和分类方法,发现和评估生殖道以外(包括泌尿系、肛肠、骨骼以及神经系统等)的畸形,才能在检查时做到首先的“心到”然后的“切面到”和“诊断到”。
